Funktionelle nuklearmedizinische Bildgebung in der Demenzdiagnostik
Schätzungsweise 130.000 Personen in Österreich leiden an einer Form der Demenz (Österreichischer Demenzbericht 2014, Bundesministerium für Arbeit, Soziales, Gesundheit und Konsumentenschutz). Basierend auf der demografischen Entwicklung soll sich diese Zahl bis 2050 verdoppeln.1
Nach ICD werden die Demenz bei Alzheimer-Krankheit (DAT), die vaskuläre Demenz (VD), die gemischte Demenz, die frontotemporale Demenz (FTD), die Demenz bei Morbus Parkinson sowie die Demenz mit Lewy-Körperchen (DLB) beschrieben. Die häufigsten Demenzerkrankungen sind dabei mit ~ 50–70 % die Alzheimer-Demenz und mit ~ 15–25 % die vaskuläre Demenz.
Im Rahmen der leitliniengerechten Demenzdiagnostik nimmt die zerebrale Bildgebung mittels cCT oder cMRT – neben internistisch/neurologischer Untersuchung, neuropsychologischer Testung und Liquordiagnostik – einen wichtigen Stellenwert hinsichtlich möglicher struktureller zerebraler Veränderungen ein, um einerseits potenziell reversible Begleitzustände und andererseits diagnostische Muster der Gehirnatrophie, die auf bestimmte Demenzsubtypen hinweisen, zu identifizieren. Funktionelle nuklearmedizinische Untersuchungen ermöglichen einen zusätzlichen und differenzierteren Blick auf verschiedene Demenzformen unter Einsatz unterschiedlicher Radiopharmaka, wobei primär die Darstellung des zerebralen Glukosestoffwechsels mittels F18-markierter Fluordesoxyglukose (FDG) und der zerebralen Perfusion mittels Tc-99m-markiertem Hexamethyl-Propylen-Aminoxim (HMPAO) und Ethylcysteinat (ECD) zu nennen sind. Nach der S3-Leitlinie für Demenzen können sie zur Klärung bei Unsicherheiten in der Differenzialdiagnostik von Demenzen (DAT, FTD und VD) beitragen. Ihr „regelhafter“ Einsatz wird nicht empfohlen.2 Unterstützt wird diese Empfehlung auch von der European Association of Nuclear Medicine und European Academy of Neurology. So findet sich im 2018 publizierten „Delphi-Konsensus“ die Empfehlung, dass in Kenntnis der eingeschränkten Datenlage die von FDG-PET im diagnostischen Verfahren bereitgestellten Informationen als unterstützend oder nicht unterstützend für die diagnostische Hypothese angesehen und zusätzlich zu herkömmlichen klinischen und neuropsychologischen Beurteilungen verwendet werden dürfen.3
PET-Tracer FDG
Mit Hilfe des PET-Tracers FDG, dem Strukturanalogon der Glukose, können Rückschlüsse auf regionale Hirnfunktionsstörungen gezogen werden, wobei FDG über die gleichen Transporter in die Zellen aufgenommen wird: einerseits über den insulinabhängigen GLUT1-Transporter, exprimiert an Endothelzellen der Bluthirnschranke und Gliazellen, andererseits über den GLUT3-Transporter an Neuronen. Phosphoryliert in der Zelle wird FDG nicht weiter verstoffwechselt und akkumuliert. Dabei ist unter physiologischen Bedingungen der zerebrale Glukosestoffwechsel auch direkt an die Perfusion gekoppelt. Für die Darstellung der regionalen Hirnperfusionsverhältnisse werden die SPECT-Tracer HMPAO und ECD eingesetzt, die als lipophile Substanzen die Blut-Hirn-Schranke überwinden können und eine rasche und hohe Extraktionsrate von ca. 80 % in das Gehirn aufweisen. Intrazellulär werden die Tracer in eine hydrophile Form umgewandelt, sodass sie in den Zellen getrappt die Verteilung des Blutflusses repräsentieren. Die Darstellung des zerebralen Glukosestoffwechsels ist allerdings jener der zerebralen Hirnperfusion in der Demenzdiagnostik überlegen und nach Möglichkeit vorzuziehen. So zeigt die FDG-PET eine Sensitivität von 86–90 % und eine Spezifität von 86–89 % zur Differenzierung von Alzheimer-Kranken gegenüber Gesunden, wohingegen dieHMPAO-SPECT hier eine Sensitivität von 65–71 % und eine Spezifität von 79 % aufweist.4, 5 Darüber hinaus zeigt die FDG-PET in der Differenzialdiagnostik der DAT gegenüber der FTD eine Sensitivität von 86 % und eine Spezifität von 98 %6 sowie in der Differenzialdiagnostik der DAT gegenüber der VD eine Sensitivität von 71 % und eine Spezifität von 76 %.7 Anzumerken ist hier, dass bei subjektiv-kognitivem Verfall oder bei asymptomatischen PatientInnen mit einem erhöhten Risiko für eine DAT sowie bei PatientInnen mit Hinweis auf eine zerebrale Amyloidpathologie mit Apolipoprotein E (APOE) ∈4-positivem Genotyp oder mit autosomal dominanter Form einer DAT nach der aktuellen Datenlage von einer FDG-PET abgeraten wird.8
Die FDG-PET zeigt schon oft in den Frühstadien der Erkrankung charakteristische kortikale Tracerminderspeicherungen bei noch nicht nachweisbarer Atrophie mittels cMRT oder cCT und kann so auch schon bei PatientInnen mit einem milden kognitiven Defizit (MCI) zur Diagnostik eingesetzt werden. Dabei findet sich bei der DAT eine Stoffwechselminderung bzw. eine Hypoperfusion vor allem im temporoparietalen Assoziationskortex. Eine Tracerverminderung im präfrontalen Kortex lässt sich meist erst in späteren Stadien finden. Der Glukosestoffwechsel und die Perfusion im sensorischen, motorischen sowie im visuellen Kortex bleiben meist erhalten. Bei der aphasischen Form lässt sich oft eine linkshemisphärische Lateralisation erkennen. Ein vorherrschender posteriorer temporoparietaler und okzipitaler Hypometabolismus bzw. eine Hypoperfusion findet sich bei der posterioren kortikalen Atrophie. Bei der behavioralen Variante der FTD (bvFTD) lässt sich ein kortikaler FDG-Hypometabolismus im Bereich des Frontal- und des Temporallappens erkennen.9 Bei der semantischen Variante der primär-progressiven Aphasie (svPPA) können sich Tracerminderanreicherungen v. a. im Bereich des linken anterioren, inferioren und lateralen Temporallappencortex finden, während bei einer nichtflüssigen‚ agrammatischen Variante (nf-avPPA) vornehmlich links frontale und periinsuläre Abschnitte hypometabol zur Ansicht kommen. Bei der logopenischen Variante (lvPPA) kann eine verminderte Traceranreicherung links temporoparietal erfasst werden. Sensitivität, Spezifität und Genauigkeit bei der Differenzierung aller PPA-Varianten sind mit jeweils 86 %, 67 % bzw. 84 % für FDG-PET beschrieben.10 Bei der LBD zeigt sich zusätzlich zu den Tracerminderspeicherungen im temporoparietalen Assoziationskortex auch eine okzipitale Beteiligung im visuellen Kortex neben ausgezeichnet gut speichernden Stammganglien. So konnte gezeigt werden, dass die LBD von der DAT mittels FDG-PET mit einer Sensitivität von 86–90 % und einer Spezifität von 80–91 % unterschieden werden kann. Die VD ist durch kein spezifisches Verteilungsmuster gekennzeichnet, wobei die Infarkte je nach Größe hauptsächlich durch keilförmige Minderspeicherungen gekennzeichnet sind.9
Zerebraler Amyloidnachweis mittels PET-Bildgebung
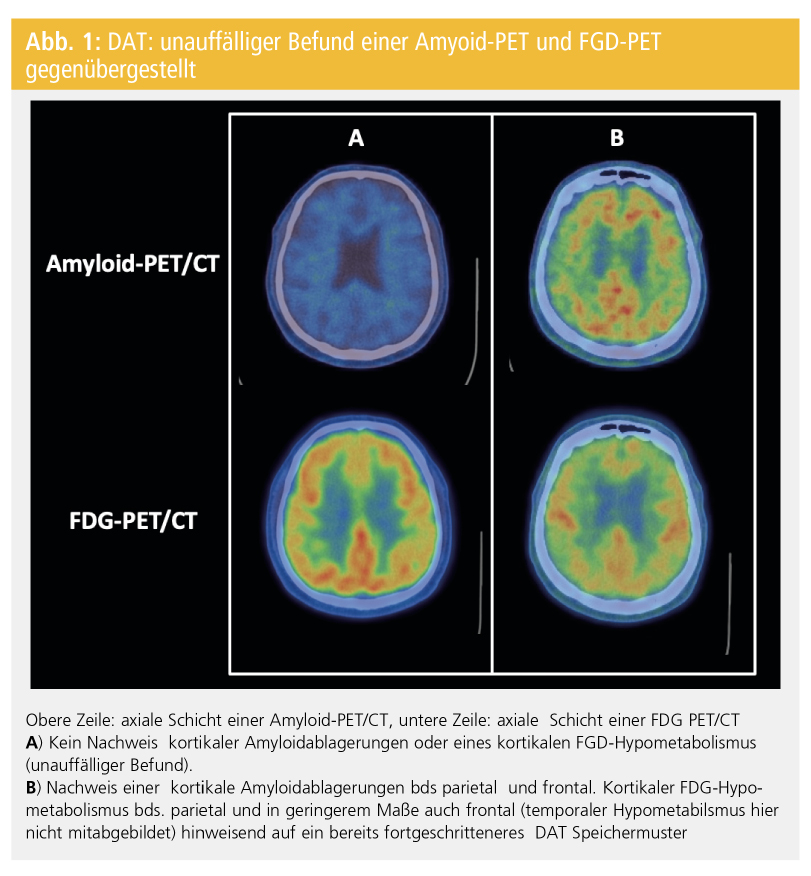
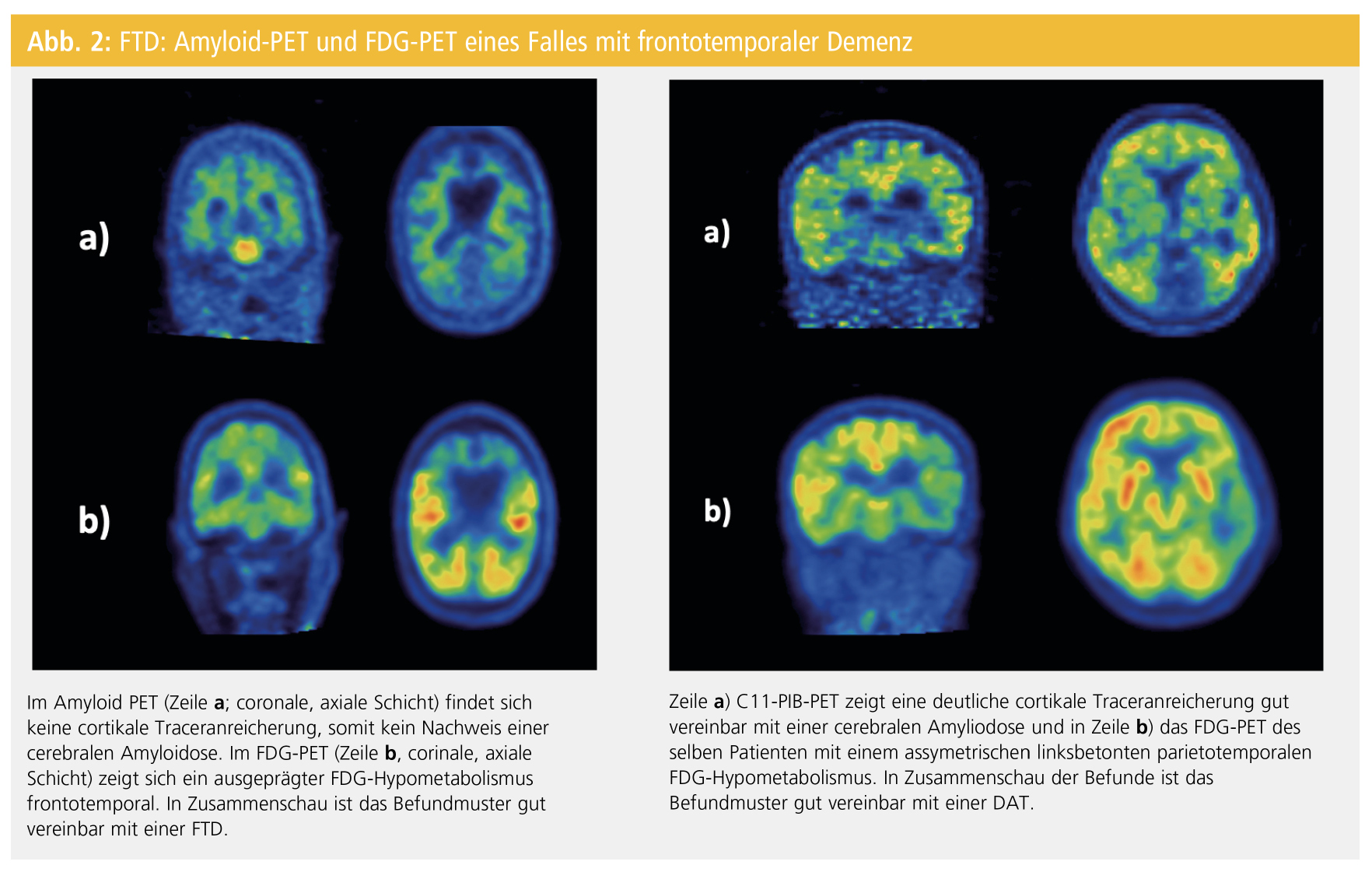
Für die Festigung der Diagnose einer Alzheimer-Erkrankung ist eine kortikale Beta-Amyloid-Ablagerung pathognomonisch, welche durch Abspaltungen aus dem Amyloid-Precursor-Protein (APP) entsteht und bereits lange, bevor die Krankheit diagnostiziert wird, auftritt. Seit kurzem stehen nun in Europa zugelassene F18-markierte PET-Radiopharmaka zur Darstellung des Beta-Amyloids zur Verfügung: 18F-Fluorbetaben (NeuraceqTM), 18F-Flutemetamol (VizamylTM), und 18F-Florbetapir (AmyvidTM), welche basierend auf dem ersten beschriebenen und im Menschen eingesetzten Amyloid-Tracer 11C-markiertem Pittsburgh Compound B entwickelt wurden. In autopsievalidierten Studien konnte gezeigt werden, dass die In-vivo-Darstellung des vor allem kortikal abgelagerten Beta-Amyloids mit dem histopathologischen Grad der Ablagerungen mit einer hohen Sensitivität von über 90 % übereinstimmen11, 12 (Abb. 1). Allerdings beobachtet man auch bei gesunden PatientInnen mit zunehmendem Alter einen zerebralen Amyloidnachweis mittels PET-Bildgebung. So liegt die Rate der im PET positiven, gesunden PatientInnen zwischen 50 und 60 Lebensjahren niedriger als 5 %, zwischen 60 und 70 Jahren bei 10 % und zwischen 70 und 80 Jahren bei 25 %. Gesunde PatientInnen zwischen 80 und 90 Jahren zeigen in über 50 % der Fälle ein positives Amyloid-PET.13 Außerdem findet sich auch bei PatientInnen mit anderen Demenzformen, die nicht der typischen amnestischen Form der DAT entspricht wie z. B. der posterioren kortikalen Atrophie, der LBD, der Parkinsondemenz oder auch der lvPPA, ein positives Amyloid-PET. Weitere Limitationen, die die Amyloid-PET-Bildgebung erschweren, resultieren daher, dass diese Radiopharmaka nicht zwischen Amyloidfibrillen in Gefäßen bei zerebraler Amyloidangiopathie und jenen im Hirnparenchym unterscheiden können. Deswegen darf jeder positive Amyloidnachweis mittels PET nur im Gesamtkontext beurteilt werden. Ein positiver Amyloid-PET-Befund kann auf eine DAT hindeuten, ein negativer Befund spricht gegen eine Alzheimer-Krankheit bzw. schließt sie nahezu aus2 (Abb. 2).
Sinnvolle Indikationen für die Amyloid-PET sind nach der S1-Leitlinie der Deutschen Gesellschaft für Nuklearmedizin, in der die Empfehlungen der Society of Nuclear Medicine and Molecular Imaging (SNMMI) und der Alzheimer’s Association berücksichtigt wurden, objektivierbare persistierende oder progrediente Gedächtnisprobleme, auffällige Ergebnisse in einer kognitiven Testung, eine nichttypische klinische Demenz-Präsentation und ein atypisch junges Alter (< 65) bei Auftreten eines Demenzsyndroms. Nicht empfohlen wird hingegen die Amyloid-PET derzeit bei PatientInnen jenseits des 65. Lebensjahres mit einem für eine Alzheimer-Krankheit typischen Testergebnis ohne vorangegangene klinische Testung oder um den Demenzschweregrad zu bestimmen. Auch eine positive familiäre Demenz-Anamnese alleine, das Vorhandensein eines ApoE4-Status, der Ersatz für eine Genotypisierung bei Verdacht auf erbliche DAT oder nichtmedizinische (z. B. legale, versicherungsrelevante, arbeitsverhältnisrelevante) Gründe rechtfertigen nicht den Einsatz der Amyloid-PET.17
Für die Bildanalyse ist es wichtig zu beachten, dass sich die aktuell verfügbaren Amyloid-Tracer in unterschiedlichem Maße unspezifisch im Marklager anreichern, vermutlich aufgrund einer unspezifischen Bindung an Myelin. Deswegen erfolgt die Beurteilung der Aufnahmen anhand des visuellen Vergleichs der Intensität der Anreicherung in der kortikalen grauen Substanz mit der unspezifischen Anreicherung in der angrenzenden weißen Hirnsubstanz. Im Fall eines positiven Befundes zeigt sich eine Anreicherung im Kortex von zumindest gleicher oder über die der weißen Hirnsubstanz hinausgehender Intensität, so dass der physiologische Kontrast zwischen Kortex und weißer Substanz verschwindet. Gemäß der oben erwähnten Verteilung der Amyloid-Plaques zeigt sich bei PatientInnen mit DAT eine Anreicherung vor allem im Frontalkortex – insbesondere im Orbitalbereich und im medialen Frontalbereich – sowie im Gyrus cinguli, im Precuneus und in den lateralen Parietal- und Temporalbereichen18, während der Okzipitalkortex, der sensomotorische Kortex und der mesiale temporale Kortex in der Regel weniger stark betroffen sind.
Interpretation der visuellen Bildanalyse
Schlussendlich sollte die Interpretation der visuellen Bildanalyse zu einem eindeutigen positiven oder negativen Befund führen. Abhängig vom verwendeten Radiopharmakon liegt ein positiver Befund vor, wenn sich eine Traceranreicherung in einer oder mehreren der oben erwähnten kortikalen Regionen findet. Dabei steht ein negativer Scan für spärliche oder fehlende Amyloid-Plaques, was bedeutet, dass der Patient/die Patientin mit sehr hoher Wahrscheinlichkeit keine DAT-Diagnose hat. Ein positiver Scan ist keine Bestätigung für die DAT, da ein positives Ergebnis auch bei anderen neurologischen Erkrankungen und bei älteren Menschen mit normaler Kognition auftreten kann. Die PET sollte möglichst unter Zuhilfenahme aktueller CT- oder MRT-Bilder befundet werden, da es gerade bei PatientInnen mit kortikaler Atrophie zu falsch positiven Befunden kommen kann. Derzeit beruht die Bildanalyse auf rein visuellen Kriterien. Eine quantitative Auswertung der bildlich nachweisbaren zerebralen Amyloidlast dürfte aber die Sicherheit der Beurteilung erhöhen, was vor allem in Grenzfällen eine Hilfestellung sein könnte. Die unterschiedlichen Messwerte in Abhängigkeit der verwendeten Amyloid-PET-Tracer fordern auch eine Vergleichbarkeit, die derzeit mit der CENTILOID-Methode verfolgt und evaluiert wird.19
Auswirkungen auf das klinische Outcome
Der Einfluss der Amyloid-Bildgebung auf das klinische Outcome ist derzeit Zustand laufender Untersuchungen. So konnte bezüglich des klinischen Nutzens der Amyloid-PET in ersten Untersuchungen bis jetzt gezeigt werden, dass diese Bildgebung in etwa 30 % der Fälle zu einer Änderung der Diagnose, in etwa 60 % der Fälle zu einer Zunahme der diagnostischen Sicherheit und zu einer Änderung des PatientInnenmanagements sowie in etwa 40 % der Fälle zu einer Änderung des medikamentösen Therapieregimes führte. PatientInnen mit Kenntnis einer zerebralen Amyloidose nach der Mitteilung der Ergebnisse dürften eher zu einer positiven Lebensstiländerungen bereit sein als Amyloid-negative ProbandInnen.20 Auch dürften die Ergebnisse der Amyloid-PET einen wichtigen Einfluss auf die pflegenden Bezugspersonen haben, die so besser mit der Diagnose zurechtzukommen scheinen.21 Die aktuell laufende IDEAS-(Imaging Dementia – Evidence for Amyloid Scanning-)Studie, unterstützt von SNMMI und der Alzheimer-Association in den USA, hat zum Ziel, die Auswirkungen der Amyloid-PET-Ergebnisse zu beurteilen. Die primäre Hypothese der Studie ist, dass in diagnostisch unsicheren Fällen der Amyloidstatus, mittels Amyloid-PET erhoben, zu signifikanten Veränderungen des PatientInnenmanagements führt, und dies konsekutiv auch einen Einfluss auf die Kosten im Gesundheitswesen hat.22 Hierzu werden Ergebnisse in den kommenden Jahren erwartet. Auch in Europa läuft derzeit die groß angelegte Studie AMYPAD (Amyloid Imaging to Prevent Alzheimer’s Disease) zur besseren Einschätzung der Auswirkungen von Amyloid-PET. Diese Studie soll bei MCI-PatientInnen untersuchen, inwieweit der bildgebende Nachweis einer zerebralen Amyloidose Einfluss auf das Management der Erkrankung hat. So wird außerdem in einer Substudie die Wertigkeit der Amyloid-Bildgebung bei PatientInnen mit subjektiv kognitivem Verfall im Sinne eines SCD-plus (subjective cognitive decline with additional evidence for preclinical AD) bestimmt werden.23
Innovative Tracer
Neben den Amyloid-Tracern wurde in den letzten Jahren auch viel zu anderen Tracern für neurodegenerative Erkrankungen geforscht. Die Darstellung der neurofibrillären Tangles (NFT), intrazellulären Aggregaten aus hyperphosphorylierten Tau-Proteinen, stellt jedoch beispielsweise die Tracerentwicklung vor eine große Herausforderung, vor allem die Selektivität und spezifische Bindung betreffend. Zwar gelten NFTs als relativ spezifisch für die DAT, so kommen sie doch auch bei verschiedenen anderen Demenzformen, wie bei M. Pick oder bei der progressiven supranukleären Paralyse (PSP) vor, jedoch in einer anderen Isoform des Taus. Ein vielversprechender, derzeit in klinischen Studien erprobter Tracer dürfte Taucipir (i.e. das 18F-AV-1451) sein, welcher eine sehr hohe selektive Bindung an Tau-Aggregate und nur eine schwache, etwa 29-fach geringere Affinität zum β-Amyloid in der grauen Substanz bei PatientInnen mit DAT aufweist.24 Dieser Tracer zeigte weiters eine deutlich spezifischere Bindung an die Tau-Isoform bei PatientInnen mit einer Alzheimer-Erkrankung im Vergleich zu PSP-PatientInnen.25
Zusammenfassung
Zusammenfassend ist zu sagen, dass der Einsatz von Radiopharmaka in der Demenzdiagnostik, unterstützt durch die S3-Leitlinie für Demenzen, eine wesentliche Rolle als weiterführende Hilfestellung bei der Diagnostik schwer zuordenbarer Demenzsyndrome darstellt. Dies kann mit Hilfe der Erfassung der zerebralen Perfusion mittels der SPECT-Tracer HMPAO und ECD oder des zerebralen Glucosestoffwechsels mittels dem PET-Tracer FDG als Ausdruck der neuronalen Schädigung erfolgen, wobei FDG den SPECT-Tracern auf Grund seiner höheren Sensitivität und Spezifität nach Möglichkeit vorzuziehen ist. Diese Radiopharmaka ermöglichen aufgrund ihrer demenztypischen Speicherungsmuster eine weiterführende Differenzialdiagnose zwischen einzelnen Demenzformen, was rezent auch durch den Delphi-Konsensus noch untermauert wurde. Im letzten Update der S3-Leitlinie für Demenzen 2016 hat auch die zerebrale Amyloid-PET einen Stellenwert bekommen. In klinisch unklaren Fällen eines vorliegenden Demenzsyndroms darf diese nuklearmedizinische Bildgebung zur Differenzialdiagnose bzw. ätiologischen Zuordnung eingesetzt werden. Hierbei muss bei einem Demenzsyndrom der positive Amyloid-Nachweis mittels PET im Gesamtkontext insbesondere unter Beachtung des klinischen Befundes und anderer Biomarker-Informationen interpretiert werden. Da unabhängig vom Erkrankungsstadium ein zerebraler β-Amyloid-Befall als conditio sine qua non für die Diagnose der Alzheimer-Krankheit („kein Alzheimer ohne Plaques“) angesehen wird, schließt ein negativer PET-Befund eine DAT mit hoher Wahrscheinlichkeit aus. In Studien wie IDEAS und AMYPAD wird derzeit untersucht, inwieweit die Amyloid-PET das Management von PatientInnen mit einem Demenzsyndrom beeinflusst bzw. verändert, sowohl auf medizinischer als auch auf gesundheitsökonomischer Ebene. Auch eine Kombination der Amyloid- und FDG-PET Bildgebung könnte hier in der Zukunft eine mögliche Rolle spielen, um eine Konversion in das demenzielle Stadium der Alzheimer-Erkrankung besser einschätzen zu können. Neben etablierten Tracern wird auch an innovativen bzw. neuen PET-Radiopharmaka gearbeitet, die beispielsweise eine mögliche In-vivo-Charakterisierung der Tau-Pathologie erlauben. Hier stellen jedoch Selektivität und Bindungsaffinität an die unterschiedlichen Isoformen des Taus eine große Herausforderung dar. Ein erster Tracer, der durch seine unterschiedliche Bindung an Tau bei DAT- und PSP-PatientInnen aufhorchen ließ, wird derzeit in klinischen Studien erprobt.