Funktionelles Imaging bei Parkinson-Syndromen
Bildgebende Untersuchungen können einen wesentlichen Beitrag zur Früh- und Differenzialdiagnose von Parkinson-Syndromen leisten. Die Diagnose des Morbus Parkinson fußt primär auf Anamnese und klinischer Untersuchung. Die Abgrenzung von milden Bewegungsstörungen bei ansonsten gesunden älteren Personen, bei PatientInnen mit orthopädischen, rheumatischen, psychiatrischen oder auch bestimmten neuromuskulären Erkrankungen (Tab. 1), von medikamenteninduzierten und vaskulären Parkinson-Syndromen sowie von Tremor-Syndromen kann jedoch schwierig sein. Eine Differenzierung zwischen M. Parkinson und atypischen Parkinson-Syndromen wie der Multisystematrophie (MSA) und der progressiven supranukleären Paralyse (PSP) ist im Frühstadium häufig unmöglich.
Post-mortem-Untersuchungen von PatientInnen in fortgeschrittenen Krankheitsstadien zeigen, dass die Treffsicherheit für die klinische Diagnose eines M. Parkinson selbst in spezialisierten Zentren und unter Einhaltung strikter Kriterien bei maximal 90 % liegen dürfte. Zu Fehldiagnosen führen auch in diesem Fall atypische Parkinson-Syndrome wie die MSA und PSP, aber auch Parkinson-Syndrome im Rahmen eines M. Alzheimer und vaskuläre Parkinson-Syndrome (VP).
Tabelle 2 zeigt die wichtigsten Parkinson-Syndrome und differenzialdiagnostisch bedeutsame Bewegungsstörungen.
Ein Überblick
- Eine MRT- oder CCT- Untersuchung sollte zum Ausschluss von läsionellen Parkinson-Syndromen und zur Dokumentation von Kopathologien immer Bestandteil der Parkinson-Abklärung sein. Die strukturelle Bildgebung ist auch eine Voraussetzung für die richtige Interpretation funktioneller Imaging-Befunde.
- Die SPECT-Untersuchung mit Dopamin-Transporter-(DAT-)Liganden wie 123I-FP-CIT erlaubt abgesehen von seltenen Ausnahmen bereits im Frühstadium eine Dokumentation der dopaminergen Degeneration beim M. Parkinson und bei atypischen Parkinson-Syndromen. Die DAT-SPECT ermöglicht in den meisten Fällen eine Abgrenzung degenerativer von nichtdegenerativen Parkinson- und Tremor-Syndromen, kann jedoch nicht zwischen Morbus Parkinson, Multisystematrophie und progressiver supranukleärer Paralyse differenzieren. Eine Limitation der überaus hilfreichen DAT-SPECT in der Praxis ist die Über- oder Unterinterpretation grenzwertiger Befunde.
- Die Untersuchung postsynaptischer Dopamin-D2-Rezeptoren mit der 123I-IBZM-SPECT kann zur Differenzierung von M. Parkinson und MSA bzw. PSP beitragen. Die Untersuchung des zerebralen Glukosemetabolismus mittels 18F-FDG-PET und die Darstellung noradrenerger Nervenendigungen im Herzen mittels des MIBG-Scans dürften in dieser Fragestellung jedoch eine höhere Sensitivität und Spezifität haben.
MRT und F-Dopa-PET bei M. Parkinson
Die Routinediagnostik von PatientInnen mit Parkinson-Syndromen umfasst neben Anamnese und klinischer Untersuchung immer eine CCT- oder MRT-Untersuchung zum Ausschluss läsioneller Ursachen wie eines Normaldruckhydrozephalus oder einer Raumforderung. CT bzw. MRT dienen darüber hinaus der Erfassung möglicher Kopathologien, deren Diagnose durch das Parkinson-Syndrom erschwert sein kann. Im Falle von atypischen Parkinson-Syndromen kann die MRT in manchen Fällen frühzeitig spezifische Atrophie-Muster oder Signalintensitätsveränderungen zeigen, in anderen Fällen als Ausgangsbefund für Verlaufskontrollen dienen.
Im Frühstadium des M. Parkinson ergeben Routine-MRT bzw. -CCT in der Mehrheit der Fälle unauffällige Befunde oder irrelevante Kopathologien, z. B. milde oder mäßiggradige mikroangiopathische Veränderungen. Gegenwärtig sind Standard-MRT-Sequenzen noch nicht in der Lage, die dopaminerge Degeneration in der Substantia nigra zuverlässig darzustellen.
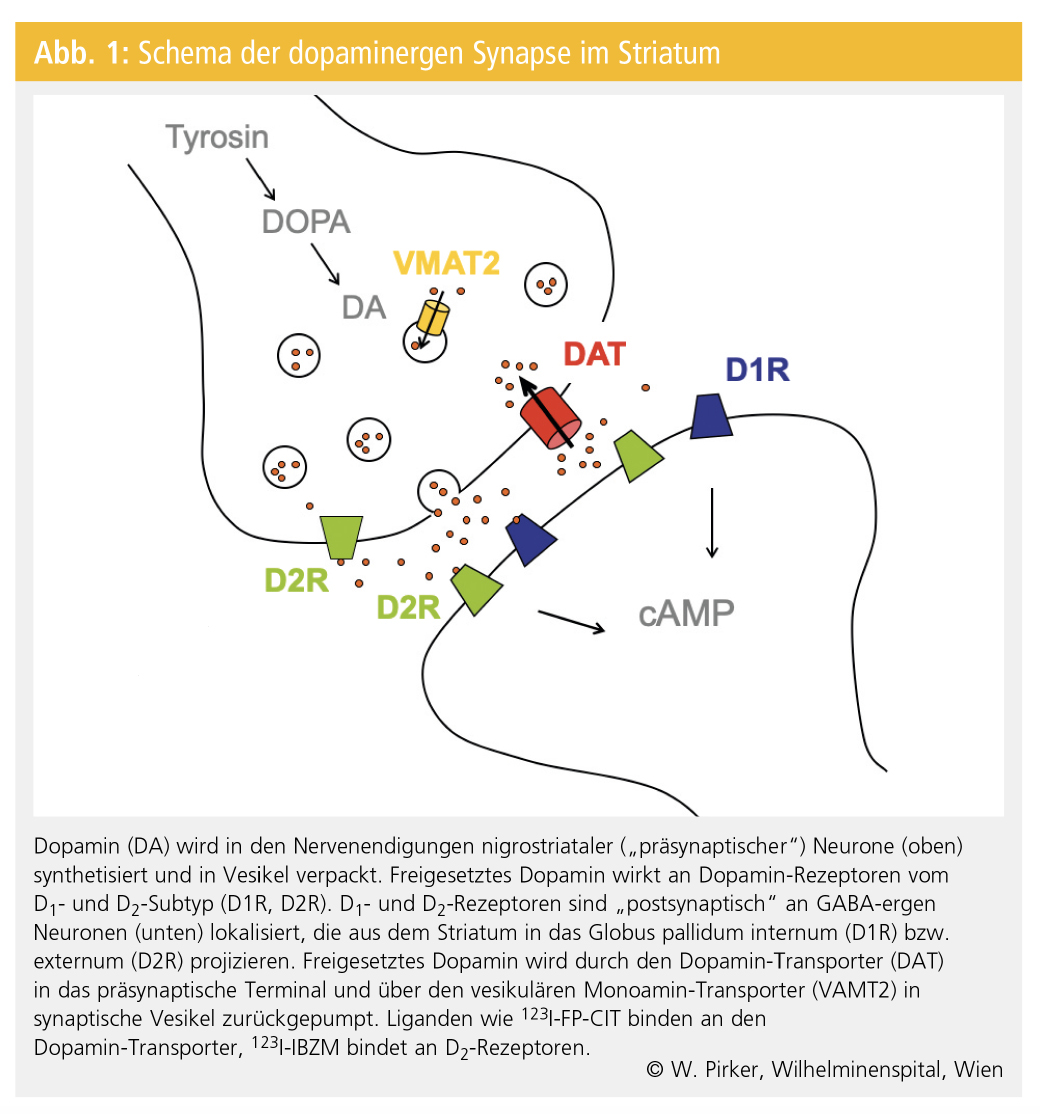
Funktionelle bildgebende Verfahren, wie die Positronen-Emissions-Tomografie (PET) und Single-Photon-Emissions-Computertomografie (SPECT), ermöglichen die In-vivo-Untersuchung von Veränderungen des Metabolismus und von Rezeptorsystemen. 18F-Fluorodopa (F-Dopa) war in den 1980er-Jahren der erste verfügbare PET-Ligand zur Untersuchung der Integrität des dopaminergen Systems. Die Bindung von F-Dopa im Striatum (Nucleus caudatus und Putamen) reflektiert in erster Linie die Aktivität der Dopa-Decarboxylase in den Nervenendigungen der nigrostriatalen Neurone. Abbildung 1 zeigt ein vereinfachtes Schema der dopaminergen Synapse im Striatum. Dopamin wird in den Nervenendigungen von aus der Substantia nigra in das Striatum projizierenden Neuronen synthetisiert. Die Dopa-Decarboxylase konvertiert L-Dopa zu Dopamin.
Der M. Parkinson ist durch eine relativ selektive Degeneration dopaminerger Neurone in der Substantia nigra und ihrer Nervenendigungen im Striatum gekennzeichnet.
F-Dopa-PET-Untersuchungen zeigen beim M. Parkinson eine progressive Reduktion der striatalen F-Dopa-Aufnahme mit zunehmender Schwere der Erkrankung. Ein weiterer PET-Ligand für das präsynaptische dopaminerge System ist 11C-Dihydrotetrabenazin, das den intrazellulären, vesikulären Monoamin-Transporter (VMAT2) in dopaminergen Nervenendigungen markiert.
Dopamin-Transporter-Imaging
Anfang der 1990er-Jahre wurde mit 123I-β-CIT ein Ligand für SPECT-Untersuchungen des nigrostriatalen Neurons verfügbar. β-CIT ist ein Kokain-Derivat und bindet an den präsynaptisch lokalisierten Dopamin-Transporter (DAT). In der Folge wurden zahlreiche weitere DAT-Liganden für PET- und SPECT-Untersuchungen entwickelt. 123I-FP-CIT, ebenfalls ein Kokain-Derivat, ist unter dem Handelsnamen Dat-Scan® registriert und für die Diagnostik des M. Parkinson und die Differenzialdiagnose von Demenz mit Lewy-Körperchen und M. Alzheimer zugelassen.
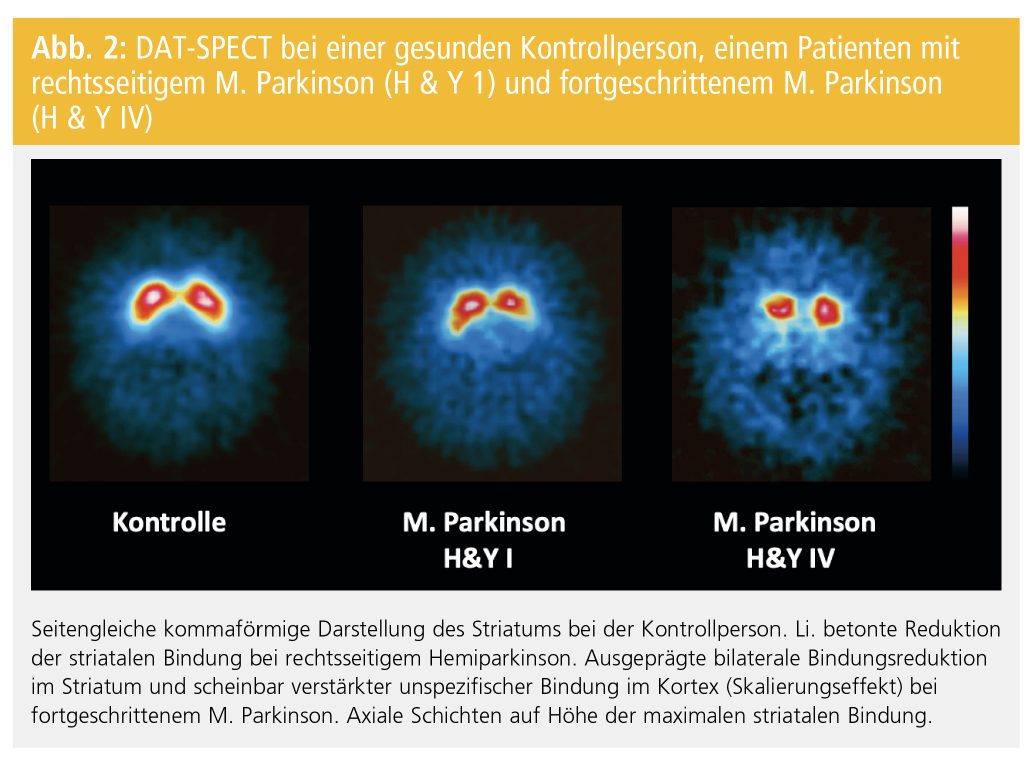
Abbildung 2 zeigt β-CIT-SPECT-Studien bei einer gesunden Kontrollperson und bei PatientInnen mit frühem bzw. fortgeschrittenem M. Parkinson. Die PatientInnen zeigen eine mit der Schwere der Erkrankung zunehmende Reduktion der striatalen DAT-Bindung. Bei PatientInnen mit Hemiparkinson, also unilateraler Symptomatik, ist die striatale Bindung kontralateral zur Klinik stärker reduziert. Zusätzlich zeigt sich eine leichte Reduktion der DAT-Bindung ipsilateral zur klinisch betroffenen Seite. Die SPECT-Untersuchung kann die beginnende dopaminerge Degeneration beim M. Parkinson meist vor Auftreten der klinischen Symptomatik erfassen und ermöglicht damit im Prinzip eine präklinische Diagnose. Dies wird durch pathologische DAT-SPECT-Befunde bei PatientInnen mit idiopathischer Hyposmie bzw. mit REM-Schlaf-Verhaltensstörung und bei asymptomatischen Genträgern für monogenen M. Parkinson unterstützt.
Die Asymmetrie der striatalen Bindung bleibt ebenso wie die klinische Asymmetrie bei der Mehrzahl der PatientInnen mit M. Parkinson bis in späte Stadien der Erkrankung erhalten. Die Reduktion der DAT-Bindung ist im hinteren Teil des Striatums ausgeprägter als in vorderen Anteilen. Ursache ist die beim M. Parkinson bevorzugte Degeneration ventrolateraler Anteile der Substantia nigra, die in das Putamen projizieren.
Querschnittuntersuchungen beim M. Parkinson zeigen eine Abnahme der striatalen DAT-Bindung mit zunehmender Krankheitsdauer und eine negative Korrelation zwischen striataler DAT-Bindung und der Schwere von Bradykinese, Rigor und axialen Symptomen. Dagegen scheinen beim M. Parkinson weder Ruhe- noch Aktionstremor mit der striatalen DAT-Bindung zu korrelieren, was auf eine Beteiligung nichtdopaminerger Systeme an der Pathogenese des Parkinson-Tremors schließen lässt. Zu einer leichten, wenn auch diffusen und symmetrischen Abnahme der striatalen DAT-Bindung kommt es auch mit dem normalen Altern. Diese Beobachtung ist mit der altersassoziierten Abnahme dopaminerger Neurone in der normalen Substantia nigra konsistent. Die Korrelation der striatalen DAT-Dichte mit der Zahl dopaminerger Neurone wurde durch Post-mortem-Studien, die PatientInnen mit verschiedenen Erkrankungen einschlossen, validiert.
Sensitivität der DAT-SPECT
Sensitivität und Spezifität der DAT-SPECT und F-Dopa-PET für die Frühdiagnose des M. Parkinson und die Differenzierung des frühen M. Parkinson von gesunden Personen und PatientInnen mit milden Bewegungsstörungen und Tremor-Syndromen ohne dopaminerge Degeneration sind hoch, aber nicht 100%ig. Longitudinale SPECT- bzw. PET-Studien zeigten, dass bis zu 10 % der PatientInnen mit der Diagnose eines milden M. Parkinson eine normale striatale DAT- bzw. F-Dopa-Bindung aufweisen. Diese normalen bildgebenden Befunde bei PatientInnen mit der klinischen Diagnose eines M. Parkinson wurden als „scans without evidence for dopaminergic deficit“ (SWEDDs) bezeichnet. Der SPECT-Befund blieb bei diesen PatientInnen nach einem mehrjährigen Beobachtungszeitraum normal. Bislang sind keine „SWEDD“-PatientInnen dokumentiert, bei denen das Parkinson-Syndrom eine weitere klinische Progredienz gezeigt hätte. Es ist daher davon auszugehen, dass die große Mehrheit dieser PatientInnen nicht unter einem M. Parkinson leidet. Als eine mögliche Ursache wurde unter anderem ein im Erwachsenenalter auftretender dystoner Extremitätentremor, der leicht mit einem Parkinson-Tremor verwechselt werden kann, beschrieben. Bei vielen anderen Fällen handelt es sich um einen der in Tabelle 1 angeführten „Parkinson mimics“.
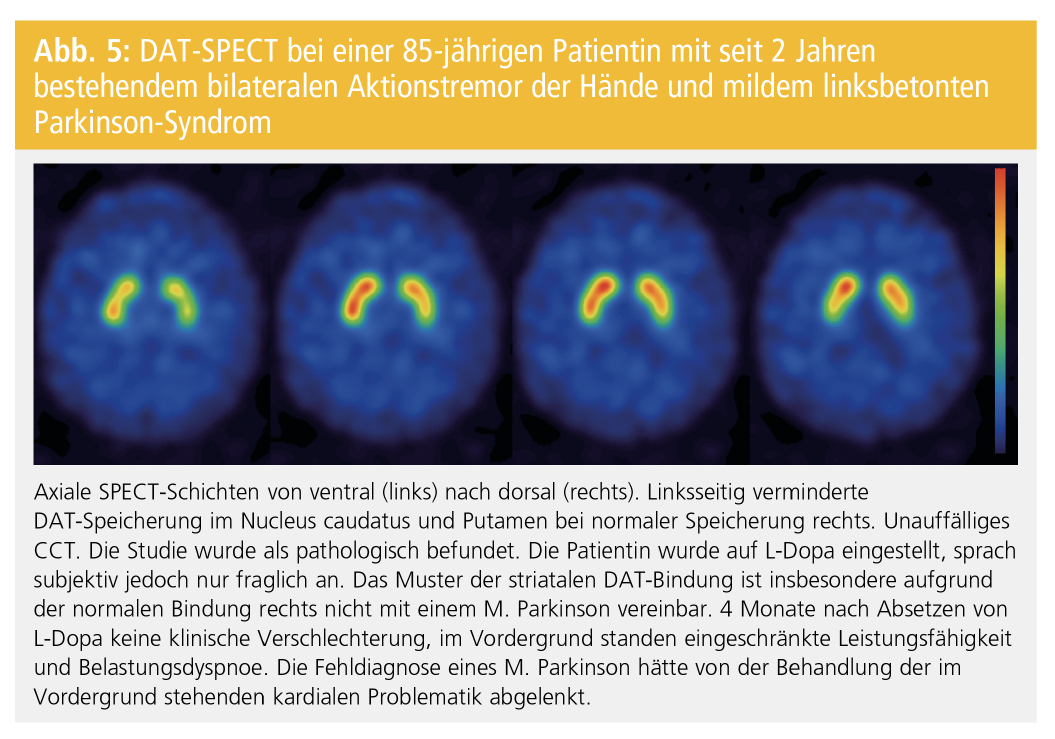
In seltenen Ausnahmefällen können frühe M.-Parkinson-PatientInnen nur eine milde Asymmetrie der striatalen Bindung zeigen, die zur Fehlklassifizierung als Normalbefund führt. Desweiteren kann die DAT-SPECT einen grenzwertigen Befund mit milder bilateraler Bindungsreduktion im posterioren Putamen zeigen, der nicht eindeutig als Muster einer dopaminergen Degeneration gewertet werden kann. Entscheidend für die Beurteilung der FP-CIT-SPECT in der Praxis ist die Identifikation eines eindeutig pathologischen Verteilungsmusters der striatalen Bindung (Asymmetrie, Putamen stärker betroffen als Nucleus caudatus). Die Semiquantifizierung der DAT-Dichte mit Bildung einer Ratio aus dem Uptake im Striatum und einer Referenzregion (z. B. Ratio Striatum/Cerebellum oder Kortex) kann die Befundung unterstützen. Das regionale Verteilungsmuster ist für die Klassifizierung einer SPECT-Studie als pathologisch oder normal jedoch entscheidender als das Ergebnis der Semiquantifizierung. Bei einem kleinen Prozentsatz der Untersuchungen ist eine Klassifizierung als normal oder pathologisch nicht zuverlässig möglich. Grenzwertige Befunde sollten unbedingt als solche ausgewiesen werden. Die Therapie richtet sich in diesen Fällen nach der Klinik. Bei anhaltend unklarer Diagnose kann eine Wiederholung der DAT-SPECT-Untersuchung nach 1 bis 2 Jahren oder im späteren Verlauf sinnnvoll sein. Beispiele für Probleme in der Befundung von DAT-SPECT-Untersuchung finden sich in den Abbildungen 3–5. Sie illustrieren auch die große Bedeutung einer guten Zusammenarbeit zwischen Neurologie und Nuklearmedizin mit gemeinsamer Diskussion unklarer und schwieriger Befundkonstellationen.
Parkinson- und Tremor-Syndrome ohne dopaminerge Degeneration
Wie oben ausgeführt kann die DAT-SPECT mit guter Zuverlässigkeit zwischen M. Parkinson und Störungen ohne dopaminerge Degneration differenzieren. Zu Letzteren zählen milde extrapyramidale Symptome bei ansonsten gesunden älteren Personen, Parkinson-Symptome bei Depression und anderen psychiatrischen Erkrankungen sowie M. Alzheimer, medikamentös und psychogen bedingte Bewegungsstörungen, Bewegungseinschränkungen durch orthopädische und rheumatologische Erkrankungen, Tremor-Syndrome ohne dopaminerge Degeneration und die doparesponsive Dystonie (Tab. 2). Zum Einsatz der DAT-SPECT in der Differenzialdiagnose zwischen M. Parkinson und diesen Störungen liegen z. T. keine oder nur limitierte Daten aus prospektiven SPECT-Studien vor. Die Praxis zeigt jedoch, dass die striatale DAT-Bindung bei diesen Störungen im Gegensatz zum M. Parkinson in der Regel normal ist. Gut dokumentiert ist das in der Regel normale DAT-Imaging beim essenziellen Tremor.
Eine Sonderstellung unter den nichtdegenerativen Bewegungsstörungen nehmen läsionell bedingte Parkinson-Syndrome ein. Läsionen in den Basalganglien oder in den nigrostriatalen Bahnen können im DAT-SPECT zu einer Reduktion der striatalen Bindung führen (Abb. 6). Bei bilateralen Strukturdefekten im Striatum wäre eine Verwechslung mit einem M. Parkinson möglich. Die Kenntnis der individuellen strukturellen Bildgebung (MRT oder CCT) ist daher Voraussetzung für die richtige Interpretation von SPECT-Daten.
Medikamentös induzierte Parkinson-Syndrome
Medikamenteninduzierte Parkinson-Syndrome können, falls eine suffiziente Anamnese durchgeführt werden kann, meist klinisch diagnostiziert werden. Als Auslöser ist neben Neuroleptika an Antiemetika wie Metoclopramid, das Antihypertensivum Reserpin, die antidyskinetisch wirksame Substanz Tetrabenazin und die Kalziumantagonisten Flunarizin und Cinnarizin zu denken. Insbesondere klassische Neuroleptika wie Haloperidol, aber auch Flunarizin führen zu einer über Wochen bis Monate anhaltenden Dopamin-D2-Rezeptor-Blockade im Striatum. Diese kann in der IBZM-SPECT durch eine Reduktion der striatalen Bindung dargestellt werden.
Klinische Untersuchungen zeigen, dass ältere Personen anfälliger für extrapyramidale Nebenwirkungen von Neuroleptika, Flunarizin und Cinnarizin sind. Ursache ist die mit dem natürlichen Altern einhergehende milde Abnahme dopaminerger Neurone und postsynaptischer D2-Rezeptoren. Ein Parkinsonoid nach Gabe niedriger Neuroleptika-Dosen kündigt bei älteren PatientInnen jedoch nicht selten eine beginnende dopaminerge Degeneration, die ohne Neuroleptikum noch subklinisch war, an. Diese kann mittels DAT-SPECT dokumentiert werden. Dopamin-Antagonisten beeinflussen die striatale DAT-Bindung nicht. Ergibt die DAT-SPECT einen Normalbefund, kann davon ausgegangen werden, dass das Parkinson-Syndrom medikamentös induziert ist und nach Absetzen des auslösenden Medikaments abklingen wird. In der Fragestellung eines medikamentös induzierten Parkinson-Syndroms ist die DAT-SPECT daher die bevorzugte Untersuchung, um eine zugrunde liegende Parkinson-Erkrankung auszuschließen oder nachzuweisen.
Die DAT-SPECT ist auch die Methode der Wahl, um zu unterscheiden, ob eine Veränderung der Psychomotorik bei einer Depression Ausdruck der psychiatrischen Grundkrankheit ist (Normalbefund) oder ob die Depression Symptom eines beginnenden M. Parkinson ist.
Vaskuläre Parkinson-Syndrome
Marklagerläsionen bzw. lakunäre Infarkte in den Basalganglien führen häufig zu Parkinson-Syndromen mit Betonung der unteren Körperhälfte (Lower Body Parkinsonism), gelegentlich aber auch zu Parkinson-Syndromen, die schwer vom M. Parkinson oder von atypischen Parkinson-Erkrankungen differenzierbar sind. DAT-SPECT-Untersuchungen bei vaskulär bedingtem Lower-Body-Parkinsonismus zeigen meist eine normale oder nur leicht reduzierte striatale DAT-Bindung. Territorialinfarkte unter Einbeziehung der Basalganglien können zu einer Reduktion der DAT-Bindung im Bereich des Substanzdefektes führen (Abb. 6). Die sehr seltenen vaskulären Parkinson-Syndrome durch Läsion einer Substantia nigra führen zu einer streng einseitigen Reduktion der striatalen DAT-Bindung. Im Einzelfall können PatientInnen mit vaskulären Parkinson-Syndromen ein Muster reduzierter striataler DAT-Bindung zeigen, das nicht vom M. Parkinson zu unterscheiden ist.
Die DAT-SPECT kann in der Fragestellung „vaskuläres Parkinson-Syndrom vs. M. Parkinson“ in folgenden Fällen zur Diagnose beitragen:
- Die SPECT ergibt eine normale DAT-Bindung.
- Die SPECT ergibt ein Muster der striatalen DAT-Bindung, das klar vom M. Parkinson abweicht (z. B. streng einseitiger Bindungsverlust).
In beiden Fällen ist ein M. Parkinson mit großer Wahrscheinlichkeit ausgeschlossen. Ein M.-Parkinson-typischer DAT-SPECT-Befund schließt aber ein vaskuläres Parkinson-Syndrom nicht mit letzter Sicherheit aus.
Nichtklassischer essenzieller Tremor (ET) und andere Tremor-Syndrome
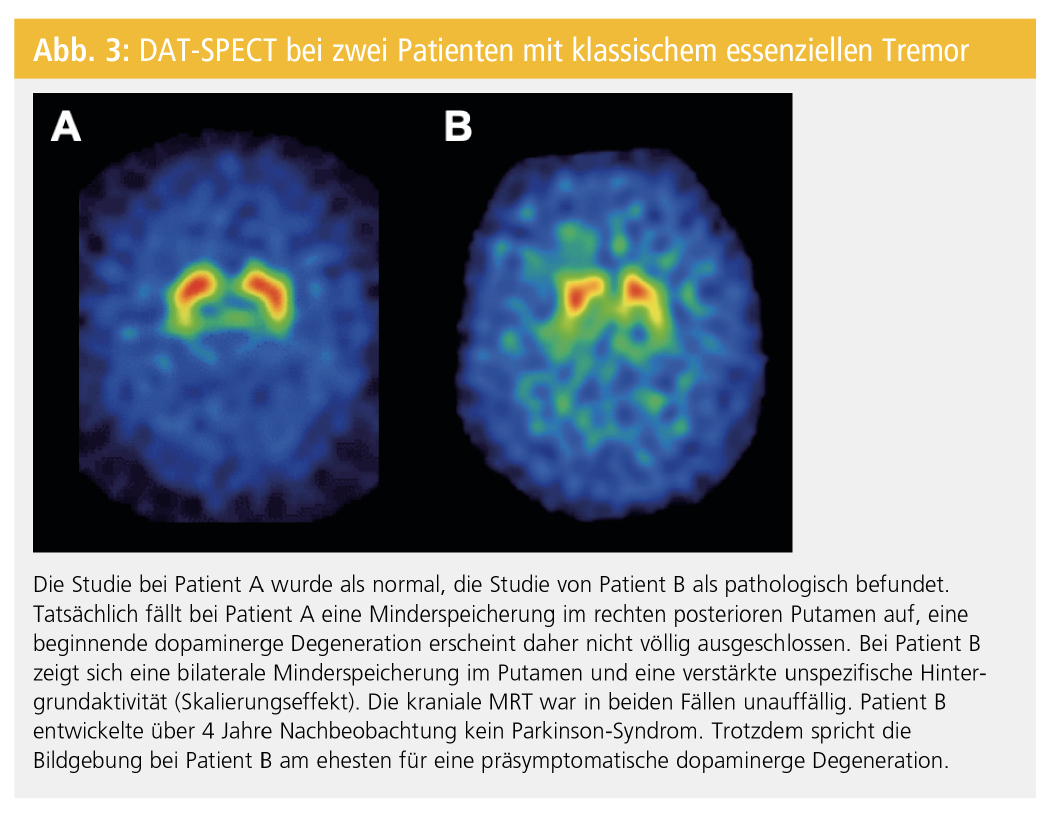
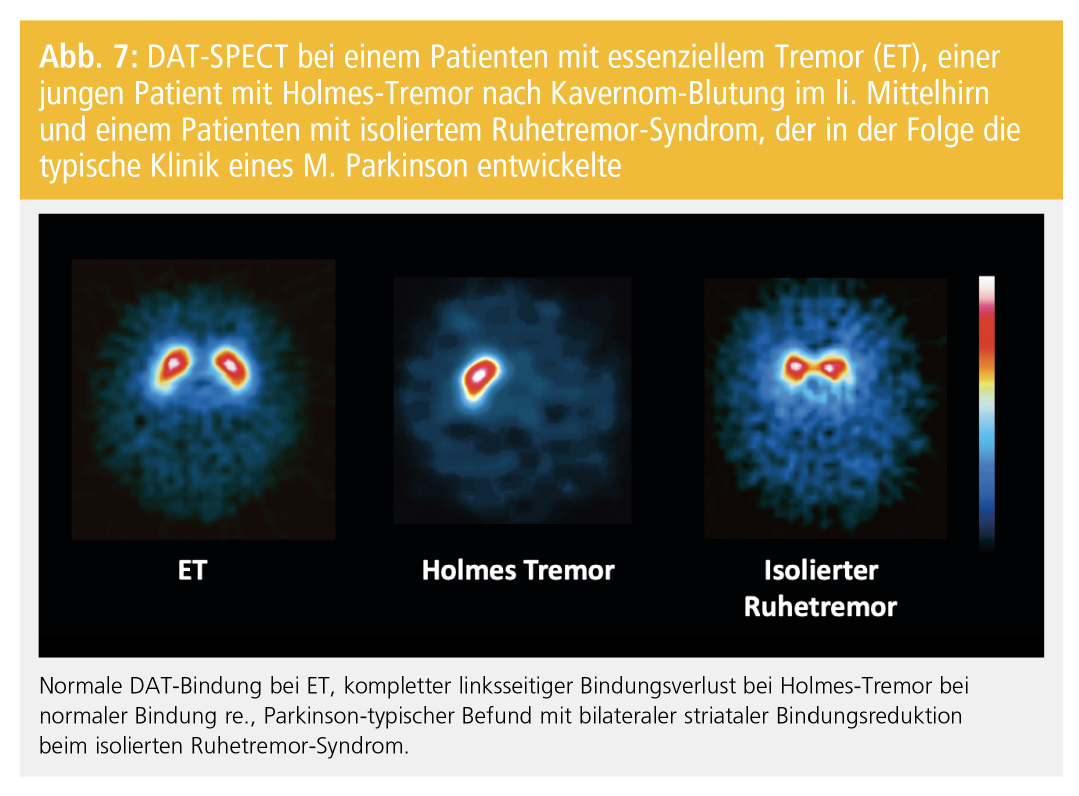
Der klassische ET, definiert als Halte- und Bewegungstremor beider Hände und Unterarme mit oder ohne Kopftremor und ohne andere neurologische Zeichen, wird klinisch diagnostiziert. Ein gleichzeitig bestehender Ruhetremor und andere neurologische Symptome können zu Problemen in der Abgrenzung vom M. Parkinson führen. PatientInnen, die die klinischen Kriterien eines ET erfüllen, jedoch weitere neurologische Symptome wie einen Hypomimie, eine reduzierte Armmitbewegung oder eine fragliche Bradykinese zeigen, werden neuerdings als ET plus klassifiziert. In manchen Fällen kann klinisch nicht sicher zwischen einem beginnendem M. Parkinson und ET differenziert werden. Generell findet sich beim ET pathologisch keine dopaminerge Degeneration. Konsequenterweise ergibt die DAT-SPECT bei diesen PatientInnen einen Normalbefund (Abb. 7). Auch PatientInnen mit dystonem, neuropathischem, medikamenteninduziertem und psychogenem Tremor zeigen in der Regel eine normale striatale DAT-Bindung und sind damit von degenerativen Parkinson-Syndromen differenzierbar.
Beim Holmes-Tremor (rubraler Tremor), einer symptomatischen Tremor-Form mit Ruhe- und Aktionstremor, die durch eine gleichzeitige Läsion des dopaminergen und des zerebellothalamischen Systems charakterisiert ist, ist eine reduzierte striatale F-Dopa- bzw. DAT-Bindung zu erwarten (Abb. 7). Der monosymptomatische Ruhetremor ist als ausschließlicher oder vorzugsweiser Ruhetremor ohne andere Zeichen eines Parkinson-Syndroms mit einer Dauer von zumindest zwei Jahren definiert. F-Dopa-PET-Studien und DAT-SPECT-Studien zeigen bei zumindest einem Teil dieser PatientInnen ein eindeutiges dopaminerges Defizit, was darauf schließen lässt, dass es sich bei diesem Syndrom in vielen Fällen um ein frühes Stadium eines M. Parkinson handelt (Abb. 7).
DAT-SPECT bei atypischen Parkinson-Syndromen
Die Degeneration des nigrostriatalen Systems ist nicht auf den M. Parkinson beschränkt. Atypische Parkinson-Syndrome degenerativer Ätiologie, wie die MSA, die PSP und die kortikobasale Degeneration (CBD), sind durch schlechtes oder fehlendes Ansprechen auf L-Dopa und rascheren Verlauf mit früher Behinderung gekennzeichnet. Neuropathologisch zeigen diese Erkrankungen eine Degeneration zahlreicher Neuronensysteme des ZNS, die üblicherweise das „präsynaptische“ dopaminerge System und im Fall von MSA und PSP „postsynaptische“ Neurone des Striatums einschließt. Die klinische Differenzierung vom M. Parkinson bereitet, besonders im Frühstadium, häufig erhebliche Schwierigkeiten. Die DAT-SPECT zeigt bei MSA und PSP in der Regel eine Reduktion der striatalen Bindung (Abb. 8). Seltene Ausnahmen (mit noch normaler DAT-Bindung) könnten neuerkrankte PatientInnen mit atypischen Parkinson-Syndromen sein, bei denen die Degeneration des präsynaptischen dopaminergen Systems der Degeneration anderer Neuronensysteme nachhinkt.
F-Dopa-PET- und DAT-SPECT-Studien, die PatientInnen mit klinisch diagnostizierter Erkrankung ohne Langzeitnachbeobachtung und ohne Post-mortem-Bestätigung einschlossen, zeigten leichte Unterschiede im Muster der striatalen Bindung zwischen M. Parkinson und atypischen Parkinson-Erkrankungen. Dazu zählte z. B. eine geringer ausgeprägte Rechts-links-Asymmetrie der striatalen Bindung bei der MSA. Eine retrospektive Untersuchung von PatientInnen mit Parkinson-Syndromen, die sich zu Lebzeiten einer DAT-SPECT unterzogen und bei denen im weiteren eine Post-mortem-Untersuchung erfolgte, zeigte jedoch entgegen unseren Erwartungen bei der MSA eine im Gruppenmittel höhere Rechts-links-Asymmetrie der striatalen Bindung als beim M. Parkinson. Der Unterschied ist durch einzelne MSA-PatientInnen mit ausgeprägter klinischer Asymmetrie und starke Rechts-links-Asymmetrie der striatalen Bindung erklärbar (Abb. 8). In einer kleinen Gruppe von PSP-PatientInnen fanden wir ein zu den PatientInnen mit M. Parkinson identes Muster der striatalen DAT-Bindung (unpublizierte Daten). Die DAT-SPECT kann also nicht zwischen M. Parkinson, MSA und PSP differenzieren.
IBZM-SPECT in der Differenzialdiagnose
Bei MSA und PSP degenerieren neben zahlreichen anderen Neuronensystemen des ZNS auch GABA-erge Neurone im Striatum, die postsynaptische Dopamin-D2-Rezeptoren tragen. 123I-Iodobenzamid (IBZM), ein Analog der Benzamid-Neuroleptika Sulpirid und Tiaprid, bindet an D2-Rezeptoren und ermöglicht die Untersuchung des postsynaptischen dopaminergen Systems mit SPECT. PatientInnen mit MSA bzw. PSP zeigen in der IBZM-SPECT in etwa zwei Dritteln der Fälle eine Reduktion der striatalen Bindung. Dagegen ergibt die IBZM-SPECT beim M. Parkinson typischerweise einen Normalbefund. Bei unbehandelten PatientInnen mit M. Parkinson findet sich, besonders kontralateral zur klinisch stärker betroffenen Körperseite, häufig eine Steigerung der striatalen IBZM-Bindung, die durch eine Up-Regulation postsynaptischer Dopamin-Rezeptoren im Frühstadium der Erkrankung bedingt ist. Die IBZM-SPECT kann daher zur Differenzierung zwischen M. Parkinson (Normalbefund) und MSA bzw. PSP (reduzierte Bindung in zwei Drittel der Fälle) beitragen. Während eine pathologische IBZM-Studie, vorausgesetzt eine einwandfreie technische Durchführung und Auswertung der SPECT-Untersuchung, einen M. Parkinson unwahrscheinlich macht, schließt ein Normalbefund eine MSA oder PSP nicht aus. Die IBZM-SPECT kann nicht zwischen MSA und PSP differenzieren.
Einfluss von Medikation auf DAT- und IBZM-SPECT
Die striatale Bindung von DAT-Liganden wird durch die übliche Parkinson-Medikation und die meisten Psychopharmaka nur in geringem Ausmaß beeinflusst, sodass der Effekt solcher Substanzen auf das Ergebnis diagnostischer DAT-SPECT-Untersuchungen irrelevant ist. Die Parkinson-Medikation sollte für die DAT-SPECT bei klinischen Fragestellungen nicht pausiert werden. Ausnahmen von dieser Regel sind Benzatropin, ein Anticholinergikum mit DAT-blockierender Wirkung, das Antidepressivum Bupropion, die vigilanzsteigernde Substanz Modafinil und das in der Therapie des ADHS eingesetzte Methylphenidat. Für Benzatropin und Bupropion wird eine Medikamentenpause von etwa 1 Woche vor der DAT-SPECT-Untersuchung empfohlen, für Modafinil 3 Tage. Relevanten Einfluss auf die DAT-Bindung können auch Drogen wie Kokain und Amphetamin haben, deren primärer pharmakologischer Angriffspunkt der DAT ist.
Die IBZM-Bindung wird dagegen durch zahlreiche, in der betroffenen Population häufig eingesetzte Medikamente stark beeinflusst. Neuroleptika, Antiemetika wie Metoclopramid und die Kalziumantagonisten Flunarizin und Cinnarizin führen zu einer lang anhaltenden Blockade striataler D2-Rezeptoren, die sich in einer mäßig bis stark reduzierten striatalen IBZM-Bindung widerspiegelt. Dopaminagonisten und L-Dopa binden ebenfalls an striatale D2-Rezeptoren und können die IBZM-Bindung leicht bis mäßig reduzieren. Für IBZM-SPECT-Untersuchungen mit der Fragestellung M. Parkinson vs. MSA bzw. PSP sollten nichtretardierte Dopaminagonisten für etwa 5 Tage, Retardpräparate für etwa 1 Woche pausiert werden. Etwa 3 Stunden vor der Untersuchung sollte nach Möglichkeit kein L-Dopa eingenommen werden. Die Einnahme eines Neuroleptikums sollte anamnestisch ausgeschlossen sein. Die sicherste Aussage aus der IBZM-SPECT in der Fragestellung M. Parkinson vs. MSA bzw. PSP ist bei der Untersuchung nichtvorbehandelter PatientInnen zu erwarten.
MIBG-Scan
Erscheint ein Absetzen des Dopaminagonisten für eine IBZM-SPECT-Untersuchung bei einem Patienten/einer Patientin mit schwerem Parkinson-Syndrom klinisch nicht vertretbar, stellt die Untersuchung der noradrenergen Innervation des Herzens mittels der 123I-MIBG-Szintigrafie eine Alternative dar. PatientInnen mit fortgeschrittenem M. Parkinson zeigen regelmäßig eine Degeneration des peripheren autonomen Nervensystems und damit eine reduzierte kardiale MIBG-Aufnahme. Dagegen besteht bei der MSA eine schwerere, jedoch zentrale autonome Störung. Die periphere autonome Innervation und damit die kardiale MIBG-Aufnahme sind intakt. Die kardiale MIBG-Szintigrafie kann daher zwischen fortgeschrittenem M. Parkinson (reduzierte kardiale MIBG Aufnahme) und MSA (Normalbefund) differenzieren. M.-Parkinson-PatientInnen mit kurzer Krankheitsdauer können jedoch eine normale kardiale MIBG-Aufnahme zeigen, was die Methode weniger zuverlässig für die frühe Differenzierung von M. Parkinson und MSA macht.
FDG-PET
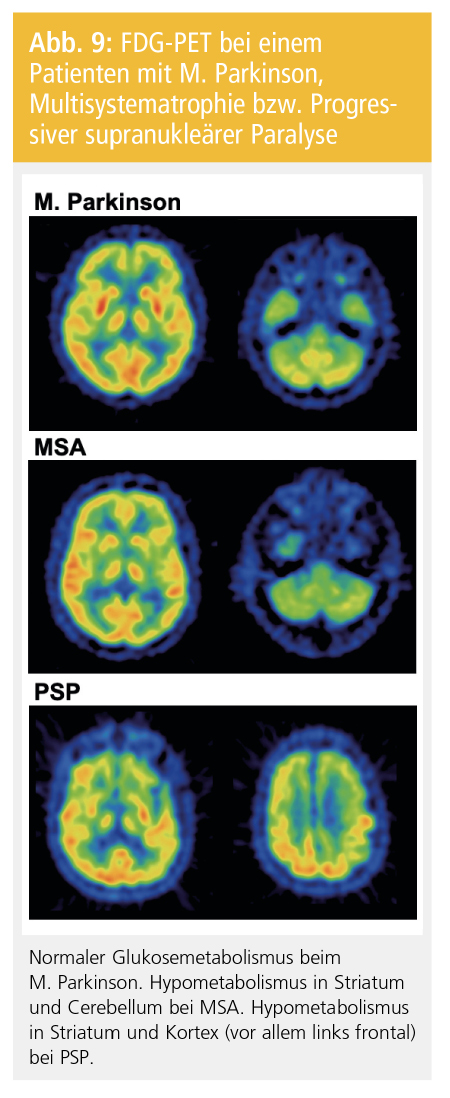
Beim M. Parkinson ergeben Standard-PET-Untersuchungen des zerebralen Glukosestoffwechsels mit 18F-Fluorodesoxyglucose (FDG) üblicherweise Normalbefunde, wenn man von fortgeschrittenen PatientInnen mit Parkinson-Demenz absieht, die einen temporoparietalen Hypometabolismus zeigen können – ein Muster, das jenem beim M. Alzheimer ähnelt. Mit sophistizierten statistischen Methoden („statistical parametric mapping“) findet sich auf Gruppenniveau jedoch auch bei M.-Parkinson-PatientInnen ohne Demenz eine im Vergleich zu gesunden Kontrollen reduzierte Perfusion im posterior-parietalen und im okzipitalen Kortex. Zudem zeigt sich ein relativ zum Kortex gesteigerter Metabolismus im Linsenkern und Thalamus („PD-related pattern“ in der Kovarianzanalyse). Bei der MSA können sich ein reduzierter striataler, kortikaler und zerebellärer Metabolismus zeigen. Bei der PSP betrifft der kortikale Hypometabolismus am stärksten den Frontallappen (Abb. 9). Neueren Untersuchungen nach hat die FDG-PET höhere Sensitivitität und Spezifität in der Differenzialdiagnose als die IBZM-SPECT.
CBD und CBS
Die kortikobasale Degeneration (CBD) ist eine sporadische primäre Tauopathie, die klinisch als kortikobasales Syndrom, als primäre progressive nichtflüssige Aphasie, als progressive Apraxie und als frontale Demenz in Erscheinung treten kann. Unter dem kortikobasalen Syndrom (CBS) versteht man ein klinisches Syndrom, das Zeichen einer Funktionsstörung des Kortex (Apraxie, kortikale Sensibilitätsstörung) und der Basalganglien (Rigor, Bradykinese, Dystonie) bietet. Dem CBS können neben der CBD andere Pathologien einschließlich der PSP, andere frontotemporale lobäre Degenerationen und ein M. Alzheimer zugrunde liegen. Obwohl PSP und M. Alzheimer selten unter dem Phänotyp eines CBS auftreten, machen sie aufgrund der generell größeren Prävalenz möglicherweise die Mehrheit der CBS-Fälle aus. Ein sicherer Rückschluss von der Klinik auf die zugrunde liegende Pathologie ist nicht möglich. Klinisch diagnostizierte Fälle sollten daher das diagnostische Label „CBS“ und nicht „CBD“ erhalten.
Nuklearmedizinische Untersuchungen liegen fast ausschließlich bei PatientInnen mit der Klinik eines CBS vor. Die DAT-SPECT kann bei CBS-PatientInnen im Frühstadium normal sein. Wir beobachteten bei zwei autopsiebestätigten CBD-PatientInnen im Frühstadium in einem Fall eine reduzierte, im anderen Fall eine grenzwertige striatale DAT-Bindung. Beim zweiten Fall zeigte eine Folgeuntersuchung einen eindeutig pathologischen Befund.
Beim CBS kommt es im Gegensatz zur MSA und PSP seltener zu einem Verlust postsynaptischer Dopamin-D2-Rezeptoren; die IBZM-SPECT ergibt meist einen Normalbefund. Zusammengefasst können beim CBS also DAT- und IBZM-SPECT einen normalen oder pathologischen Befund ergeben, wobei eine reduzierte IBZM-Bindung für ein CBS untypisch ist.
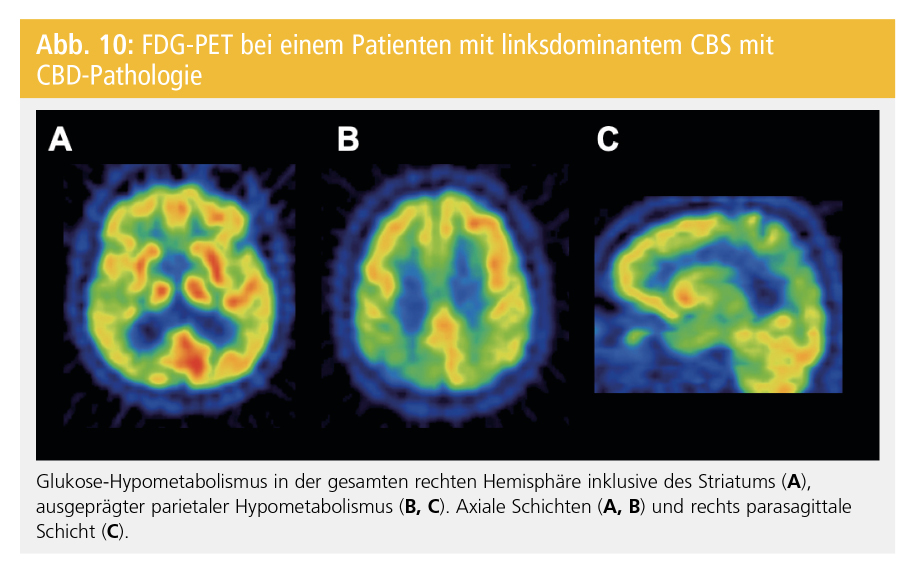
Perfusions-SPECT und FDG-PET können beim CBS eine deutlich asymmetrische Hypoperfusion bzw. einen asymmetrischen Hypometabolismus in Kortex und Basalganglien zeigen, der zu einer Differenzierung von der PSP beitragen kann. Die FDG-PET ist unserer Erfahrung nach die hilfreichste nuklearmedizinische Untersuchung in der Abklärung von PatientInnen mit CBS (Abb. 10).
Demenz mit Lewy-Körperchen
Die Demenz mit Lewy-Körperchen („dementia with Lewy bodies“, DLB) ist mit 15–20 % der Fälle nach dem M. Alzheimer die zweithäufigste Demenzerkrankung. Neuropathologisch ist die DLB durch eine Degeneration des nigrostriatalen dopaminergen Systems, eine schwere Degeneration cholinerger Projektionssysteme und das Auftreten von Lewy-Körperchen im Kortex gekennzeichnet. DLB-PatientInnen zeigen daher wie der M. Parkinson eine reduzierte striatale DAT-Bindung. Der M. Alzheimer zeigt dagegen keine relevante dopaminerge Degeneration und damit keine Bindungsreduktion im DAT-SPECT. DAT-SPECT-Untersuchungen können daher zwischen DLB (reduzierte Bindung) und M. Alzheimer (Normalbefund) unterscheiden. Eine rezente Studie mit post mortem validierten Diagnosen zeigt, dass DLB-PatientInnen in Ausnahmefällen eine normale DAT-Bindung zeigen können. Bei diesen PatientInnen könnte eine kortikale und striatale Lewy-Pathologie ohne relevanten Zellverlust in der Substantia nigra vorliegen.
Typische Veränderungen bei DLB wurden auch mit metabolischen und Perfusionsmarkern beschrieben. So ergeben Perfusions-SPECT und FDG-PET bei der DLB ebenso wie beim M. Alzheimer häufig ein temporoparietales Speicherdefizit. Im Gegensatz zum M. Alzheimer findet sich bei der DLB häufig zusätzlich ein verminderter Uptake im okzipitalen Kortex. Dagegen sind Metabolismus und Perfusion im mesialen Temporallappen (im Einklang mit der im MR oft weniger ausgeprägten mesiotemporalen Atrophie) bei der DLB weniger reduziert als beim M. Alzheimer.
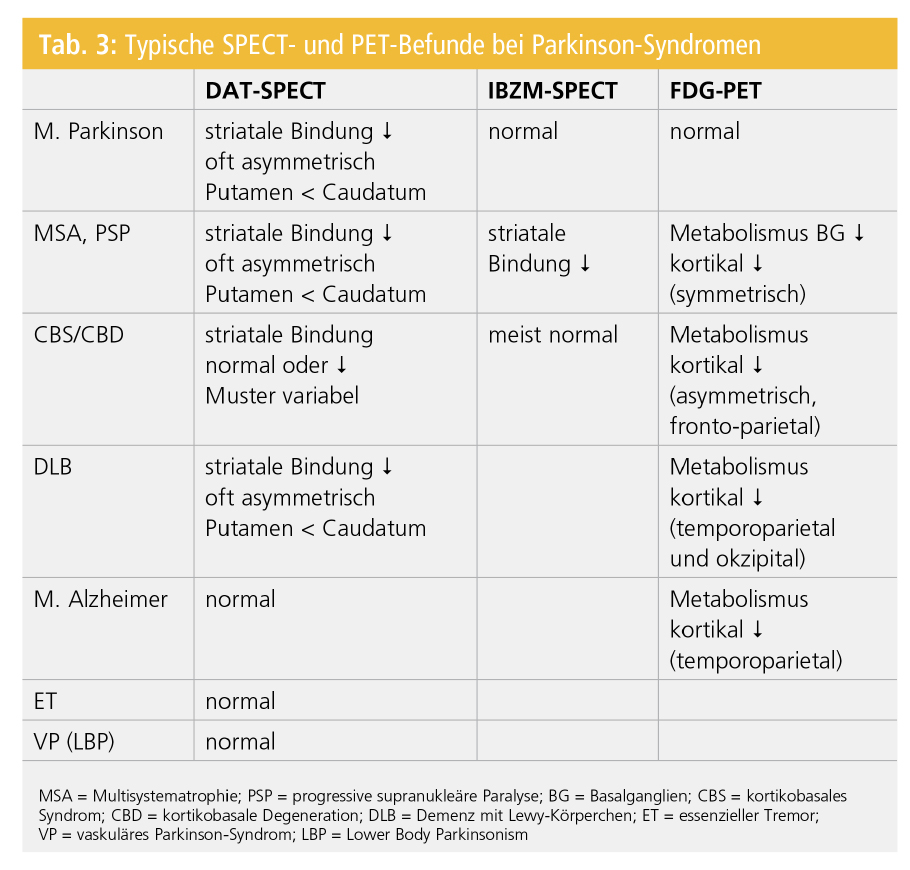
Tabelle 3 zeigt einen Überblick über typische SPECT-Befunde beim M. Parkinson und bei atypischen Parkinson-Syndromen.
Zusammenfassung
Die DAT-SPECT-Untersuchung erlaubt in den meisten Fällen eine frühzeitige Dokumentation der dopaminergen Degeneration beim M. Parkinson und anderen degenerativen Parkinson-Syndromen wie der MSA und PSP. Die DAT-SPECT kann nicht zwischen diesen verschiedenen degenerativen Parkinson-Syndromen differenzieren, diese aber gut von Bewegungsstörungen ohne dopaminerge Degeneration abgrenzen. Struktuelle Läsionen können das Muster der striatalen DAT-Bindung im Einzelfall beeinflussen. Die korrekte Interpretation funktioneller Imaging-Daten setzt daher die Kenntnis des MRT- oder CT-Befunds voraus.
Gelegentlich erlaubt das Muster der striatalen DAT-Bindung keine klare Grenzziehung zwischen normal und pathologisch. Diese grenzwertigen Befunde sollten als solche ausgewiesen werden. Die Behandlerin/der Behandler wird ihre/seine therapeutischen Entscheidungen in diesem Fall vom klinischen Bild und weiteren Verlauf abhängig machen. Bei ursprünglich grenzwertigem Befund kann eine Kontrolle der SPECT-Untersuchung nach mindestens einem Jahr sinnvoll sein. Im Übrigen gibt es keine klinische Indikation für die Wiederholung einer DAT-SPECT-Untersuchung.
Die Untersuchung postsynaptischer Dopamin-D2-Rezeptoren mit 123I-IBZM kann zur Differenzialdiagnose zwischen M. Parkinson und MSA bzw. PSP beitragen. Die Untersuchung des zerebralen Glukosemetabolismus mittels 18F-FDG-PET sowie moderne MRT-basierte Methoden dürften in dieser Fragestellung jedoch eine höhere Sensitivität und Spezifität haben.
Danksagung
Der Autor dankt seinen nuklearmedizinischen KooperationspartnerInnen, allen voran Prof. Siroos Mirzaei, Institut für Nuklearmedizin mit PET-Zentrum, Wilhelminenspital, und Frau Doz. Tatjana Traub-Weidinger, Universitätsklinik für Radiologie und Nuklearmedizin, MUW, für die gute Zusammenarbeit.


























































































_Wilhelminenspital,_Bernhard_Noll_opt.jpg)



