Standards in den Stadien II, III und künftige Entwicklungen – Adjuvante Therapie des Kolonkarzinoms
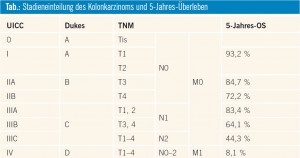
Das kolorektale Karzinom ist mit fast 5.000 Neuerkrankungen pro Jahr nach dem Brustkrebs der zweithäufigste maligne Tumor bei der Frau und nach dem Bronchial- und dem Prostatakarzinom der dritthäufigste Tumor beim Mann in Österreich. Entscheidend für die Prognose und die Wahl der Therapieoptionen ist das Ausbreitungsstadium zum Diagnosezeitpunkt. Ist der Tumor auf die Schleimhaut begrenzt, kann durch eine radikale Entfernung ein 5-Jahres-Überleben von 93 % erreicht werden, bei zusätzlichen Lymphkontenbefall sinkt das 5-Jahres-Überleben auf 44–83 % und beträgt im metastasierten Stadium nur mehr ca. 8 % (Tab.). Während für loko – regionale Stadien (UICC I-III oder Dukes A-C) die Operation mit kurativer Zielsetzung im Zentrum des therapeutischen Vorgehens steht und durch (neo-)adjuvante Therapiemaßnahmen ergänzt wird, steht die systemische Therapie im metastasierten Stadium (UICC IV oder Dukes D) im Mittelpunkt der therapeutischen Bemühungen.
UICC-Stadium III (Tx, N1-2, M0)
Mit Veröffentlichung der amerikanischen Intergroup-Studie an über 900 Patienten durch Moertel und Mitarbeiter im Jahr 1990 wurde die adjuvante Chemotherapie mit 5-Fluorouracil (5-FU) + Levamisol über 12 Monate zum Standard im Stadium III des Kolonkarzinoms1. Nachfolgende Studien zeigten, dass eine sechsmonatige 5-FU-Bolus- plus Leucovorin- Therapie (Mayo-Clinic-Schema) die gleiche Wirksamkeit hat wie das zwölfmonatige Moertel-Schema. Die Rezidivrate kann um 30–40 % gesenkt und das 5-Jahres-Überleben um 20–30 % gesteigert werden.
Vergleiche zwischen 5-FU-Bolus-Schemata mit infusionalem 5-FU zeigten eine vergleichbare Wirksamkeit, jedoch mehr Toxizität im 5-FU-Bolus-Schema.
Mit Capecitabin und UFT stehen zwei orale 5-FU-Prodrugs für die Behandlung des Kolonkarzinoms zur Verfügung. Capecitabin hat sich in der X-ACT-Studie als mindestens genauso effektiv und weniger toxisch als Bolus 5-FU/LV erwiesen. UFT, ein orales 5-FU-Prodrug kombiniert mit Uracil, zeigte in der NSABPC06- Studie (National Surgical Adjuvant Breast and Bowel Project) im Vergleich mit 5-FU-Bolus ähnliche Toxizitäts- und Überlebensraten.
Nach Etablierung von Kombinationschemotherapien im metastasierten Stadium wurde die Wirksamkeit von Oxaliplatin im adjuvanten Einsatz überprüft. In drei großen Studien (MOSAIC-, NSABP-C07- und XELOXA-Studie) zeigte sich durch den Zusatz von Oxaliplatin zur 5-FU-basierten Chemotherapie sowohl eine 4 bis 6%ige Verbesserung des krankheitsfreien Überlebens als auch ein signifikanter Vorteil im Gesamtüberleben im Stadium III2–4. Aufgrund dieser Ergebnisse gilt FOLFOX-4 (5-FU, LV, Oxaliplatin) als Standard in der adjuvanten Chemotherapie des Kolonkarzinoms im Stadium III. Bei Risiko für höhere Toxizitäten oder sonstige Kontraindikation gegen Oxaliplatin sind infusionale 5-FU/LV-Regime (De Gramont) und Capecitabin Therapiealternativen in der adjuvanten Behandlung. Auch Irinotecan hat sich im metastasierten Stadium als effektiver Kombinationspartner zur 5-FU-basierten Chemotherapie erwiesen. Im adjuvanten Setting konnte der Zusatz von Irinotecan zu 5-FU jedoch keinen Überlebensvorteil zeigen.
Stadium II
Patienten im Stadium II haben mit alleiniger R0-Resektion ein 5-Jahres-Überleben von 70–80 %. Der Stellenwert der adjuvanten Chemotherapie im Stadium II des Kolonkarzinoms ist derzeit noch unklar. Die absolute Risikoreduktion durch eine 5-FU-haltige Chemotherapie beträgt 3–5 % mit nur einem marginalen Überlebensvorteil von 1–5 %5, 6. Die adjuvante Chemotherapie wird daher nicht generell für alle Patienten im Stadium II empfohlen. Nach dem ASCO-Empfehlungen 2004 und den ESMO-Guidelines 2008 sollte eine adjuvante Chemotherapie im Stadium II in bestimmten Risikosituationen (Perforation, T4-Stadium, G3-Tumor, < 12 untersuchte Lymphknoten, Gefäßinvasion, Lymphangiosis, hohe CEASpiegel) mit dem Patienten diskutiert werden.
Ältere Patienten
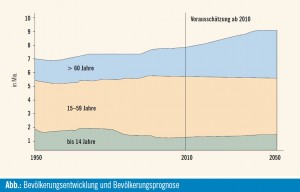 In Österreich treten mehr als 70 % der Kolorektalkarzinome bei Patienten über 65 Jahre auf. Mit Anstieg der Lebenserwartung und Verschiebung der Altersstruktur zu älteren Menschen hin (Abb.) wird in Zukunft eine Steigerung der Anzahl älterer Patienten erwartet, die an einem Kolorektalkarzinom erkranken. Geriatrisch- onkologische Patienten profitieren grundsätzlich gleichermaßen von einer Chemotherapie wie jüngere Patienten. Aufgrund der Heterogenität in dieser Population von fitten älteren Patienten zu immobilen, multimorbiden Patienten sollte anhand von geriatrischen Assessments die individuelle Belastbarkeit bestimmt werden. Im Stadium III profitieren ältere Patienten > 70 Jahre genauso wie jüngere Patienten von einer 5-FU-haltigen Chemotherapie, wie es in einer Metaanalyse von 7 klinischen Studien gezeigt werden konnte7. Subgruppenanalysen aus 3 großen randomisierten Studien konnten allerdings in der Gruppe > 70 Jahre für Oxaliplatin keinen zusätzlichen Überlebensgewinn zeigen. Im Stadium II liegen keine eigenen Auswertungen für geriatrische Patienten vor. Hier sind neben den Tumorparametern die altersbedingten Therapierisiken mit einzubeziehen.
In Österreich treten mehr als 70 % der Kolorektalkarzinome bei Patienten über 65 Jahre auf. Mit Anstieg der Lebenserwartung und Verschiebung der Altersstruktur zu älteren Menschen hin (Abb.) wird in Zukunft eine Steigerung der Anzahl älterer Patienten erwartet, die an einem Kolorektalkarzinom erkranken. Geriatrisch- onkologische Patienten profitieren grundsätzlich gleichermaßen von einer Chemotherapie wie jüngere Patienten. Aufgrund der Heterogenität in dieser Population von fitten älteren Patienten zu immobilen, multimorbiden Patienten sollte anhand von geriatrischen Assessments die individuelle Belastbarkeit bestimmt werden. Im Stadium III profitieren ältere Patienten > 70 Jahre genauso wie jüngere Patienten von einer 5-FU-haltigen Chemotherapie, wie es in einer Metaanalyse von 7 klinischen Studien gezeigt werden konnte7. Subgruppenanalysen aus 3 großen randomisierten Studien konnten allerdings in der Gruppe > 70 Jahre für Oxaliplatin keinen zusätzlichen Überlebensgewinn zeigen. Im Stadium II liegen keine eigenen Auswertungen für geriatrische Patienten vor. Hier sind neben den Tumorparametern die altersbedingten Therapierisiken mit einzubeziehen.
Künftige Entwicklungen
Antikörpertherapie im adjuvanten Setting
Ein weiterer Fortschritt in der Behandlung des Kolorektalkarzinoms im metastasierten Stadium konnte in jüngster Zeit durch Etablierung von monoklonalen Antikörpern zur Chemotherapie erzielt werden. Derzeit gibt es 3 monoklonale Antikörper, die im klinischen Einsatz sind. Cetuximab und Panitumumab sind gegen den epidermalen Wachtsumsfaktorrezeptor (EGFR) gerichtet, und Bevacizumab blockiert über Bindung an VEGF (vascular endothelial growth factor) die Angiogenese. Diese zielgerichteten Substanzen werden derzeit in der adjuvanten Indikation überprüft. Erste Ergebnisse der NSABP-C08-Studie zeigten keine signifikante Verbesserung des krankheitsfreien Überlebens im gesamten Studienverlauf bei einjähriger Gabe von Bevacizumab zusätzlich zur 6-monatigen modifizierten Chemotherapie mit FOLFOX- 68. Es konnte jedoch eine transiente Verbesserung des krankheitsfreien Überlebens während der einjährigen Behandlung mit Bevacizumab beobachtet werden. Dieser Effekt war jedoch nach 3 Jahren nicht mehr nachweisbar. Mit Spannung werden nun die Ergebnisse der europäischen AVANT-Studie und der QUASAR-2-Studie erwartet, die ebenfalls den Nutzen von Bevacizumab im ad juvanten Setting untersuchen. Gegenwärtig wird die Wirksamkeit des monoklonalen Antikörpers Cetuximab in der PETACC-8-Studie und der NCCTGNO147- Studie im adjuvanten Setting überprüft. Die erste Auswertung der NCCTG-NO147-Studie am ASCO 2010 zeigte keine Verminderung der Rezidivrate durch Zugabe von Cetuximab zur Standardchemotherapie nach dem FOLFOX- Schema. Die PETACC-8-Studie wurde bereits 2008 geschlossen. Erste Ergebnisse werden für 2011–2012 erwartet. Derzeit wird die routinemäßige Gabe von monoklonalen Antikörpern im adjuvanten Setting nicht empfohlen. Zusammen mit den laufenden Studien müssen künftige Studien den Stellenwert von monoklonalen Antikörpern in der adjuvanten Therapie weiter überprüfen.
Therapieoptimierung durch sorgfältige Patientenselektion
Aufgrund des nur geringen Benefits einer 5-FU-haltigen Chemotherapie im Stadium II sind besonders für diese Patientengruppe die Identifikation und Etablierung von prognostischen und prädiktiven Markern notwendig. Die Bestimmung des K-ras-Status als prädiktivem Marker wird bereits routinemäßig eingesetzt. Patienten mit einem mutierten K-ras-Gen profitieren nicht von einer Therapie mit dem monoklonalen Antikörpern Cetuximab und Panitumumab. K-ras ist jedoch kein prognostischer Marker. Mikrosatelliteninstabilität scheint ein prädiktiver Marker für den Nutzen einer adjuvanten Chemotherapie zu sein. Patienten im Stadium II mit einem defekten DNA-Mismatch-Repair profitieren nicht von einer 5-FU-haltigen Chemotherapie, durch Zusatz von Oxaliplatin oder Irinotecan wird dieser negative Einfluss von 5-FU jedoch wieder aufgehoben. Genetische Tests (wie Coloprint) können Patienten mit kolorektalem Karzinom im Stadium II identifizieren, die von einer adjuvanten Chemotherapie profitieren würden.
Körperliche Aktivität
In den letzten Jahren konnten mehrere Beobachtungsstudien eine Reduktion der Rezidivrate und eine Verlängerung des krankheitsfreien Überlebens durch körperliche Aktivität nach Beendigung der adjuvanten Therapie bei PatientInnen mit Kolon- und Mammakarzinom auf – zeigen. Zwei Kohortenstudien von Meyerhardt et al. zeigten eindrucksvolle Ergebnisse beim nichtmetastasierten Kolonkarzinom. In der ersten Beobachtungsstudie wurden Frauen mit einer Kolonkarzinomanamnese nach ihrer körperlichen Aktivität im Rahmen der Nurses Health Study (NHS) befragt9. Eine postoperative körperliche Aktivität von umgerechnet 18 metabolischen Einheiten (MET) pro Woche zeigte einen deutlichen Rückgang der relativen kolonkarzinomassoziierten Mortalität von 56 % im Vergleich zur inaktiveren Gruppe. In einer weiteren prospektiven Beobachtungsstudie von Meyerhardt et al. wurden 832 Patientinnen mit einem Kolorektalkarzinom im Stadium III nach ihrer körperlichen Aktivität sechs Monate nach Ende der Chemotherapie befragt10. In der Gruppe mit einer körperlichen Aktivität von 18 MET pro Woche konnte eine relative Reduktion des Rezidivrisikos von 50–60 % sowie eine Verbesserung des Gesamtüberlebens erreicht werden. Nach 3 Jahren betrug das krankheitsfreie Überleben bei Patienten mit weniger als 18 MET pro Woche 75,1 % im Vergleich zu 84,5 % bei Patienten, die mehr als 18 MET pro Woche ausübten. Daten der bisher durchgeführten Beobachtungsstudien lassen auf eine hohe therapeutische Wirksamkeit von körperlichem Training schließen. Ergebnisse von prospektiv randomisierten Studien gibt es zu diesem Thema bisher nicht. Derzeit wird in Rahmen einer Pilotstudie der „Austrian Breast & Colorectal Cancer Study Group“ (ABCSG) die Machbarkeit eines strukturierten Trainings nach Abschluss der adjuvanten Chemotherapie bei Patienten mit Kolorektalkarzinom im Stadium III und II mit Risikofaktoren überprüft.
Zusammenfassung
Eine 6-monatige adjuvante Therapie mit FOLFOX oder XELOX ist derzeit Standardtherapie im Stadium III des Kolonkarzinoms. Patienten mit Kontraindikation für Oxaliplatin sollten eine 5-FU-basierte Chemotherapie erhalten (De-Gramont, Capecitabin). Ältere Patienten > 70 Jahre profitieren wie jüngere Patienten von einer 5-FU-haltigen Chemotherapie, die zusätzliche Gabe von Oxaliplatin bringt jedoch keinen darüber hinausgehenden Überlebensgewinn. Die routinemäßige Verabreichung einer adjuvanten Chemotherapie im Stadium II wird nicht generell empfohlen. Bei Patienten mit Hochrisikofaktoren im Stadium II sollte jedoch eine 5-FU-haltige Chemotherapie erwogen werden. Irinotecan und monoklonale Antikörper haben derzeit keinen Stellenwert in der adjuvanten Behandlung.
1 Moertel CG et al., Levamisol and fluorouracil for adjuvant therapy of resected colon carcinoma. N Engl J Med 1990; 322:352–8
2 André T et al., Multicenter International Study of Oxaliplatin/5-Fluorouracil/ Leucovorin in the adjuvant treatment of colon cancer (MOSAIC). N Engl J Med 2004; 350:2343–51
3 Kuebler JP et al., Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP C-07. J Clin Oncol 2007; 25:2198–2204
4 Haller DG et al., First efficacy findings from a randomized phase III trial of capecitabine + oxaliplatin versus bolus 5-FU/LV for stage III colon cancer. Eur J Cancer Suppl 2009; 7:4
5 Gray R et al., Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet 2007; 370:2020–2029
6 Sargent DJ et al., End points for colon cancer adjuvant trials: observations and recommendations based on individual patient data from 20.898 patients enrolled onto 18 randomized trials from the ACCENT group. J Clin Oncol 2009; 4569–4574
7 Sargent DJ et al., A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. N Engl J Med. 2001; 345:1091–1097
8 ASCO Annual Meeting 2009, Plenary Session – A phase III trial assessing bevacizumab in stage II and III carcinoma of the colon: Results of NSABP Protocol C-08
9 Meyerhardt JA et al., Physical activity and survival after colorectal cancer diagnosis. J Clin Oncol 2006; 24:3527–34
10 Meyerhardt JA et al., Impact of physical activity on cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J Clin Oncol 2006; 24:3535–41