Perioperative Therapie des Rektumkarzinoms
Ziele der perioperativen Therapie
Laut ESMO 2009 sind die Ziele der perioperativen Therapie2:
1. niedriges Rezidivrisiko (sowohl Lokalrezidive als auch Fernmetastasen)
2. geringe Früh- und Spätmorbidität
3. Erhaltung einer guten Sphinkterfunktion
Im Tumorstadium II und III kann durch eine präoperative Radiotherapie das Lokalrezidivrisiko gesenkt werden. Bei tiefen/ sphinkternahen Tumoren ist die sphinktererhaltende Operation durch eine präoperative Radiotherapie in einem deutlich höheren Prozentsatz möglich. Auch bei optimaler Chirurgie (TME) beträgt die Lokalrezidivrate im Stadium II und III bis zu 10 %. Die Prognose des Lokalrezidivs ist schlecht, das mediane Überleben beträgt 12–18 Monate. Komplett pathologische Responseraten von 10–25 % können durch die präoperative Chemoradiatio erreicht werden. Diese Therapie ist jedoch im Vergleich zur alleinigen chirurgischen Therapie mit einer gering erhöhten Komplikationsrate assoziiert. Möglicherweise kann bei einzelnen Patienten mit geringem Lokalrezidivrisiko eine alleinige Therapie mittels chirurgischer Resektion und adjuvanter Chemotherapie durchgeführt werden.
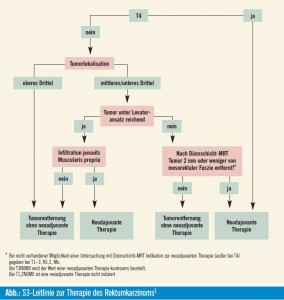
Stadium I UICC (T1,T2,N0)
Perioperative Therapie
Im Regelfall besteht keine Indikation zur perioperativen Therapie. Bei so genannten malignen Polypen T1 (sm1, sm2?) mit günstiger Prognose ist eine lokale Behandlung mit Polypektomie, endoskopischer Mukosaresektion (EMR), endoskopischer Submukosadissektion (ESD) oder transanaler endoskopischer Mikrochirurgie (TEM) ausreichend, sofern klar eine R0-Resektion vorliegt und ein Grading G1–2 und L0V0 am histologischen Präparat bestätigt wurden.
Operation
Durch eine alleinige radikale Operation, d. h. durch die totale mesorektale Exzision (TME) mit En-bloc-Nll-Dissektion für Tumoren im unteren (< 6 cm) und mittleren (6–12 cm) Drittel und durch die partielle mesorektale Exzision (PME) mit En-bloc-Nll-Dissektion für Tumoren im oberen Drittel (12–16 cm) wird eine niedrige Lokalrezidiv- und Fernmetastasierungsrate erreicht. Eine mögliche Indikation zur perioperativen Radiochemotherapie besteht vor oder nach lokaler Exzision eines T1-high-risk-Karzinoms (G3/4, L1, V1, Tumorgröße > 3 cm, R1- Resektion). Grundsätzlich soll bei Risikofaktoren oder R1-Resektion primär eine radikale Tumorentfernung innerhalb von 4 Wochen angestrebt werden. Sollte ein Patient mit tief sitzendem T1-high-risk- Karzinom oder T2N0 die Rektumexstirpation ablehnen, kann im Ausnahmefall eine präoperative Radiochemotherapie mit anschließender lokaler Exzision erwogen werden.
Stadium II/III (UICC)
Perioperative Therapie
Bei Tumoren im UICC-Stadium II und III ist eine neoadjuvante Radio- oder Radiochemotherapie als Standard anzusehen. Im Einzelfall kann bei cT1/2-Karzinomen mit fraglichem Nll-Befall eine primäre chirurgische Resektion erfolgen. Sollte postoperativ ein pN+ gefunden werden, ist eine adjuvante Radiochemotherapie zu empfehlen. Mehrere Metaanalysen weisen auf Vorteile der präoperativen im Vergleich zur postoperativen Radiatio hin. Speziell die Lokalrezidivrate war in mehreren Studien in der neoadjuvanten Behandlungsgruppe deutlich günstiger. Operative Komplikationen und Wundheilungsstörungen waren nach präoperativer Radiochemotherapie im Vergleich zur Sofort-Operation nicht höher.9
• Stadium II/III oberes Drittel; 12 bis 16 cm ab Anokutanlinie: Die Studienlage zum Vorteil einer präoperativen Radiochemotherapie ist nicht so klar, möglicherweise können die Rektumkarzinome im oberen Drittel wie Kolonkarzinome betrachtet werden, somit würde keine neoadjuvante Therapie durchgeführt werden.
• Bei präoperativem Tumorstadium T1/T2 mit fraglichem Lymphknotenbefall ist auch die primäre Operation eine mögliche Therapieoption. Aufgrund der (wenngleich geringen) Radiatio-Nebenwirkungen wird die primäre Operation von manchen Zentren auch bei T3/N0-Tumoren mit einem Abstand von > 1 mm zur mesorektalen Resektionslinie (Dünnschicht- MR) empfohlen.
Therapeutisches Vorgehen:
1. Kurzzeit-Radiatio: 25 Gy in 5 Einzeldosen an 5 aufeinander folgenden Tagen (Mo–Fr), Operation unmittelbar anschließend (üblicherweise Folgewoche). Damit wird eine klare Verbesserung des Lokalrezidivrisikos, jedoch keine wesentliche Tumorschrumpfung erreicht, da nur eine geringere Strahlendosis verabreicht wird und der Abstand zur Operation – die Zeit für eine Tumorregression – zu kurz ist.
2. Langzeit-Radiatio: Gesamtreferenzdosis 45–50,4 Gy in 25–28 Einzeldosen, gefolgt von der Operation nach 4–6 Wochen. Dieses Schema wird bei T4-Tumoren bevorzugt, insbesondere bei Tumoren im unteren Rek – tumdrittel – wo die Sphinktererhaltung ohne Downsizing nicht sicher möglich erscheint – oder bei nicht ausreichendem Sicherheitsabstand zur mesorektalen Faszie (im Dünnschicht- MR Abstand 1 mm oder weniger). Bei cT3-Tumoren oder N+ Tumoren, bei denen kein Downsizing notwendig ist, kann präoperativ eine Kurzzeit-Radiatio oder eine Radiochemotherapie durchgeführt werden, in der Regel wird der Kurzzeitbestrahlung der Vorzug gegeben.
3. Chemotherapie bei neoadjuvanter Radiochemotherapie/Langzeitra – diatio: Es erfolgt eine 5FU-Mono – therapie (kontinuierlich möglicherweise besser als Bolus) mit oder ohne Folinsäure; wahrscheinlich kann auch eine Monotherapie mit Capecitabin mit gleich gutem Erfolg verabreicht werden.
Diskussionspunkte der neoadjuvanten Therapie
Potenzielles Overstaging: Von der „German Rectal Cancer Study Group“ konnte in der postoperativen Chemoradiatio- Gruppe bei 18 % der Patienten ein Stadium I gefunden werden, wo aber präoperativ durch endorektalen Ultraschall ein Overstaging mit T3/T4 oder N1 diagnos – tiziert worden war. Ein vergleichbarer Prozentsatz ist möglicherweise in der präoperativen Chemoradiatio-Gruppe überbehandelt worden, bei Patienten, bei welchen T3- oder N+-Tumoren diagnostiziert worden waren. Die Beurteilung des Lymphknotenbefalls ist limitiert, manche Zentren diskutieren bei T3-Tumoren mit Infiltration ins mesorektale Fettgewebe unter 5 mm sowie bei Tumoren mit einem Sicherheitsabstand zur mesorektalen Resektionslinie von mehr als 1 mm die primäre Operation.
Präoperative vs. postoperative Strahlentherapie: Eine Vergleichsstudie von Sebag-Montefiore et al. (Lancet 20093) zwischen präoperativer Radiatio (Kurzzeit 5 x 5 Gy) und selektiver postoperativer Radiatio (45 Gy über 5 Wo + 5-FUChemotherapie) nur bei positivem Resektionsrand (CRM+, circumferential resection margin) zeigte einen klaren Vorteil für das Lokalrezidivrisiko und für das krankheitsfreie Überleben (DFS) in der präoperativ bestrahlten Gruppe; das Gesamtüberleben war ident. Diese Ergebnisse bestätigten sich in allen Subgruppen (Größe, Stadium, CRM +/–).
Nebenwirkungsprofil der neoadjuvanten Radiochemotherapie: In Fragebogen mit Analogskalen (bis 24 Monate) zeigte die Lebensqualität nur geringe Unterschiede; gering erhöht war die Rate an Stuhlinkontinenz und der Sexual Disorders in der präoperativ bestrahlten Gruppe. Die Strahlenproktitis war nur in einem kleinen Prozentsatz vorhanden
Stadium IV
Beim synchron metastasierten Rektumkarzinom existiert keine Standardempfehlung für einen Therapie-Algorithmus. Das therapeutische Vorgehen und die Prognose werden grundsätzlich durch das Ausmaß und die Lokalisation der Metastasierung bestimmt. Meist wird eine systemische Kombinationstherapie eingesetzt werden, sofern nicht durch die Ausdehnung des Primärtumors andere Maßnahmen (chirurgische oder lokal – therapeutische wie z. B. Laserbehandlung oder Radiotherapie) notwendig werden.
Intensivierung der neoadjuvanten Chemotherapie
„ACCORD 12/0405 Prodige 2“-Studie4: In dieser Studie wurde Oxaliplatin additiv zur Radiotherapie bei cT2-4-Tumoren verabreicht. Ingesamt wurden 598 Patienten in 2 Gruppen behandelt, der CAP-45-Gruppe (Radiatio 45 Gy plus Capecitabin) und der CAPOX-50-Gruppe (Radiatio 50 Gy plus Capecitabin + Oxaliplatin während 5-wöchiger Bestrahlung). Operiert wurde nach 6 Wochen. Im Ergebnis waren Grad-III- und -IV-Toxizitäten in der CAPOX-Gruppe erhöht (25 % vs. 11 %, großteils Diarrhoen), die ypCRRate konnte von 14 % auf 19 % erhöht werden (nicht signifikant), und Fernmetastasen waren mit 2,8 % vs. 4,2 % in der Oxaliplatingruppe etwas seltener.
STAR-01-Studie5: Die italienische Studie versuchte ein ähnliches Schema mit Oxaliplatin und behandelte insgesamt 747 Patienten (T3/4, N+). Die Therapie bestand aus 5-FU und konkomitanter Radiatio +/– Oxaliplatin, die Operation fand 6–8 Wochen später statt. Auch hier war die Toxizität erhöht (Grad III/IV 24 % vs. 8 %), die ypCR-Rate betrug in beiden Gruppen 16 %, und es fand sich ein gering günstiger Einfluss auf die Fernmetastasierungsrate (16 vs. 2 Patienten, signifikant).
Zusammenfassend kann eine Intensivierung der Standardchemotherapie durch die Zugabe von Oxaliplatin derzeit noch nicht als Standard empfohlen werden.
Induktionschemotherapie
Mit der bisherigen perioperativen Therapie konnte zwar die Rate an Lokalrezidiven verringert werden, die Rate der Fernmetastasierung blieb jedoch gleich. Dazu kommt, dass nach präoperativer Radiochemotherapie und Operation nur ca. 60 % aller Patienten die geplante postopera – tive Chemotherapie erhalten. Durch die so genannte Induktionschemotherapie (bisherige Studien verwendeten großteils Kombinationen von Oxaliplatin und Capecitabin) würde die gesamte Chemotherapie in die präoperative Phase verlegt werden – das Ziel ist die Steigerung des Gesamtüberlebens. Die bisherigen Ergebnisse zeigen eine ebenso gute Rate an R0-Resektionen, die pCR-Raten schwanken zwischen 13 % und 20 %, Langzeitergebnisse bezüglich overall survival sind allerdings noch ausständig6, 7.
Evaluation des Ansprechens nach präoperativer Radiochemotherapie
Nach präoperativer Therapie erfolgt die Beurteilung der Tumorregression mittels MRI und PET-CT, wobei das Ansprechen in drei Gruppen unterschieden wird: jene mit complete response (pCR), some response (good, moderate, poor) und no response. Derzeit besteht keine klare Richtlinie, ob sich das Ausmaß der Chirurgie an der durch die neoadjuvante Therapie erzielten Tumorregression orientieren soll.
Pathologische Komplettremission: Zur prognostischen Bedeutung der pathologischen Komplettremission nach neoadjuvanter Radiochemotherapie wurde eine Metaanalyse (n = 3.105) in Lancet Oncology8 publiziert: Im Ergebnis dieser Untersuchung betrug die pCR-Rate der präoperativ behandelten Patienten 15,6 %. Bei diesen Patienten fand sich eine signifikante Verbesserung des disease free survivals, des Lokalrezidivrisikos und auch des overall survivals nach 5 Jahren. Prognostisch ungünstige Faktoren waren T4, N+ und APR (abdominoperineale Resektion). Das Gesamtüberleben wurde durch eine postoperative adjuvante Chemotherapie günstig beeinflusst. Die Rate der durch die neoadjuvante Therapie erreichten pathologischen Komplettremissionen ist durch das Ausmaß der Dissektion mitbestimmt, d. h. die Standards der Dissektion sind bei Vergleichsstudien zu beachten. Die Tumorregression nach neoadjuvanter Therapie wird als unabhängiger Prognosefaktor gewertet, dies gilt jedoch nur für den kompletten oder sehr guten Respons (keine oder < 10 % Tumorzellen im Resektat).
Adjuvante Chemotherapie nach neoadjuvanter Behandlung
Nach neoadjuvanter Radio-/Chemotherapie sollte laut S3-Leitlinie eine adjuvante Chemotherapie mit 5-FU unabhängig vom postoperativen Tumorstadium erfolgen (somit auch bei kompletter Remission oder in den UICC-Stadien I oder II). Nach neoadjuvanter Kurzzeitbestrahlung gibt es keine ausreichenden randomisierten Daten für eine adjuvante Chemotherapie. Bisherige Therapiestudien und Analogschlüsse sprechen für die Durchführung einer adjuvanten Chemotherapie wie beim Kolonkarzinom.
Adjuvante Therapie bei primärer Operation ohne vorangegangene neoadjuvante Therapie
• Stadium I mit R0-Resektion: keine Indikation
• Stadium II und III: Eine adjuvante Radiochemotherapie wird empfohlen, wenn weder eine neoadjuvante Radiochemotherapie noch eine Kurz zeit- Radiotherapie präoperativ durchgeführt worden waren.
• Nach R1-Resektion oder intraopera – tivem Tumoreinriss sollte postoperativ radiochemotherapiert werden, falls keine neoadjuvante Radiochemotherapie vorangegangen ist. Die adjuvante Therapie soll 4 bis 6 Wochen nach der Operation be gonnen werden. Die Strahlentherapie kann zeitgleich zum 1. und 2. Chemotherapiezyklus oder zum 3. und 4. Chemotherapiezyklus erfolgen. Es wird eine 5-FU-Monochemotherapie als Kombination zur Strahlentherapie empfohlen.
FACT-BOX
- Neoadjuvante Therapie beim Rektumkarzinom: Standardempfehlung im Stadium II/III (UICC)
- Präoperative Kurzzeitbestrahlung (5 Tage): Verbesserung des Lokalrezidivrisikos
- Präoperative Langzeitbestrahlung mit Chemotherapie (4 Wochen): Tumorschrumpfung/ Downsizing, verbesserte Operabilität bei sphinkternahen Tumoren
1 Schmiegel W et al., DGVS S3-Leitlinie Leitlinie „Kolorektales Karzinom“ (2004, 2008)
2 Glimelius B et al., Rectal Cancer: ESMO Clinical Practice Guidelines, Annals of Oncology 2010; 21:v82–v86
3 MRC-CR-07-Studie: Sebag-Montefiore D et al., ASCO 2006;Abstr. #3511; Quirke P et al., ASCO 2006, Abstr #3512
4 Gerard JP et al., Results of the phase III trial: ACCORD 12/0405-Prodige 2, J Clin Oncol 2010; 28:1638–1644
5 Aschele CP et al., Pathological response analysis of the studio terapia adjuvante retto (STAR)-01 randomized phase III trial, J Clin Oncol 2009; 27:170s (suppl; abstr CRA40008)
6 Fernandez Martos C et al., Grupe cancer de recto 3 study, J Clin Oncol 2010; 28:859–865
7 Chua YJ et al., Neoadjuvant capecitabine and oxaliplatin before chemotherapy and total mesorectal excision in MRI-defined poor risk rectal cancer: a phase 2 trial. Lancet Oncol 2010; 11:241–248
8 Maas M. et al., Long term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol 2010; 11:835–844 9 Sauer R et al., Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351(17):1731–1740
Weiterführende Literatur:
– National Cancer Institute (NCI) Rectal Cancer Treatment
– Fuchs R et al., Therapie gastrointestinaler Tumore 2011, Manual zum Workschop „Praktische Onkologie“