Systemische Therapieoptionen des Jod-negativen Schilddrüsenkarzinoms
Hintergrund
Der überwiegende Prozentsatz an Patienten mit differenzierten Schilddrüsenkarzinomen zeichnet sich durch eine exzellente Prognose aus, wie die Artikel aus anderen Fachgebieten in diesem Themenheft zeigen. Die Rate an Patienten, die nach initialer chirurgischer Sanierung und Radiojodtherapie ein Rezidiv erleiden, liegt bei 10–15 %, wobei unter 10 % davon an der Erkrankung versterben. Die Rolle des Onkologen beschränkt sich daher im Management von Patienten mit Schilddrüsenkarzinomen auf die Applikation palliativer Therapien, wenn der Tumor refraktär auf Radiojod geworden ist. Wenngleich die Anzahl der Patienten eine geringe ist, stellen sie aufgrund der beschränkten therapeutischen Optionen doch eine große medizinische Herausforderung dar.
Anaplastisches Schilddrüsenkarzinom
Das anaplastische Schilddrüsenkarzinom (ATC) stellt eine seltene Sonderform (< 2 % aller Schilddrüsenkarzinome in größeren Serien) dar, zählt aber zu den aggressivsten Tumorformen überhaupt. Das mediane Überleben liegt bei etwa fünf Monaten, das 1-Jahres-Überleben bei < 20 %, und die Todesfälle sind ausschließlich Tumor-assoziiert, wobei in 40 % der Tod durch Ersticken eintritt. Als Besonderheit wird das ATC immer als Stadium IV gewertet; trotz massiver Nebenwirkungen (v. a. durch die Toxizität der Strahlentherapie mit Notwendigkeit parenteraler Ernährung bei fast 90 % der Patienten) gilt ein kombiniertes Vorgehen mit Radio-Chemotherapie und Chirurgie als Therapie der Wahl, falls dies möglich ist. Mit der Kombination Radiatio + Docetaxel wurde in einer kleinen Serie ein geringer Prozentsatz an Langzeitrespondern beschrieben; es gibt allerdings keinen klaren Therapiestandard in dieser Situation, was die Wahl der Chemotherapie betrifft.
Chemotherapie des Schilddrüsenkarzinoms (non-ATC)
Die konventionelle Chemotherapie wird generell beim Schilddrüsenkarzinom (sowohl anaplastisch als auch differenziert) als nicht wirksam angesehen, und die Daten in der Literatur sind daher – neben der geringen Anzahl an Studien – bereits älteren Datums und oft retrospektiver Natur. Ein großes Caveat in der Interpretation dieser Daten sind allerdings sowohl das Design und die Evaluierung des Ansprechens als auch die Tatsache, dass das Toxizitätsmanagement heutigen Qualitätskriterien nicht standhält. So wurde die Effektivität klassischer Chemotherapien ausschließlich an der objektiven Remissionsrate (= Rate kompletter und partieller Remission) nach radiologischen Kriterien gemessen, die im Schnitt für die am breitesten eingesetzte Monosubstanz Doxorubicin bei etwa 15 % lag (Range = 0–37 %). Allerdings zeigte sich in einer retrospektiven Analyse, dass Responder auf Chemotherapie unabhängig von der Substanzklasse ein deutlich verlängertes Überleben (median 11 Jahre) im Vergleich zu non-Respondern (4 Jahre) aufwiesen. Mit modernen Kombinationstherapien (Gemcitabin + Oxaliplatin, GemOx) berichteten Spano et al. 2011 in einer kleinen Serie über durchaus beachtliche Ansprechraten von 57 % bei geringer Toxizität, wobei es sich hier um ein extrem fragiles Patientenkollektiv mit einem Performance-Status > 2 bei mehr als 50 % handelte. Theoretisch ansprechend, aber leider nicht mehr als „hypothesis generating“ war auch der Ansatz von Spano et al. 2002, in dem versucht wurde, durch TSH-Stimulation der Turmozellen (entweder durch rekombinantes TSH oder endogene Stimulation durch Absetzen der Substitution) eine gewisse Synchronisierung und dadurch bessere Wirkung der Chemotherapie mit Epirubicin und Carboplatin zu erreichen. Die Ansprechrate lag bei 37 %, mit weiteren 50 % Krankheitsstabilisierung nach initialer Progression. Bemerkenswert in dieser Serie war aber auch das progressionsfreie Überleben (PFS) von 17 Monaten, das durchaus (wenngleich nur im indirekten Vergleich) mit den Ergebnissen moderner Studien mit Tyrosinkinase-Inhibitoren (TKIs) mithalten kann.
Das Resümee der spärlichen Daten zum Thema Chemotherapie zeigt klar, dass die Resultate
keine Einschätzung der Wirksamkeit und Toxizität nach modernen Kriterien erlauben und das Urteil über etwaige Unwirksamkeit sehr vorsichtig gefällt werden sollte.
TKIs in der Therapie des Jod-refraktären Schilddrüsenkarzinoms
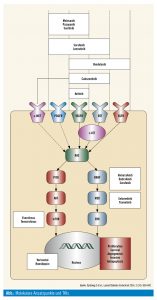
Molekulare Untersuchungen haben eine große Anzahl an intrazellulären Targets aufgezeigt (Abb.), gegen die bereits verfügbare Medikamente existieren (Tab.), wobei der VEGF-Pathway eine prominente Rolle spielt. Hervorzuheben ist in dieser Reihe der MEK-Inhibitor Selumetinib, der zwar keine ausgeprägte Antitumor-Aktivität zeigte, aber in einer Pilotserie zur Redifferenzierung und erneuten Radiojod-Aufnahme mit Möglichkeit erfolgreicher Therapie bei ursprünglich bereits refraktär gewordenen Patienten führte.
Nach einer Reihe kleinerer Phase-II-Studien mit unterschiedlichen Einschluss- und Remissionskriterien wurden letztendlich zwei randomisierte, Placebo-kontrollierte Studien durchgeführt, die zur Zulassung der Multikinase-Inhibitoren Sorafenib und Lenvatinib führten: Im Rahmen der DECISION-Studie (Sorafenib) und der SELECT-Studie (Lenvatinib), welche aufgrund der Seltenheit des Krankheitsbildes multizentrisch und v. a. multinational durchgeführt wurden, konnten zwei in diesem Setting hoch effektive Tyrosinkinase-Inhibitoren (TKIs) für das Jod-refraktäre differenzierte Schilddrüsenkarzinom etabliert werden. Seitens der Einschlusskriterien waren in beiden Studien Patienten mit papillärem, follikulärem oder Hürthle-Zellkarzinom inkludiert; signifikante Unterschiede gab es allerdings betreffend erlaubter Vortherapien: Während im Rahmen der DECISION-Studie nur Patienten ohne systemische Vortherapie behandelt wurden, war in der SELECT-Studie auch eine TKI-Vortherapie zulässig, was bei 25 % der Patienten zu einer Vorbehandlung mit VEGF-gerichteter TKI-Gabe geführt hatte. Auch in der Randomisierung fand sich ein unterschiedliches Design (1:1 Sorafenib – Placebo bei DECISION, 2:1 Lenvatinib – Placebo bei SELECT). Der Einschluss in beide Studien war außerdem nur möglich, wenn die Patienten innerhalb eines Jahres vor Start eine eindeutige radiologische Progression gezeigt hatten, sodass auch in der klinischen Praxis die Entscheidung zur Therapie mit TKIs nicht allein auf Tumormarker-Befunde, sondern auf radiologische und symptomatische Parameter gestützt werden sollte.Der Anteil an pulmonaler Metastasierung war in beiden Studien mit über 85 % vergleichbar hoch, nur der Anteil der ossären Metastasierung war im Kollektiv der SELECT-Studie mit rund 40 % höher. In der DECISION-Studie, deren Intent-to-treat-Kollektiv 417 Patenten umfasste, konnte durch die Gabe von Sorafenib (Startdosis 2 x 400 mg tgl.) das mediane PFS (welches in beiden Studien den primären Endpunkt darstellte) von 5,8 Monate im Placebo-Arm auf 10,8 Monate de facto verdoppelt werden, objektive Remissionen fanden sich bei 12 % der Patienten. Bemerkenswert ist allerdings auch die Tatsache, dass aufgrund von Nebenwirkungen 66 % der Patieten entweder pausieren mussten, eine Dosisreduktion notwendig war oder die Therapie abgebrochen wurde.In der SELECT-Studie wurden insgesamt 392 Patienten behandelt (261 mit Lenvatinib auf einer Startdosis von 24 mg tgl., 131 im Placebo-Arm); unter Lenvatinib zeigte sich ein deutlicher PFS-Benefit von 14,7 Monaten (HR = 0,21; 95 % KI = 0,14–0,31; 18,3 vs. 3,6 Monate), der sich über alle Subgruppen hinweg als signifikant erwies. Das extrem kurze PFS im Placebo-Arm von 3,6 Monaten zeigt letztendlich auch, dass im Rahmen der SELECT-Studie Patienten mit aggressivem Verlauf eingeschlossen waren, die einen eindeutigen Therapiebedarf hatten. Im Gegensatz zur DECISION-Studie fand sich auch ein relevanter Prozentsatz von Patienten mit objektiver Remission (65 %, 2 % CR, 63 % PR), was Lenvatinib zu einem attraktiven Kandidaten in der Therapie von Patienten macht, die aufgrund ihrer Symptome von einer Tumorregression profitieren. Zusätzlich zeigte sich auch in der TKI-vorbehandelten Kohorte ein vielversprechendes PFS von 15,3 Monaten unter Lenvatinib. Auch hier war allerdings die Toxizität beträchtlich: Bei 254 von 261 Patienten traten unter Lenvatinib therapieassoziierte Nebenwirkungen auf, bei 198 Patienten sogar Grad 3 oder höher. Hypertension (67 %, 41 % Grad 3), Diarrhoe (59 %, 8 % Grad 3) sowie Fatigue (59 %, 9 % Grad 3) waren die häufigsten Toxizitäten und führten auch hier zu einer nicht unbeträchtlichen Anzahl von Unterbrechungen, Dosisreduktionen und Therapie-Abbrüchen. Ein Einfluss auf das Gesamtüberleben (OS) konnte allerdings (wohl aufgrund des Crossover-Designs) in keiner der beiden Studien dokumentiert werden. Zusammenfassend lässt sich über beide Studien sagen, dass unter TKI-Therapie bei moderater Verträglichkeit – in beiden Studien kam es vs. Placebo zu einer deutlichen Zunahme an serious adverse events (SAEs) – ein signifikanter und klinisch relevanter PFS-Zuwachs, aber kein Einfluss auf das OS dokumentiert werden konnte. Daher sollte der Einsatz der zugelassenen TKIs in der klinischen Praxis bevorzugt an erfahrenen Zentren und ausschließlich bei Patienten mit dokumentierter radiologischer Progression oder Symptomatik erfolgen, wobei mit Lenvatinib die Chance auf eine objektive Tumorverkleinerung deutlich größer scheint. Die zu erwartende hohe Rate an Toxizitäten mit konsekutiver Dosisreduktion bei Patienten mit Schilddrüsen-karzinom stellt eine zusätzliche Herausforderung dar und erfordert eine engmaschige Interaktion mit dem Patienten im Rahmen regelmäßiger, klinischer Kontrollen, v. a. in den ersten Monaten der Therapie.
Resümee
Abschließend lässt sich somit sagen, dass im vergangenen Jahrzehnt einige neue und vielversprechende Therapiekonzepte im klinischen Alltag etabliert werden konnten und insbesondere die Anzahl und Qualität der Studien am Sektor der neuroendokrinen Tumoren (NET) und differenzierten Schilddrüsentumoren deutlich zugenommen hat. Während bei den neuroendokrinen Tumoren der aktuelle Schwerpunkt nun auf der optimalen Sequenzierung der multimodalen Therapiekonzepte liegt, wird bei den Schilddrüsentumoren v. a. die personalisierte Medizin mittels Next-Generation-Sequencing rasch an Stellenwert gewinnen.