Die zukünftige Diagnostik des Prostatakarzinoms
| Kontext: In den derzeitigen Empfehlungen der Urologischen Gesellschaften zur Diagnostik des Prostatakarzinoms (PCa) spielen bildgebende Verfahren immer noch eine untergeordnete Rolle. Neben PSA und Fingeruntersuchung der Prostata haben lediglich der transrektale Ultraschall (TRUS) bzw. die TRUS-unterstützte Gewebeentnahme eine klar definierte diagnostische Bedeutung. Trotz der eingeschränkten Sensitivität und Spezifität der genannten diagnostischen Standardverfahren wird der Stellenwert der Bildgebung immer noch unterschätzt. Durch zahlreiche falsch positive Testergebnisse resultieren unnötige Gewebeentnahmen in einer beträchtlichen Anzahl, die ihrerseits eine Übertherapie zur Folge haben können. Deshalb kommt der PCa-Bildgebung eine steigende Bedeutung zu. Die Magnetresonanztomographie (MRT) hat sich vor allem zur Beurteilung des Stagings und Gradings des PCa als wertvoll erwiesen. Die Positronenemissionstomographie (PET) zeigt eine besondere Stärke in der Rezidivdiagnostik und bei der Suche von Lymphknoten- und Knochenmetastasen. In diesem Beitrag wird im Speziellen der derzeitige Stand der Technik sowie auch das Zukunftspotenzial der MRT und PET vorgestellt. |
Multiparametrische MRT1-8
Bei der MRT oder Kernspintomographie entstehen Bilder mittels ausgerichteter und anschließend mit Radiofrequenzwellen angeregter Wasserstoffkerne. Dazu wird der Patient in eine Röhre mit einem starken Magnetfeld gelegt. Die MRT kommt ohne Röntgenstrahlen (ionisierende Strahlung) aus und zeichnet sich durch einen guten Weichteilgewebskontrast aus. Durch entsprechende Geräteeinstellungen und Kontrastmittelverabreichung können unterschiedliche anatomische/strukturelle und funktionelle Informationen über das Prostatagewebe, z.B. über Textur, Durchblutung, Stoffwechsel oder Molekülbewegung gewonnen werden. Die multiparametrische MRT untersucht die:
-
die Morphologie mittels T2-gewichteter Bilder
-
die Gewebedurchblutung mittels T1-gewichteter Bilder und Kontrastmitteldynamik
-
den Stoffwechsel mittels Spektroskopie
-
die Zelldichte mittels diffusionsgewichteter Bilder
T2-gewichtete Bilder: Die T2-gewichteten Bilder erlauben die Darstellung der zonalen Anatomie der Prostata in einem hohen Weichteilkontrast. Das PCa stellt sich größen- und lageabhängig als Areal erniedrigter Signalintensität dar (Abb. 1).
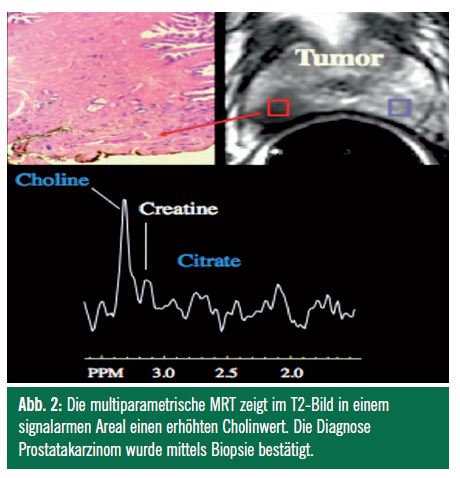
Wasserstoffprotonen-Spektroskopie (MRS)9,10: Die MRS ist eine nichtinvasive Messmethode der Gewebemetaboliten. Die semiquantitative Analyse der Metaboliten Citrat (ein Parameter des aeroben Stoffwechsels) und Cholin (ein Parameter der Zellmembranproliferation) erfolgt bei den modernen Geräten voxelweise. In Tumoren ist die Konzentration von Cholin erhöht (Abb. 2) und jene von Citrat erniedrigt. Die zu berechnende Cholin-Citrat-Ratio kann einen Hinweis auf den Malignitätsgrad (Gleason-Score) eines PCa geben.
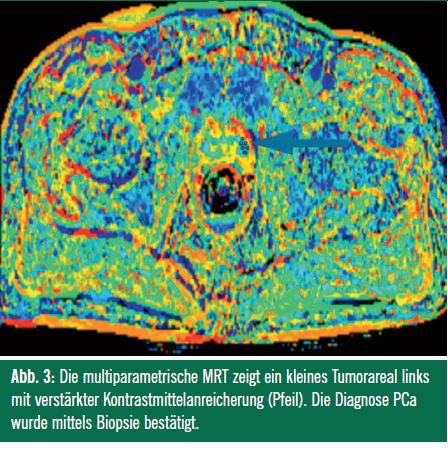
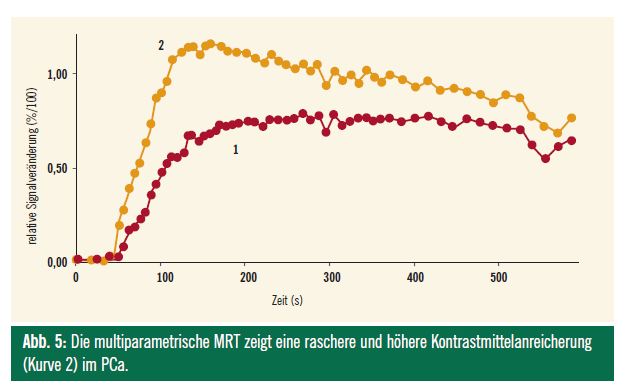
Die Perfusion11,12: Tumoren weisen mit zunehmender Malignität eine Erhöhung der Vaskularisation und der Gefäßpermeabilität auf. Die Gewebeperfusion entspricht der Blutmenge, die sich pro Zeiteinheit durch ein definiertes Gewebevolumen bewegt. Diese Gewebeperfusion kann mittels verschiedenster Parameter erfasst und berechnet werden. Im Karzinomgewebe zeigt sich durch die tumorinduzierte Neoaangiogenese eine höhere Kontrastmittelanreicherung als im normalen Drüsengewebe (Abb. 3). Insbesondere Prostatakarzinome zeigen häufig einen steileren Anstieg der Signalintensität und eine höhere Signalintensität als gesundes Prostatagewebe (Abb. 5).
Die Diffusion (Diffusion-weighted Imaging, DWI)13,14: Die DWI beruht auf der bildlichen Darstellung der Brown’schen Bewegung der Wassermoleküle. Im Falle einer intrazellulären oder intraduktalen Beweglichkeitseinschränkung innerhalb der Drüsenzellen oder in den Drüsengängen bzw. -kanälchen, so gesehen z.B. im Karzinomgewebe bedingt durch eine erhöhte Zelldichte, kommt es in der qualitativen Darstellung dieser Diffusion zu Signalveränderungen. Die Diffusionsveränderungen können auch mittels eines Diffusionskoeffizienten semiquantitativ erfasst und mittels so genannter ADC-Funktionskarten dargestellt werden (Abb. 4).
Multiparametrische Analyse: Die Ergebnisse der oben beschriebenen Parameter sollte in einem Scoringsystem erfasst bzw. ausgewertet werden. Für jeden Parameter können dabei, eingeteilt nach Dignitätskriterien, maximal 5 Punkte vergeben werden. Ein hoher Score weist dabei auf einen hohen Aggressivitätsgrad des Tumors – z.B. bei Gleason-Score 8-10 – hin (Abb. 6).
Die MRT-gesteuerte Biopsie15-17: Bei der MRT-gesteuerten Biopsie werden in der MRT-Suite aus suspekten Arealen mittels kompatibler Instrumente Gewebeproben entnommen. In einigen Studien konnte mittels dieser aufwendigen Biopsietechnik die PCa-Detektionsrate auf bis zu 60% erhöht werden. Limitierend sind die lange Dauer der Prozedur und die damit verbundenen hohen Kosten anzuführen.
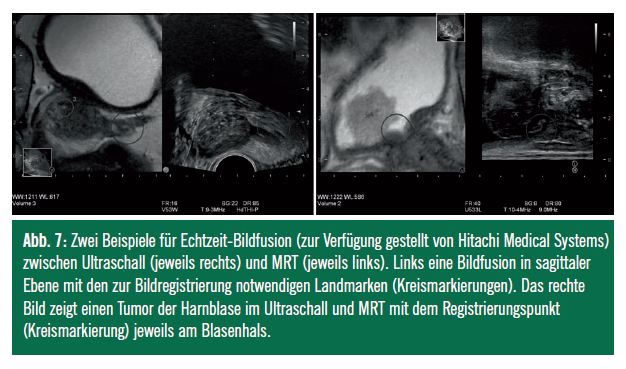
Echtzeit-Bildfusion MRT/Ultraschall18,19: Andererseits können 3-D-MRT-Datensätze gewonnen und elektronisch an dedizierte Ultraschallgeräte verschickt werden. Diese speziellen Ultraschalleinheiten sind mit einem elektromagnetischen Tracking- oder Navigationssystem ausgestattet. Dadurch ist einerseits die Fusion der MRT- und Ultraschalldatensätze unter Echtzeitbedingungen möglich (Abb. 7), andererseits ist mittels “getrackter” (also im elektromagentischen Feld markierter) Instrumente eine Lokalisation z.B. der Spitze der Biopsienadel in der Prostata möglich. Derzeit sind diese Systeme noch nicht ausgereift, sie werden aber in Zukunft die diagnostischen und therapeutischen Abläufe sicherlich beeinflussen.
Zukunftsaspekte20,21: Die 3-T-MRT bietet eine bessere Bildauflösung und könnte so zu einer Verbesserung der Diagnostik des Prostatakarzinoms beitragen. Vor allem aber könnte diese Technik die Anwendung der Endorektalspule unnötig machen. Die Endorektalspule ist ein Instrument, das zur Verbesserung der Bildqualität in den After eingeführt wird, gleichzeitig aber auch eine für den Patienten unangenehme und zuweilen sogar schmerzhafte Untersuchungssituation erzeugt.
Cholin-PET-CT22,23
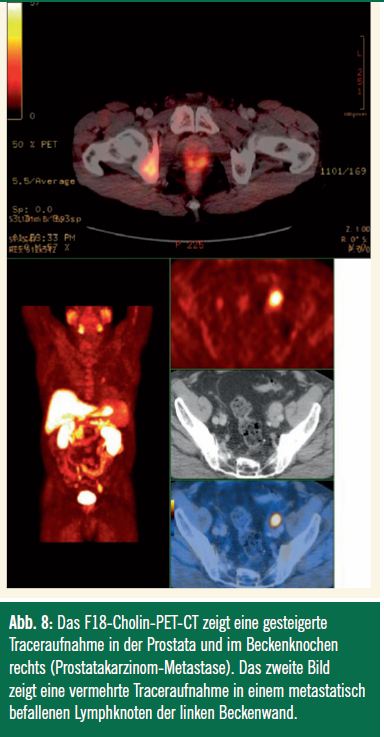
Die PET-CT-Untersuchung ist eine Kombination aus PET und CT. Es werden radioaktiv markierte Moleküle als Tracer verwendet, die sich besonders in den stoffwechselaktiven Tumorzellen anreichern (Abb. 8). Das PCa zeigt in vielen Fällen einen eher geringen Zuckermetabolismus, weswegen das 18Fluor-Deoxyglukose (18F-FDG)-PET eine eher limitierte Sensitivität in der Krebsdetektion zeigt.
Die Zellen des PCa bauen aber vermehrt Cholin ein, das sich, wenn es radioaktiv markiert ist, mittels PET nachweisen und bildlich darstellen lässt. Verwendet werden Cholin-Derivate die mit 11C (HWZ 20 Minuten) und 18F (HWZ 109 Minuten) radioaktiv markiert werden. Das Potenzial dieser Methode liegt, wie die Literatur zeigt, vor allem in der Detektion befallener Lymphknoten sowie auch in der Rezidivdiagnostik. Durch eine starke Exkretion des markierten Cholins im Harn kann es durch eine Akkumulation in der Harnblase bzw. im kleinen Becken zu störenden Überlagerung kommen. Dennoch sind die Studienergebnisse der Cholin PET-CT für die Detektion von Rezidivtumoren nach radikaler Prostatektomie (RPE) vielversprechend. Eine Erhöhung des PSA auf 1 ng/ml nach RPE scheint dabei ein sinnvoller Schwellwert für die Indikationsstellung zur Durchführung einer Cholin PET-CT.
Die Wertigkeit dieser Methode für die Primärdiagnostik, für die Risikobeurteilung zur stadienadaptierten Therapie und für das Staging, wird derzeit wegen der hohen Kosten noch etwas widersprüchlich diskutiert.
Für die Beurteilung von Knochenmetastasen spielt die Cholin-PET eine wichtige Rolle, wenngleich derzeit unklar ist, ob sie die viel weiter verbreitete und billigere 99mTc-Diphosphonat-Knochenszintigraphie vollständig ersetzen kann, zumal scheinbar in osteosklerotischen Läsionen der Radiotracer- Uptake im Vergleich zur Szintigraphie reduziert scheint und sich die Anspeicherung des markierten Cholins vor allem im Markraum zeigt.
Außerdem zeigt auch das bereits erhältliche aber nicht so weit verbreitete 18F-Fluorid PET-CT erste interessante Ergebnisse in der Detektion von Knochenmetastasen. Die vermehrte Anreicherung des Fluorids bei gesteigerter Osteoblastenaktivität findet sich aber auch in gutartigen Knochenveränderungen wie z.B. den unkomplizierten und sehr häufigen Knochenzysten, was eine hohe Rate an falsch positiven Ergebnissen verursachen könnte.
Die SPECT-CT findet ebenfalls zunehmend Anwendung, einerseits in der Diagnostik des lokalen Rezidivs mittels markierter Antikörper gegen das relativ krebsspezifische Prostatamembran-Antigen (PSMA) und andererseits als Hybrid-Verfahren zur genaueren Lokalisation der Anreicherungsareale der Knochenszintigraphie.
Für die Weiterentwicklung der Diagnostik wurden mehrere Radiotracer entwickelt, was auch auf den großen Stellenwert der PCa-Diagnostik in der Nuklearmedizin hinweist. Die Liste der aufgelisteten Radiotracer ist inkomplett und soll nur einen groben Überblick auf die regen Forschungsaktivitäten im Bereich der so genannten molekularen Bildgebung vermitteln.
-
Darstellung der Androgenrezeptordichte mittels markierter Agonisten und Antagonisten (z.B. 18Fluor-5alpha-Dihydrotestosteron). Mit diesem Radiotracer kann auch ein Therapiemonitoring der antiandrogenen Therapie ermöglicht werden.
-
Darstellung des Gastrin-releasing Peptid-Rezeptors (GRPR), der eine hohe Spezifität für das PCa aufweist und mittels markiertem Bombesin (ein Neuropeptid) agonistisch und antagonistisch erfasst werden kann.
-
Radioaktiv markierte Aminosäurenderivate (z.B. 1-amino-3-18F-fluoro – cyclobutyl-1-carboxylic acid), die scheinbar eine Differenzierung zwischen gutartigen und bösartigen Prostataveränderungen erlauben.
-
Markierte Antikörper gegen die extrazelluläre Domäne des PSMA.
-
Darstellung des transmembranösen Glykoproteins Alpha-v-beta-3-Integrin, das bei der Tumorangiogenese eine wichtige Rolle spielt, mittels spezieller PET-Tracer.
PET-MRT24-26
Die kombinierte Anwendung von PET und MRT soll die diagnostischen Möglichkeiten der beiden Methoden vereinen und die Detektion des PCa bzw. seiner Metastasen sogar noch verstärken. Derzeit sind solche Ganzkörper-Hybrid-MRT-PET-Scanner noch in Entwicklung bzw. klinischer Überprüfung. Speziell die Diagnostik des lokalen Rezidivs und von Lymphknotenmetastasen könnte sich mit solchen Systemen entscheidend verbessern.
Die Registrierung der vor ein paar Jahren vorgestellten lymphotropen ultrakleinen superparamagnetischen Eisenoxidpartikel (USPIO) zur MRT-Lymphographie und Detektion von Lymphknotenmetastasen, wurde trotz vielversprechender Ergebnisse, wahrscheinlich aus Kostengründen, zurückgezogen.
In der Detektion von Knochenmetastasen erwartet man sich durch die Kombination von MRT (sehr gute Detektion von Knochenmarksraumveränderungen mittels T1-gewichteter Bilder und ein großes Potenzial in der Erfassung von Knochenzelldichtezunahmen in der diffusionsgewichteten Bildgebung) und der Cholin-PET (erhöhter Cholin-Metabolismus in Knochenmetastasen), eine deutliche Steigerung der diagnostischen Akkuranz.
|
Take Home MessageDie neuen bildgebenden Verfahren der multiparametrischen MRT und der Cholin-PET haben sich als zukunftsträchtig in der PCa-Diagnostik gezeigt.
Insbesondere können die Detektion bzw. das Grading und Staging des PCa optimiert werden. Diese bildgebenden Verfahren werden zukünftig auch eine Rolle bei der Planung und Durchführung neuer therapeutischer Methoden wie z.B. der fokalen Therapie spielen. |
1 Franiel T, Rofo 2011; 183(7):607-17
2 Kirkham AP et al., Eur Urol 2006; 50(6):1163-74; discussion 1175
3 Sala E et al., Radiology 2006; 238(1):176-83
4 Roethke MC et al., Eur J Radiol 2011; 79(2):189-95
5 Seitz M et al., Eur Urol 2009; 55(4):801-14
6 Dickinson L et al., Eur Urol 2011; 59(4):477-94
7 Pucar D et al., Radiology 2005; 236(2):545-53
8 Yoshizako T et al., Acta Radiol 2008; 49(10):1207-13
9 Scheidler J et al., Rofo 2009; 181(6):531-5
10 Zakian KL et al., Radiology 2005; 234(3):804-14
1 Engelbrecht MR et al., Radiology 2003; 229(1):248-54
12 Somford DM et al., Magn Reson Imaging Clin N Am 2008; 16(4):685-95
13 Mueller-Lisse UG et al., Radiologe 2011; 51(3):205-14
14 Yoshizako T et al., Acta Radiol 2008; 49(10):1207-13
15 Yakar D et al., Top Magn Reson Imaging 2008; 19(6):291-5
16 Anastasiadis AG et al., Eur Urol 2006; 50(4):738-48; discussion 748-9
17 Hambrock T et al., J Urol 2010; 183(2):520-7
18 Ukimura O et al., Int J Urol 2010; 17(10):890-3
19 Pinto PA etal., J Urol 2011 Aug 15; [Epub ahead of print]
20 Turkbey B et al., Radiology 2010; 255(1):89-99
21 Fütterer JJ et al., Top Magn Reson Imaging 2008; 19(6):285-9
22 Zengerling F et al., Aktuelle Urol 2011 Jul 18; [Epub ahead of print]
23 Ambros J Beer et al., Lancet Oncol 2011; 12:181-91
24 Pandharipande PV et al., Am J Roentgenol 2009; 193(3):W230-7
25 Sciarra A et al., Eur Urol 2011; 59(6):962-77
26 Bouchelouche K et al., Semin Nucl Med 2011; 41(1):29-44