Alternative zur mikrografisch kontrollierten Chirurgie: Mohs-Chirurgie beim Basalzellkarzinom
In den letzten Monaten wurde an der Universitätsklinik für Dermatologie und Venerologie der Medizinischen Universität Graz die Durchführung der sogenannten Mohs-Chirurgie (eine spezielle Methode der schnittrandkontrollierten Schnellschnittchirurgie) vor allem bei solid fibrosierenden Basalzellkarzinomen etabliert. Bisher wurde diese Methode bei über 50 Patienten in Graz angewandt.
Ziel ist es, eine gewebsschonende R0-Resektion bei diesen klinisch schwer abgrenzbaren Tumoren zu erreichen. Kommen noch weitere Faktoren, wie eine ungünstige Lokalisation mit zu erwartender diffiziler Defektdeckungssituation oder eine ungünstige Größenrelation des Tumors in Bezug auf die Lokalisation hinzu, wird die R0-Resektion immer entscheidender für das postoperative Outcome. Bislang konnte unseren Patienten die „mikrografisch kontrollierte Chirurgie“ nach Breuninger („3D-Histologie“) mit Hämotoxylin-Eosin- (HE-)Färbung, mit ausgezeichneten Ergebnissen (geringsten Rezidivraten, ansprechendem kosmetischen Ergebnis), jedoch längerer Aufenthaltsdauer im Krankenhaus angeboten werden. Die Defektdeckung kann bei dieser Methode im Gegensatz zur Mohs- Chirurgie nicht am selben Tag erfolgen.
Besonderheiten des Mohs-Verfahrens
Namensgebend für die Mohs-Chirurgie war Frederic Mohs, der 1941 in den USA die Chemochirurgie einführte und mittels Zinkchlorid-Paste Tumorgewebe am Patienten intravital fixierte. Mittlerweile wird eine Kryostattechnik angewandt. Gefrierschnitte von der Tumorbasis und vom Randbereich des Tumors werden angefertigt – und zwar lückenlos. Das Zentrum des Tumors kommt als Hauptpräparat in einen gesonderten Behälter mit 10%iger Formalinlösung und wird anschließend mittels HE-Färbung in gewohnter Art und Weise histologisch aufgearbeitet.
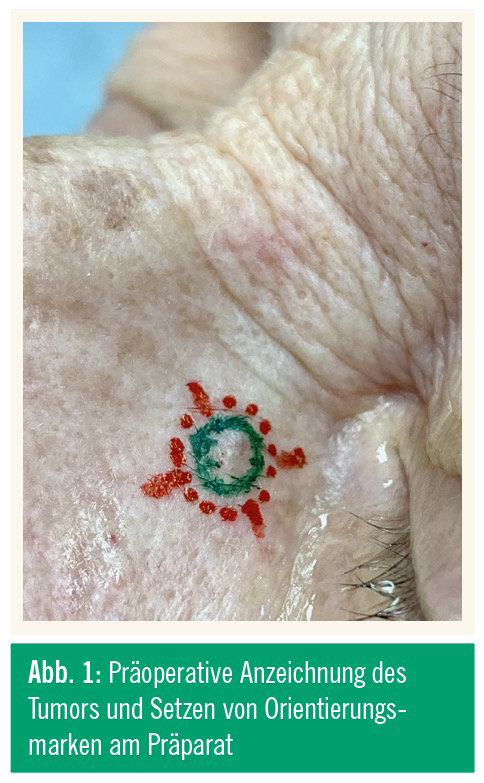
Besonders wichtig ist die präoperative Anzeichnung des Tumors und das Setzen von Orientierungsmarken am Präparat und eventuell auch in situ (Abb. 1). Die Anzeichnung sollte mit einer Lupenbrille unter guter Ausleuchtung des OP-Feldes stattfinden. Der Tumor selbst – also das Hauptpräparat – wird direkt ohne Seitenabstand angezeichnet. Von dort ausgehend wählt man nun den jeweiligen Mindestseitenabstand. Je nach Tumordurchmesser sollte man auch bereits die Markierungen von zumindest zwölf Uhr und sechs Uhr markieren, um die nachfolgende Reorientierung bei der Einlage in die Histologiekassetten zu erleichtern (Abb. 2). Je nach Gewebebeschaffenheit und Lokalisation kann es technisch von Vorteil sein, das gesamte angezeichnete Feld mitsamt Seitenabstand und Basis en bloc zu entnehmen und erst ex corporis das Basispräparat abzupräparieren sowie die Randprä parate zu erstellen, oder eben schon bei der Exzision die Anteile getrennt zu entnehmen. Wichtig ist hierbei jedoch, dass saubere und möglichst wenig traumatisierte Gewebestücke für den Histopathologen gesichert werden können, da diese sonst stark eingeschränkt beurteilbar sind und damit nicht repräsentativ für den korrelierenden Abschnitt.
Nach der Entnahme der Gewebeschnitte für die Schnellschnitthistologie werden diese in spezielle Histologiekassetten eingelegt und Markierungspunkte mit blauer Tusche gesetzt bzw. beim Basispräparat die Oberfläche Blau markiert. Das Protokoll und die Histologieanforderung werden kontrolliert, und die Präparate gehen so schnell als möglich unfixiert in die Hände der medizinisch-technischen Assistentin zur Verbringung in den Kryostaten. Nach allen weiteren durchlaufenen Arbeitsschritten im histopathologischen Labor werden die Präparate dem Histopathologen zur Befundung vorgelegt. Dieser übermittelt persönlich telefonisch jeweils an den Operateur den Befund. Inzwischen konnte eine Zeitspanne von Präparatabholung bis Befundübermittlung durch den Histopathologen von knapp 20 Minuten erreicht werden.
Im besten Falle wird ein „In-sano-Befund“ übermittelt und die Defektdeckung kann nun erfolgen. Bei einem „Non-in-sano- Befund“ hingegen erfolgt eine selektive Nachexzision.
In einem prospektiven Vergleich mit der mikrografisch kontrollierten Chirurgie (Tübinger Methode nach Breuninger) hoffen wir, ähnlich niedrige Rezidivraten zu erreichen.