Chronische Herzinsuffizienz – Pharmakologische Behandlung: Update 2012
Am diesjährigen europäischen Herzkongress in München, wurden in der Sitzung „Pharmakologische Therapie der chronischen Herzinsuffizienz – ein Update 2012“ aktuelle Aspekte der wichtigsten medikamentösen Therapiestrategien bei chronischer Herzinsuffizienz (cHI) dargestellt.
Diuretika – sind höhere Dosen vorteilhaft?
Zum Thema, wie die Diuretika-Therapie optimiert werden könnte, machte C. O’Connor klar, dass die Überwässerung die Hauptursache von Hospitalisierungen bei Patienten mit Herzinsuffizienz darstellt. In der Behandlung der akuten Herzinsuffizienz stellt die diuretische Therapie eine wesentliche Behandlungssäule dar. Viele Patienten sind auch zum Zeitpunkt der Spitalsentlassung wegen kardialer Dekompensation immer noch nicht vollständig rekompensiert und häufig weiterhin überwässert. Eine Optimierung des Flüssigkeitshaushaltes mit vollständiger Rekompensation ist häufig mit einer Optimierung der Nierenfunktion assoziiert.
In einer rezent publizierten Analyse (Felker G. M. et al., N Engl J Med 2011; 364:797-805) wurden zur Behandlung von Patienten mit kardialer Dekompensation zwei unterschiedliche Diuretika-Strategien (niedrige versus hohe Dosis) untersucht. Es zeigte sich ein Trend zu einer rascheren Flüssigkeitsmobilisierung und einer rascheren symptomatischen Verbesserung unter höher dosierter Diuretikatherapie. Allerdings zeigte sich auch ein (nicht signifikanter) Trend zu einem stärkeren Anstieg des Serum-Kreatinins unter der höheren Dosis des Diuretikums.
Anstiege des Serum-Kreatinins unter Diuretika-Therapie sind häufig transient. Wenn es im Rahmen der Hospitalisierung von Patienten mit dekompensierter Herzinsuffizienz unter Optimierung des Flüssigkeitshaushaltes nicht gelingt, den BNP-Spiegel zu reduzieren, so ist mit einem höheren Risiko für eine neuerliche Hospitalisierung zu rechnen.
Der Referent sprach sich klar für eine höher dosierte Diuretika-Therapie und eine max. Ödem-Ausschwemmung aus und meinte, dass eine (meist transiente) renale Funktionsverschlechterung kein Hindernis für eine Normalisierung des Flüssigkeitshaushalts mit kompletter Ödemmobilisierung darstellen sollte.
UNLOAD-Studie: Es wurde letztlich auf die Option der Ultrafiltration (UNLOAD-Studie; Costanzo M. R. et al., J Am Coll Cardiol 2007; 49:675-83) hingewiesen, wobei die Anwendung von Ultrafiltration im Vergleich zur intravenösen Diuretikatherapie eine Reduktion von Herzinsuffizienz-assoziierten Ereignissen nach 3 Monaten zeigte. Die rezenten ESC-Herzinsuffizienz-Guidelines (Update 2012) empfehlen die Anwendung einer diuretischen Therapie mit einer Klasse-IB-Empfehlung.
In der chronischen Therapie der dekompensierten Herzinsuffizienz zeigen höhere Diuretikadosen – zumindest tendenziell – mehr Benefit. Zukünftig können „Infusions-Kliniken“ eine ambulante oder tagesstationäre Option zur Rekompensation von Herzinsuffizienz-Patienten darstellen. Dieses Modell einer ambulanten Therapie in einem „ambulanten/tagesstationären“ Setting zur Rekompensation bzw. zur Vermeidung von Hospitalisation könnte auch andere Therapieformen wie Verabreichung von Inotropika oder Gabe von i.v. Diuretika und Ultrafiltration beeinhalten. Optional käme auch die Anwendung einer ambulanten Ultrafiltrationsbehandlung in Frage.
Kombinationen von RAAS-Inhibitoren – wie viel ist nötig?
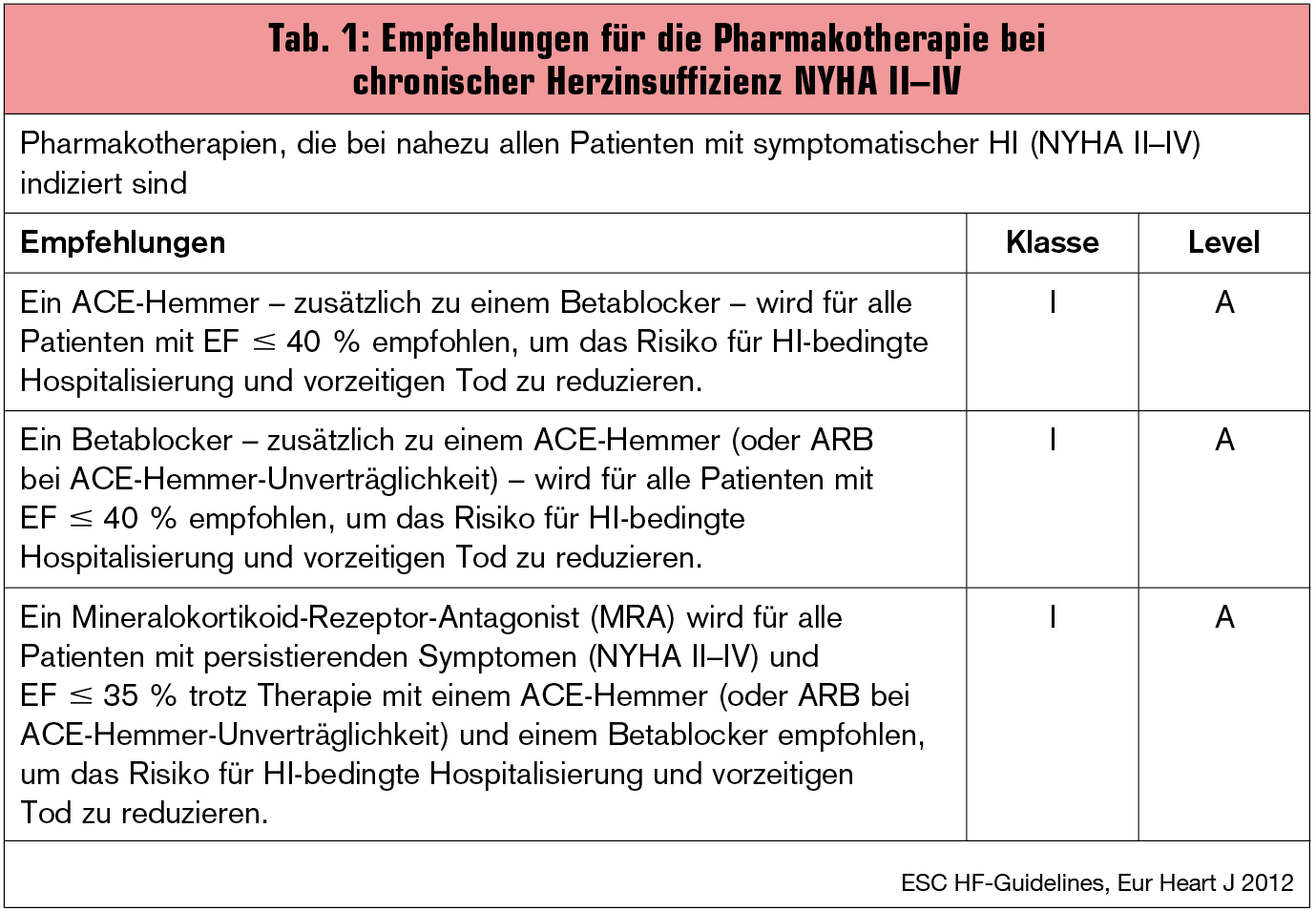
K. Swedberg gab eine Übersicht über Kombinationen von Inhibitoren des Renin-Angiotensin-Aldosteron-Systems (RAAS). Er wies auf die bahnbrechenden Ergebnisse der CONSENSUS-Studie (N Engl J Med 1987; 316:1429-35) hin und betonte, dass ACE-Hemmer den Grundstein einer Mortalitätsreduktion für Patienten mit chronischer Herzinsuffizienz darstellen (Tab. 1). Der kombinierte Einsatz eines RAS-Blockers mit einem Betablocker („Blocker-Cocktail“) sollte a priori im Behandlungsplan jedes individuellen Herzinsuffizienz-Patienten verankert werden und mit dem Patienten bereits zum Behandlungsbeginn noch vor der definitiven Einleitung der Therapie eingehend besprochen werden. Auch die Titrationsschritte und Zieldosen der entsprechenden Medikamente sind a priori festzulegen.
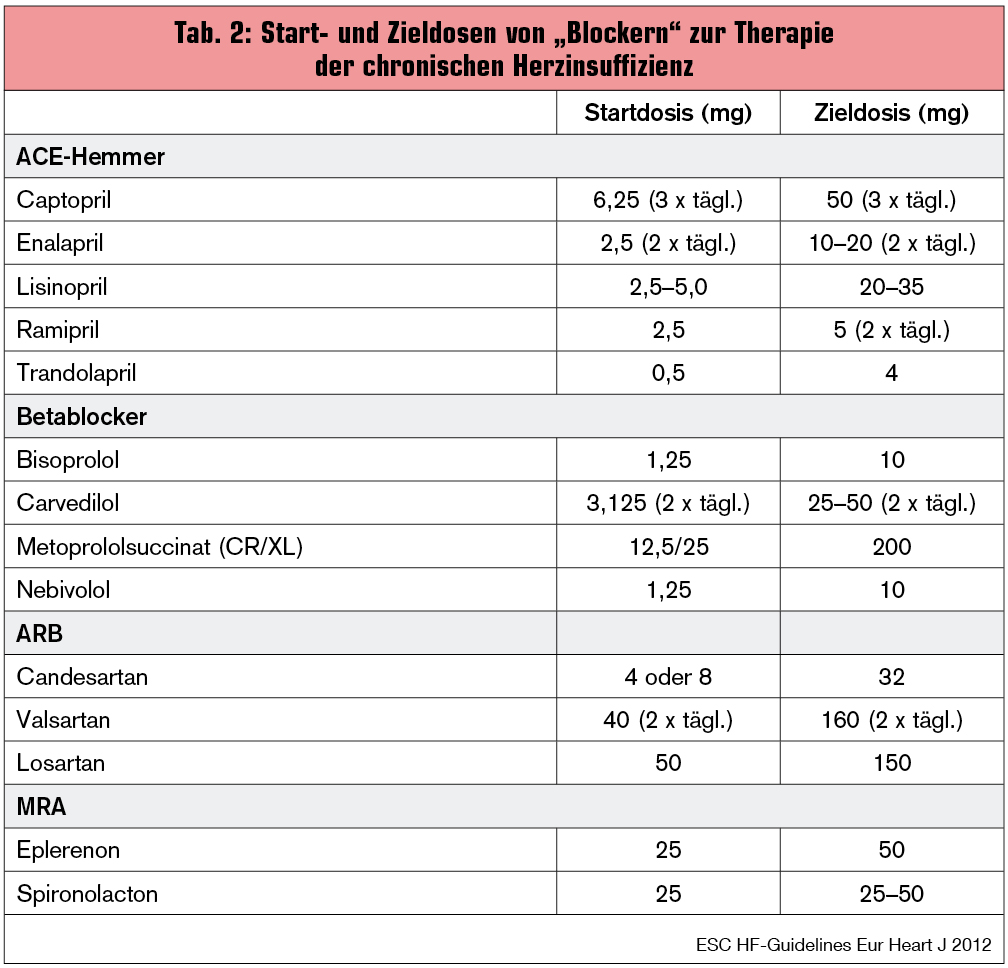
Der Referent zeigte Daten zu Vergleichen zwischen unterschiedlichen Angiotensin-Rezeptor-Blockern in der Therapie der chronischen Herzinsuffizienz. Während ein schwedisches Register (Eklind-Cervenka M. et al., JAMA 2011; 305:175-182) zeigen konnte, dass Patienten, die mit Candesartan behandelt wurden, im Vergleich zu den mit Losartan behandelten Patienten einen Überlebensvorteil aufwiesen, konnten diese Ergebnisse in einem dänischen Register (Swanström H. et al., JAMA 2012; 307:1506-12) nicht bestätigt werden. Ursächlich für die unterschiedlichen Ergebnisse könnten Unterschiede in der gewählten Medikamentendosis sein. Die Kernbotschaft hinsichtlich RAS-Blockade ist zweifelsfrei die Anwendung hoher (studienkonformer) Dosen (Tab. 2).
Aldosteron-Blockade – wer profitiert?
Die erste systematische, groß angelegte Studie zur Aldosteron-Blockade bei chronischer Herzinsuffizienz war die RALÈS-Studie (Pitt B. et al., N Engl J Med 1999; 341:709-17), die einen Überlebensvorteil für Patienten mit fortgeschrittener Herzinsuffizienz unter Spironolakton zeigte. Rezent wurde in der EMPHASIS-HF-Studie (Zannad F. et al., N Engl J Med 2011; 364:11-21) in einem zeitgemäß behandelten Patientenkollektiv mit leichteren Formen von Herzinsuffizienz unter Behandlung mit Eplerenon eine 24%ige Reduktion der Gesamtmortalität dokumentiert. Allerdings kam es, ähnlich wie bei der RALES-Studie, zum Auftreten einer höheren Rate an Hyperkaliämien unter Therapie mit dem Aldosteron-Rezeptor-Blocker (im Vergleich zu Placebo), bei einer allerdings deutlich verminderten Inzidenz von Hypokaliämien.
Unter einer Kombinationstherapie aus RAAS-Blockern, insbesondere einer 3-fach-Kombination aus ACE-Hemmer, ARB und Aldosteron-Antagonist steigt das Risiko einer Hyperkaliämie erheblich an, sodass diese Kombination in den rezenten Herzinsuffizienz-Guidelines als kontraindiziert eingestuft wird (Empfehlungsgrad IIIC; Tab. 3).
Bezüglich der Unterschiede zwischen Spironolakton und Eplerenon, wies Swedberg darauf hin, dass Head-to-Head-Vergleiche beider Substanzen weitgehend fehlen. Allerdings zeigt sich klar eine deutliche Überlegenheit von Eplerenon, hinsichtlich des Auftretens von Nebenwirkungen, insbesondere von Gynäkomastie. Bezugnehmend auf die Praxisempfehlung in den rezenten Guidelines wies Swedberg abschließend darauf hin, dass eine Kombination von „Blockern“ der neurohumoralen Systeme bei allen Patienten mit symptomatischer systolischer Herzinsuffizienz indiziert ist. Vor Therapiebeginn sollte ein Behandlungsplan festgelegt und mit dem Patienten besprochen werden, wobei auch Titrationsschritte und Zieldosen definiert werden müssen. Während der Titrationsphase und während der Phase der Erhaltungstherapie ist ein Monitoring der Nierenfunktion und des Kaliumspiegels erforderlich.
Niedrige Herzfrequenz als „neues“ Therapieziel
L. Tavazzi diskutierte Medikamente zur Herzfrequenzmodulation und deren Optimierung.
Die Ausgangsherzfrequenz ist ein Risikoindikator bei Patienten mit chronischer Herzinsuffizienz (Castagno D., JACC 2012; 59:1785-95). Es konnte gezeigt werden, dass eine Reduktion der Herzfrequenz bei Patienten mit chronischer Herzinsuffizienz mit einer Reduktion der Gesamtmortalität assoziiert ist.
In einer rezenten Analyse war ein Rückgang von 5 Schlägen/min mit einer 18%igen Reduktion der Gesamtmortalität verbunden (Mc Allister, Ann Int Med 2009; 150:784-94). Der Autor dieser Arbeit konnte auch zeigen, dass die Mortalitätsreduktion nicht mit der Dosis des angewandten Betablockers korrelierte.
Insgesamt ist eine Herzfrequenz-Reduktion bei Patienten mit chronischer Herzinsuffizienz ein erwünschtes Therapieziel. Die Surveys der letzten Jahre zeigten eine deutliche Zunahme der Anwendung von Betablockern in der Therapie der chronischen Herzinsuffizienz bei Patienten mit systolischer linksventrikulärer Dysfunktion. In den sequenziell durchgeführten Heart Failure Survey der ESC konnte zwischen den Jahren 2000 und 2011 ein Anstieg der Verwendung von Betablockern von 37 % auf 87% dokumentiert werden.
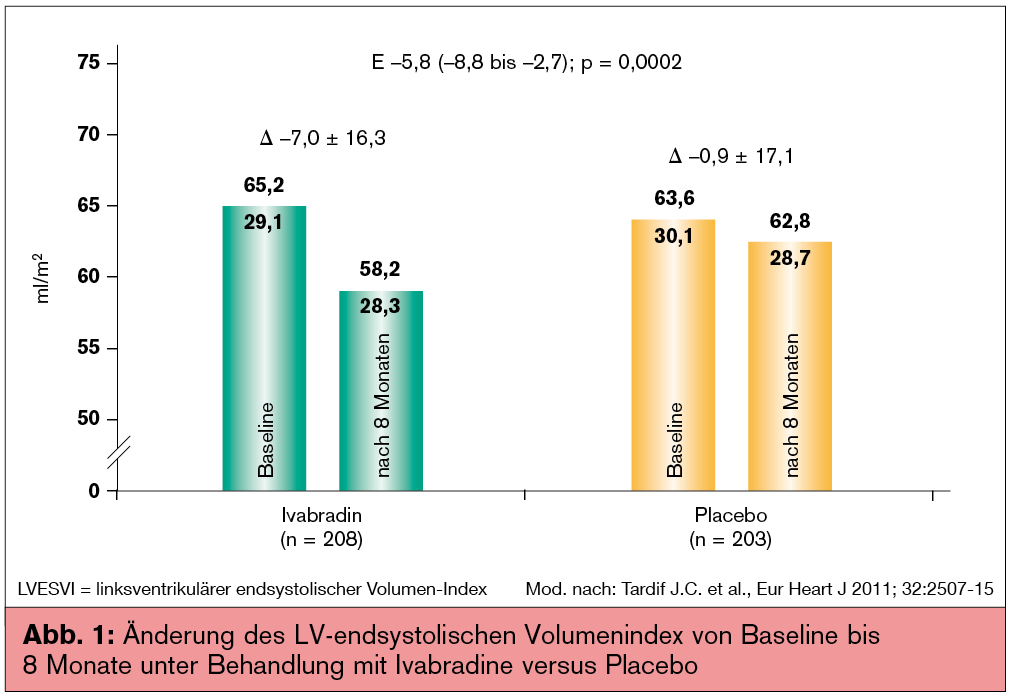
Basierend auf den Daten der SHIFT-Studie (Swedberg K. et al., Lancet 2010; 376:875-885) ist Ivabradin für Herzinsuffizienz-Patienten mit einer Herzfrequenz über 70/min in den Guidelines empfohlen. Laut europäischer Zulassungsbehörde (EMA) ist diese Substanz allerdings erst ab einer Herzfrequenz von 75/min zugelassen. In rezenten Analysen konnte demonstriert werden, dass der klinische Vorteil der Anwendung von Ivabradin bei Patienten mit persistierend erhöhter Herzfrequenz trotz adäquater Betablockade mit günstigen pathophysiologischen Veränderungen, wie einer Abnahme des linksventrikulären endsystolischen Volumen-Index, assoziiert ist (Tardif J. C. et al., Eur Heart J 2011; 32:2507-15; Abb. 1).
Als Zielbereich für die Herzfrequenz bei Patienten mit chronischer Herzinsuffizienz sind unter 60 Schläge pro Minute oder zumindest eine Abnahme von 10 Schlägen pro Minute unter Therapie anzusehen.
Das Problem der Medikamentenadhärenz in der „Polypharmakotherapie“
Im letzten Referat befasste sich U. Laufs mit den Optionen zur Verbesserung der Therapietreue, einem Dilemma der modernen Medizin – nicht nur in der Herzinsuffizienzbehandlung. Der Referent stellte klar, dass Therapietreue klar mit reduzierter Mortalität assoziiert ist (Baroletti S. et al., Circulation 2010; 121:1455-8).
Aus den zeitlichen Mustern der Therapietreue bei Patienten mit arterieller Hypertonie kann abgeleitet werden, dass es zwei Typen von Patienten mit reduzierter Therapieadhärenz gibt. Einerseits jene, die zunächst eine hohe Therapietreue aufweisen und in der subjektiven Meinung, wieder gesundet zu sein, die Therapie nicht fortsetzen, und andererseits jene Patienten, die sich bereits von Anfang an immer wieder „Drug-Holidays“ verordnen.
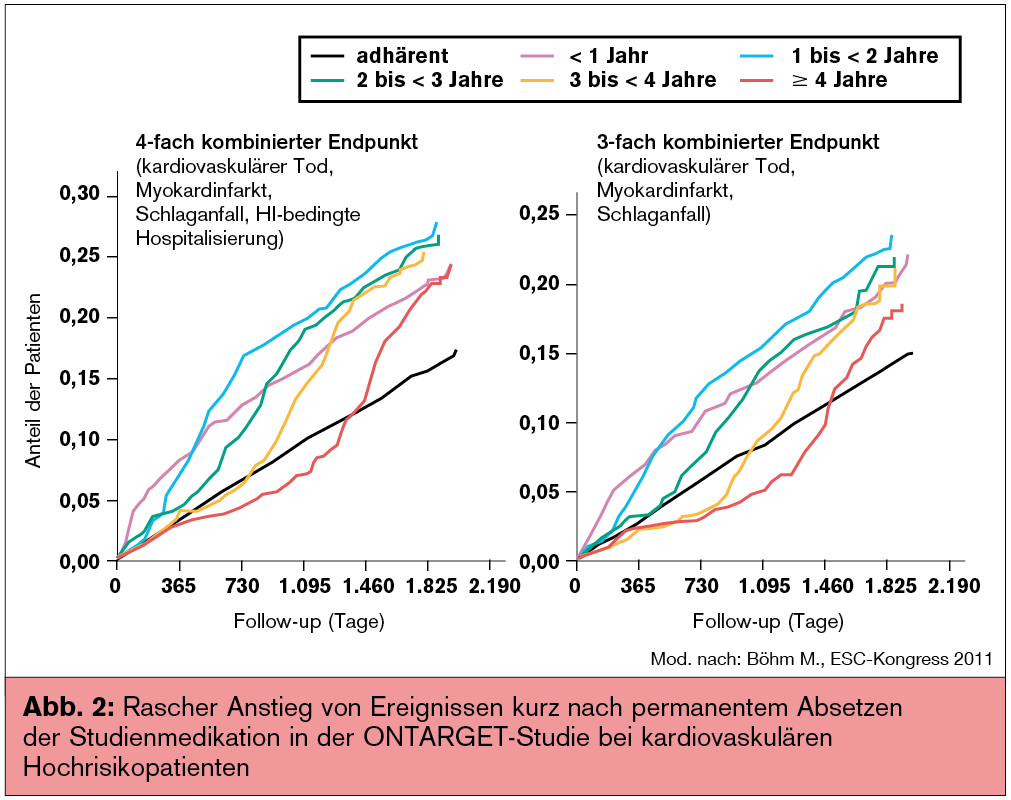
Daten aus der ONTARGET-Studie (N Engl J Med 2008; 358:1547-59), die ACE-Hemmer und Angiotensinrezeptorblocker bei kardiovaskulären Hochrisikopatienten untersuchte, konnten klar demonstrieren, dass eine verminderte Therapieadhärenz, mit einem 3–4-fachen Anstieg von kardiovaskulären Ereignissen, und zwar relativ zeitnahe nach dem Absetzen der Therapie, assoziiert ist (Abb. 2).
Folgende Faktoren können zu einer Verbesserung der Therapieadhärenz beitragen:
- Patientenaufklärung und Information
- Intensivierung der Patientenbetreuung
- Angebot komplexer verhaltenstherapeutischer Maßnahmen zur Steigerung der Compliance
- Vereinfachung der medikamentösen Therapie-Regime.
Die Intensivierung der Patientenversorgung kann mittels unterschiedlicher Monitoring-Systeme (z. B. Telemonitoring; Anker S. D. et al., Lancet 2011; 378:731-39) durchgeführt werden. Die Kombination unterschiedlicher oben genannter Strategien kann die Therapietreue steigern (Lee J. K. et al., JAMA 2006; 296:2563-2571). Der Referent wies darauf hin, dass Therapietreue auch ein Indikator für eine definierte Risikosituation eines individuellen Patienten darstellt (Granger B. B. et al., Lancet 2005; 366: 2005-11). Dieser Effekt wird als „Healthy survivor“-Phänomen bezeichnet.
Unbestritten ist, dass eine Verbesserung der Medikamentenadhärenz sowohl zu einer Verbesserung des klinischen Zustandes des Patienten als auch zu einer Prognoseverbesserung bei Patienten mit chronischer Herzinsuffizienz beitragen kann.