Herzinsuffizienz und KHK – Neue Daten zur medikamentösen und interventionellen Therapie
In insgesamt drei „Clinical Trials and Update Sessions“ beim diesjährigen ESC wurden neue Daten bereits publizierter Studien präsentiert.
Erwähnenswert sind folgende Ergebnisse betreffend Herzinsuffizienz (HI) und KHK:
SHIFT
Die SHIFT-Studie (Systolic Heart failure treatment with the If Inhibitor ivabradine Trial; Swedberg K. et al., Lancet 2010) wurde bereits beim ESC 2010 in Stockholm präsentiert. In dieser randomisierten, placebokontrollierten Studie mit 6.505 Patienten verbesserte Ivabradin (Procorolan®) die Prognose bei HI (NYHA II–IV), reduzierter LVEF < 35 % und Sinusrhythmus ≥ 70/min, wenn es zusätzlich zur etablierten HI-Therapie gegeben wurde. Der primäre Endpunkt (kardiovaskulärer Tod oder Hospitalisierung wegen HI) wurde verglichen mit Placebo signifikant um 18 % reduziert, der sekundäre Endpunkt (Zeit bis zur ersten Hospitalisierung wegen HI) um 26 %.
J. Borer präsentierte die Ergebnisse über die Wirkung von Ivabradin bezüglich wiederholter Hospitalisierung wegen HI. Patienten mit drei Hospitalisierungen waren signifikant älter, häufiger Diabetiker, hatten eine höhere Herzfrequenz, einen niedrigeren systolischen Blutdruck, eine schlechtere Linksventrikelfunktion, waren seltener in NYHA II und litten länger an HI. Die kumulative Häufigkeit der Hospitalisierungen war mit Ivabradin um 25 % geringer als bei Placebo (die Reduktion betraf die erste, zweite und die dritte Hospitalisierung um jeweils 25 %, 33 % und 29 %).
S. Anker kommentierte die Ergebnisse, indem er hervorhob, dass die Zeit bis zum ersten Ereignis nicht die Gesamtbelastung einer HI widerspiegelt (ein gemeinsamer primärer Endpunkt aus kardiovaskulärem Tod oder Hospitalisierung berücksichtige einen kardiovaskulären Tod nach einer Hospitalisierung oder wiederholten Hospitalisierungen nicht). 1.186 Patienten hatten eine, 472 Patienten 2 oder mehrere Hospitalisierungen; insgesamt gab es 2.113 Hospitalisierungen und 940 kardiovaskuläre Tode. Das bedeutet, dass 44 % aller HI-Hospitalisierungen und 42 % der kardiovaskulären Todesfälle in einer „Time to first event“-Analyse (Ivabradin verhinderte 47 Hospitalisierungen pro 1.000 behandelte Patienten) nicht berücksichtigt werden. Bei einer „Repeat events“-Analyse verhinderte Ivabradin immerhin 93 Hospitalisierungen pro 1.000 Patienten; zukünftige Studien sollten diesen Gesichtspunkt wiederholter Ereignisse stärker berücksichtigen.
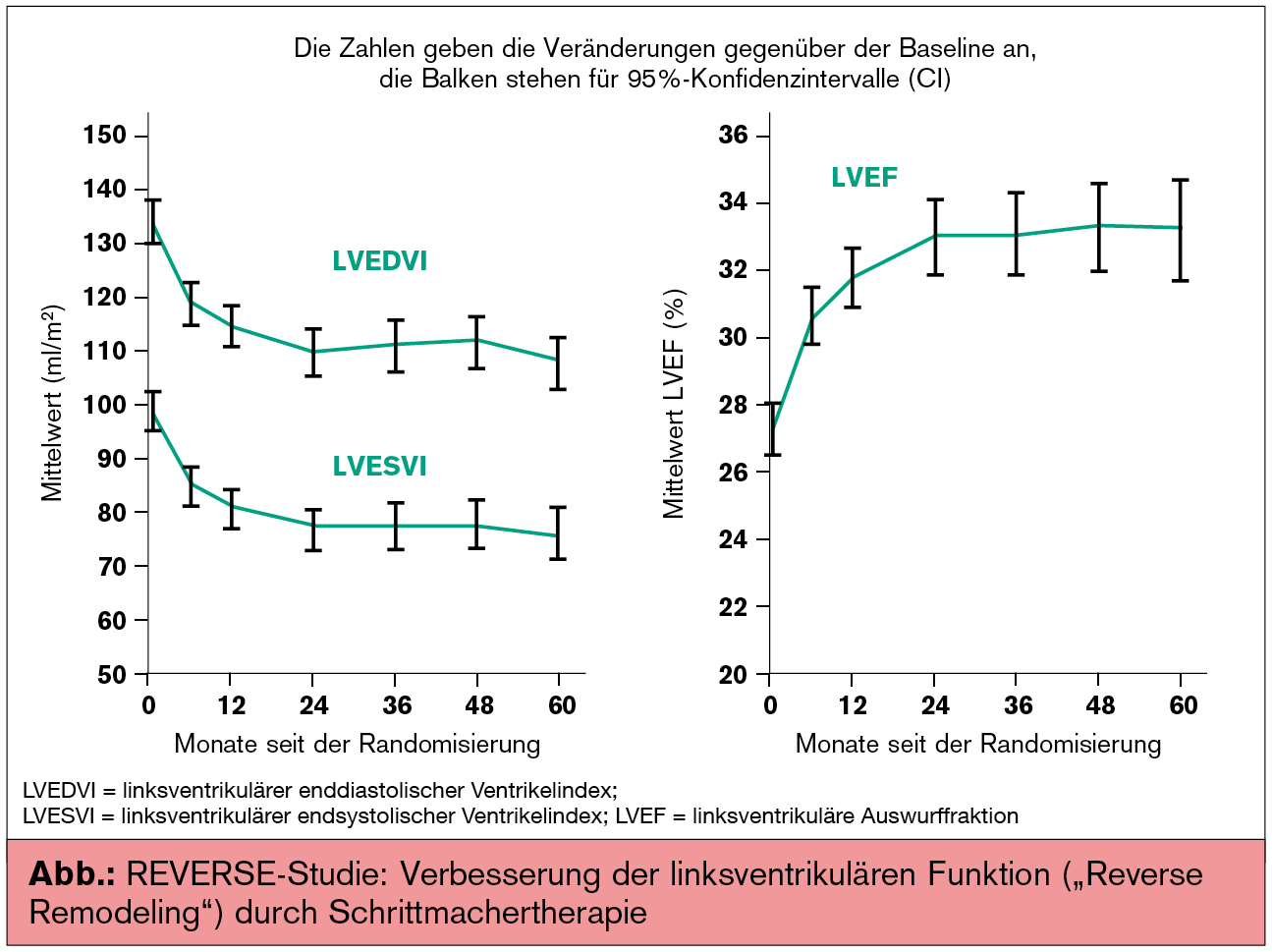
REVERSE
C. Linde präsentierte die 5-Jahres-Ergebnisse der REVERSE-Studie (REsynchronisation reVErses Remodeling in Systolic left vEntricular dysfunction; Linde C. et al., JACC 2008). In der Basisstudie erhielten Patienten in NYHA I oder II mit Sinusrhythmus (SR), QRS-Intervall ≥ 120 ms, linksventrikulärer Auswurffraktion (LVEF) ≤ 40 % und enddiastolischem Durchmesser des linken Ventrikels (LVEDD) ≥ 55 mm einen Schrittmacher mit Defibrillatorfunktion (CRT-ICD-System) implantiert und wurden 1:2 CRT OFF (optimierte medikamentöse Therapie/OMT oder OMT + ICD) vs. CRT ON (CRT + OMT oder CRT + OMT + ICD) randomisiert; nach einem Jahr (US) bzw. 2 Jahren (Europa) wurden alle Patienten auf CRT ON programmiert und durchliefen ein jährliches Follow-up über 5 Jahre. Primärer Endpunkt war die Verschlechterung der HI. Sekundäre Endpunkte waren LVESVi (endsystolischer Volumenindex), 6-Minuten-Gehtest (6MWT), Lebensqualität (QoL), NYHA, Gesamtmortalität und Hospitalisierung wegen HI.
54 % der Patienten in der CRT-ON-Gruppe verbesserten sich verglichen zu 40 % in der CRT-OFF-Gruppe (p < 0,01). Die Reduktion der Hospitalisierung wegen HI betrug im ersten Jahr 53 % in der CRT-ON-Gruppe. Ob die Vorteile auch langfristig bestehen bleiben, wurde in einem Follow-up (durchschn. 54 Monate) bei den 419 Patienten mit CRT ON untersucht. Sowohl die echokardiografischen Parameter als auch die LVEF verbesserten sich in den ersten beiden Jahren und blieben konstant (Abb.).
Die Gesamtmortalität betrug 13,5 % nach 5 Jahren (jährlich 2,9 %). Die Mortalität und erste Hospitalisierung wegen HI betrug 28,1 % nach 5 Jahren (6,4 % pro Jahr) und war damit niedriger als bei medikamentösen HI-Studien. Die Komplikationsrate (bedingt durch die zusätzliche linksventrikuläre Sonde) betrug 12,5 % nach 5 Jahren, wobei die meisten Komplikationen in den ersten 3 Monaten durch eine Sondendislokation oder eine Zwerchfellstimulation verursacht waren.
ATLAS ACS 2-TIMI 51
Die Thrombinbildung beim akuten Koronarsyndrom (ACS) bleibt auch nach dem akuten Ereignis bestehen; Thrombin verursacht Thrombose und Hämostase über Plättchenaggregation, -adhäsion und Fibrinbildung. Rivaroxaban (Xarelto®) ist ein oraler Faktor-Xa-Inhibitor, der die Thrombinbildung hemmt. In der ATLAS-ACS-2-TIMI-51-Studie (Rivaroxaban in Patients following a ST-Elevation Myocardial Infarction) reduzierte Rivaroxaban die kardiovaskuläre Ereignisrate beim ACS.
J. Mega berichtete über die STEMI-Subgruppe, bei der eine Antikoagulation von besonderem Interesse war. 7.817 STEMI-Patienten (von insg. 15.526 Patienten mit ACS) erhielten ASS +/– Thienopyridin (97 % hatten Clopidogrel oder Ticlopidin) und wurden anschließend zu Placebo vs. Rivaroxaban (2 x 2,5 mg bzw. 2 x 5 mg/d) randomisiert. Der primäre Endpunkt war hinsichtlich Effektivität die Kombination aus kardiovaskulärem (KV) Tod, Myokardinfarkt (MCI) und Schlaganfall, hinsichtlich Sicherheit die schwere Blutung.
Rivaroxaban reduzierte signifikant den primären Endpunkt (Effektivität) um 19 %. In der 2-x-5-mg-Gruppe wurde der gemeinsame Endpunkt KV-Tod, MCI und Schlaganfall reduziert, jedoch nicht der KV-Tod. Nur in der Gruppe mit 2 x 2,5 mg wurde auch der KV-Tod um 40 % sowie signifikant die Gesamtmortalität reduziert. Blutungen traten häufiger unter Rivaroxaban als unter Placebo auf, die Rate war in der 2-x-2,5-mg-Gruppe deutlich niedriger als in der 2-x-5-mg-Gruppe (2,46 vs. 4,5 %; 1,08 % bei Placebo). Somit bietet die niedrige Dosis eine effektive Strategie zur Verhinderung von thrombotischen Ereignissen nach einem STEMI.
CARDIA
R. Hall präsentierte die 5-Jahres-Follow-up-Daten der CARDIA-Studie (Coronary Artery Revascularisation in DIAbetes Trial).
CARDIA verglich („non inferiority“) die PCI vs. CABG bei Patienten mit Diabetes und KHK (proximale/komplexe LAD oder 2- bzw. 3-Gefäß-Erkrankung) mit stabiler Angina pectoris oder NSTEMI/ACS. Der primäre Endpunkt war kombiniert: Gesamtmortalität, MCI oder Schlaganfall; der sekundäre Endpunkt war die Rate neuerlicher Revaskularisation. Von 510 Patienten wurden 254 zu CABG und 256 zu PCI randomisiert. Das Follow-up betrug durchschnittlich 5,1 Jahre. Im Schnitt wurden pro Patient 2,9 Gefäße (CABG-Gruppe) revaskularisiert und 3,6 Stents (PCI-Gruppe) gesetzt (69 % DES).
Die CABG-Gruppe erzielte ein tendenziell besseres Ergebnis (primärer Endpunkt 20,5 % vs. 26,6 % in der PCI-Gruppe), die mit 12 % gesetzte „Non-Inferiority“-Grenze wurde aber nicht erreicht. Bei den individuellen Endpunkten war CABG hinsichtlich einer neuerlichen Revaskularisation und beim kombinierten Endpunkt Tod, MCI und neuerliche Revaskularisation signifikant besser, jedoch nicht beim primären Endpunkt (Tod, MCI Schlaganfall). Die Studie war aber für diesen Vergleich „underpowered“. Die Mortalität war in beiden Gruppen gleich. Derzeit gibt es somit keine klare Evidenz für eine Routine-PCI bei Patienten mit Diabetes und Mehrgefäßerkrankung, die ACBG bleibt die bevorzugte Methode für diese Patienten.