Periphere arterielle Verschlusskrankheit – Spezifika in der Diagnose und Therapie beim alten Menschen
Der Mensch ist so alt wie seine Gefäße“ – dieser Satz hat viel für sich. Dass die Jahre allein nicht das Maß der Dinge sind, manifestiert sich ganz besonders im Zustand der Blutgefäße. Dennoch scheint es ein Faktum zu sein, dass Gefäßveränderungen gehäuft bei älteren Patienten beobachtet werden. So stellen kardiovaskuläre Erkrankungen in Österreich und Deutschland die wichtigste Todesursache dar und geben in der Geriatrie den häufigsten Anlass für eine stationäre Behandlung. Dabei rangiert die periphere arterielle Verschlusskrankheit (PAVK) mit einer unterschiedlichen Inzidenz, je nach Untersucher, im Alter bis 50 Jahre zwischen 6,1–9,5 %, in der Alterskategorie ab 55 Jahren aufwärts progredient bei bis zu 20,7 %.
Prävalenz- und Inzidenzdaten der PAVK werden häufig mit dem Auftreten einer Claudicatio intermittens, also der klinischen Manifestation einer peripheren arteriellen Minderdurchblutung, gleichgesetzt. Tatsächlich ist die Krankheit mit Veränderungen am Gefäßsystem bereits lange im Vorfeld der klinischen Beschwerden präsent. Diese „klinisch stumme PAVK“ ist, aufgrund der vielfach begleitenden peripheren Neuropathie, vor allem bei Patienten mit Diabetes mellitus vorzufinden. Daten aus einer Arbeit von Mostaza et al. (Eur J Intern Med 2008) zeigen, dass bei konsequentem Screening bei 26,2 % aller Typ-2-Diabetikern eine periphere Minderperfusion (gemessen mit dem Knöchel-Arm-Index, ABI) vorliegt. Dabei war in dieser Arbeit das Auftreten eines reduzierten ABI mit einem erhöhten Lebensalter, der Dauer der metabolischen Störung, den Plasmatriglyzeriden, aber auch dem Rauchverhalten assoziiert. Zudem konnte in dieser Publikation der Zusammenhang zwischen einem erniedrigten ABI und dem Vorliegen anderer kardiovaskulärer Erkrankungen wie der diabetischen Nephropathie, einer Retinopathie, einer Neuropathie, einem Linksschenkelblock und assoziierten Herzrhythmusstörungen und einer Linksherzhypertrophie nachgewiesen werden.
Interessant erscheint allerdings, dass die Prävalenz des Typ-2-Diabetes bei der hochaltrigen (> 75 Jahre), zu Hause lebenden Bevölkerung mit 9,8 % bei Männern und 6,8 % bei Frauen wieder abzunehmen scheint. Die in dieser Bevölkerungsgruppe mit dem Typ-2-Diabetes assoziierten Gesundheitsprobleme sind anders gewichtet und betreffen renale und kardiale Einschränkungen sowie Sehstörungen. Die PAVK kommt in dieser Alterskategorie selten klinisch manifest vor, diabetische Fußulzerationen betreffen nur mehr 1,7 % der alten Typ-2-Diabetiker. Es erscheint aus diesem Grund sinnvoll, vor allem bei Patienten mit Typ-2-Diabetes im Alterssegment zwischen 50 und 75 Jahren ein engmaschiges und möglichst umfassendes kardiovaskuläres Screeningprogramm zu installieren. Bei älteren multimorbiden Patienten hat das kardiovaskuläre Screening immer den Hintergrund, aufgrund der eher allgemeinen gesundheitlichen Probleme holistische Therapiekonzepte zu entwickeln, um die Lebensqualität maßgeblich zu modifizieren.
Patienten mit einer PAVK werden in allen Leitlinien als „Hochrisiko“-Kollektiv kategorisiert.
Risikofaktoren und pathophysiologische Grundlagen
Bei Diabetikern entstehen als Folge einer Hyperglykämie auf nichtenzymatischem Weg „advanced glycosylated end-products“ (AGE). Makrophagen reagieren darauf mit der vermehrten Freisetzung von proliferativ wirkenden, aber auch lytischen Zytokinen wie „vascular endothelial growth factor“ (VEGF), „tissue growth factor β“ (TGF-β), Tumornekrosefaktor α (TNF-α), Angiotensin 2 oder Endothelin 1. Diese wirken allesamt direkt auf die Struktur der Gefäßwand oder beeinflussen den Gefäßtonus. Hohe Insulinkonzentrationen, wie sie bei Typ-2-Diabetikern mit PAVK, aber auch bei PAVK-Patienten mit normalen Nüchternblutzuckerwerten nachgewiesen werden können, sind direkt verantwortlich für die Zellproliferation in der Gefäßwand und bedingen wiederum Störungen des Lipidstoffwechsels. Damit beeinflusst der Diabetes auch unmittelbar andere vaskuläre Risikofaktoren wie Lipidstoffwechselstörungen und die arterielle Hypertonie. Hyperkoagulabilität durch eine erhöhte Bereitschaft zur Thrombozytenaggregation sowie erhöhte Werte von Plasminogen-Aktivator-Inhibitor-1 (PAI-1) begünstigen wiederum die Entstehung akuter thrombotischer Komplikationen auf Basis eines vorgeschädigten Endothels. Parallel dazu führt die Aktivierung des Zytokinsystems über eine Hemmung des NF-κB-Systems und eine Aktivierung des Ubiquitin- Protease-Systems an der Muskulatur zu einem Verlust an Muskelmasse und zu Veränderungen des Immunsystems. Eine zusätzliche Knochenmarksdepression führt zur Ausbildung einer Anämie.
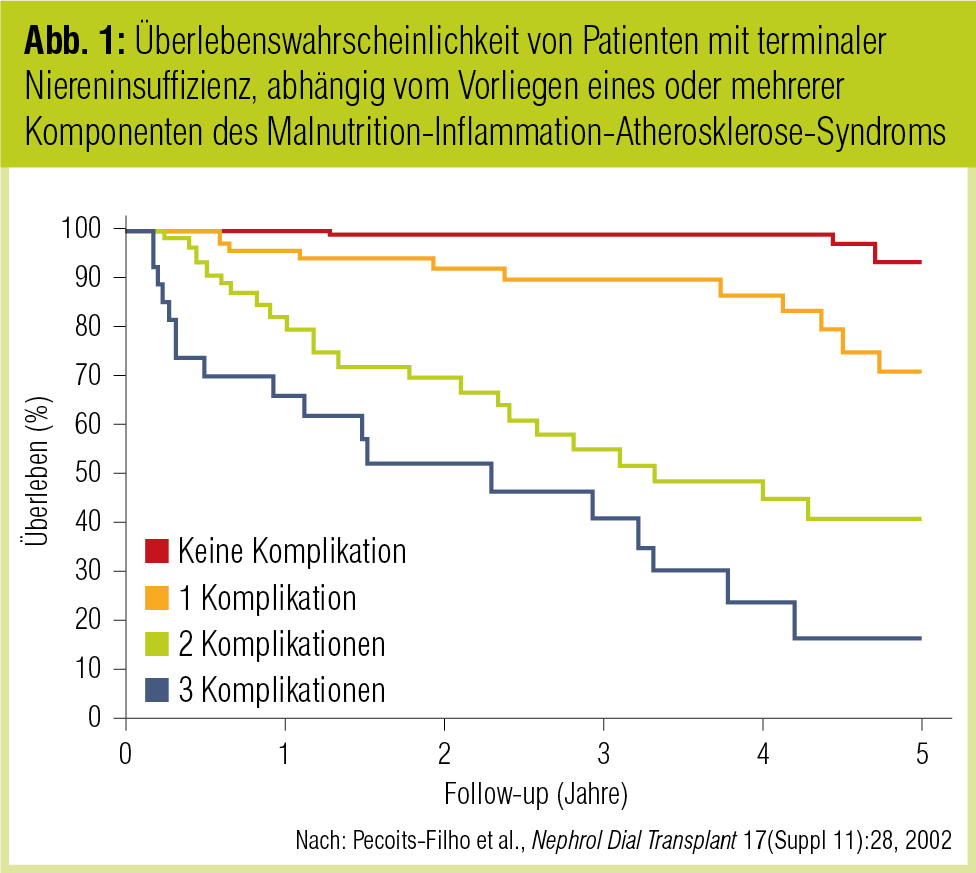
Diese Prozesse bedingen in der Folge eine deutliche Einschränkung der individuellen Reservekapazität und eine Reduktion der kognitiven Fähigkeiten. Dieses als Malnutrition-Inflammation-Atherosklerose-Komplex (MIA-Komplex) bekannte Triumvirat ist bei Patienten mit chronischer Niereninsuffizienz bereits seit den 1990er-Jahren bekannt und publiziert (Pecoits-Filho et al., Nephrol Dial Transplant 2002; Abb. 1). Eine erhöhte Lipolyse und eine Hemmung der Lipoproteinasen haben zusätzlich eine Hypertriglyzeridämie zur Folge, die den Circulus vitiosus weiter antreibt. Damit begünstigen die klassischen Risikofaktoren, welche die Entstehung einer Arteriosklerose bedingen, zusätzlich die Entstehung einer „Frailty“. Allen voran ist dabei der Diabetes mellitus mit seinen Begleiterscheinungen die „Frailty“-Erkrankung per se. Vor allem Männer mit viszeraler Adipositas sind prädisponiert, eine Insulinresistenz zu entwickeln. Diese begünstigt die Manifestation eines metabolischen Syndroms mit Funktionsstörungen des Gerinnungssystems. Diese Pathomechanismen tragen zusätzlich zur Entwicklung des sogenannten „Fat-frail“-Syndroms bei.
Alle diese Überlegungen erscheinen in der Betreuung von Typ-2-Diabetikern aller Altersstufen wichtig, gewinnen aufgrund der vorliegenden epidemiologischen Daten mit dem zunehmenden Lebensalter der betreuten Patienten aber an Bedeutung.
Klinische Präsentation
Die symptomatische PAVK ist charakterisiert durch das Auftreten von „Claudicatio intermittens“, also von belastungsabhängigen Schmerzen nach dem Gehen einer definierten Strecke, welche reproduzierbar sind und sich unter Ruhebedingungen bessern.
Davon abzugrenzen ist die bei Diabetikern gehäuft auftretende „stumme PAVK“. Diese ist gekennzeichnet durch eine mittels ABI-Messung nachgewiesene Gefäßschädigung (ABI < 0,9) ohne Einschränkung der Gehstrecke. Sehr oft besteht auf genaue Befragung hin bereits eine „subtile“ Anamnese bezüglich belastungsabhängiger Beschwerden.
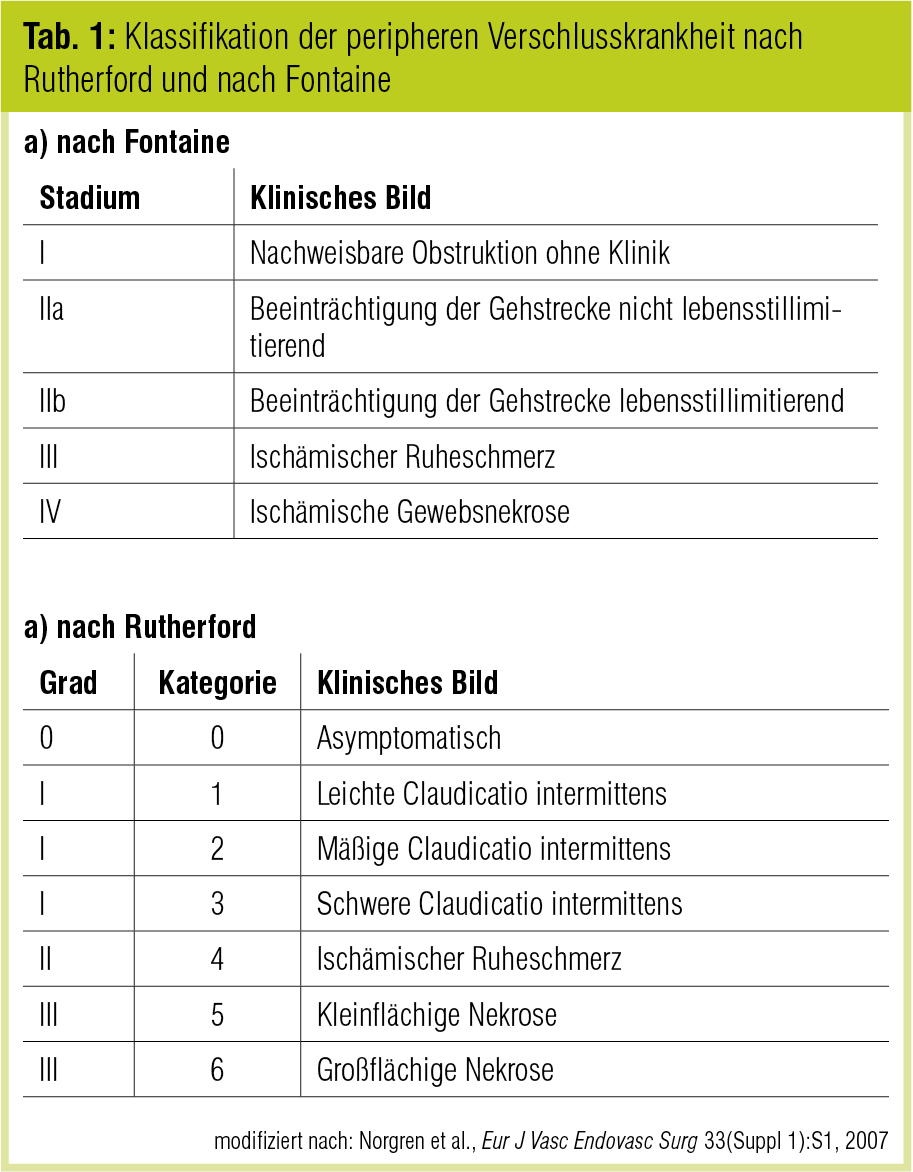
Die symptomatische PAVK wird heute in der klinischen Routine nach Fontaine klassifiziert. Die Klassifikation nach Rutherford ist ebenfalls angeführt, wiewohl nicht mehr ubiquitär gebräuchlich (Tab. 1). Abzugrenzen von einer klassischen Claudicatio-Symptomatik sind vertebrogene Ursachen der Beschwerden, neuropathische Schmerzen, Arthritiden und Arthrosen, aber auch unbemerkte Traumen.
Der ischämische Ruheschmerz ist primär an den Akren, den Fußsohlen und am Calcaneus lokalisiert. Er tritt meist nachts auf und wird durch Tieflagerung der betroffenen Extremität gelindert, durch Hochlagerung der Extremität hingegen verstärkt. Oftmals schwierig vom ischämischen Ruheschmerz abzugrenzen sind neuropathische Schmerzen und Phantomschmerzen, Morbus Sudeck und Neurinome, aber auch Arthritiden und Arthroseschmerzen.
Treten Gewebedefekte in Folge einer PAVK auf, sind diese meist im Fußbereich lokalisiert. Venöse Ulzera treten primär am Unterschenkel und hier bevorzugt an der Unterschenkelinnenseite auf. Makroskopisch sollten die Gewebedefekte als Nekrose, als trockene oder feuchte Gangrän oder Ulcus klassifiziert werden. Das diabetische Fußsyndrom ist von der klassischen PAVK abzugrenzen, wiewohl die klinische Präsentation der PAVK im Stadium IV sehr ähnlich sein kann (siehe Abschnitt „Diabetisches Fußsyndrom“).
Diagnostik der PAVK
Die Diagnostik der PAVK beruht auf einem standardisierten Algorithmus: Die Basisuntersuchung umfasst eine Anamnese und eine klinische Untersuchung des peripheren Pulsstatus. Sie wird ergänzt durch die Messung des ABI mittels Dopplersonde. Als nichtinvasives Untersuchungsverfahren eignet sich die ABI-Messung auch in der Betreuung älterer Menschen sehr gut für die klinische Routine. Die Bewertungskriterien der ABI-Messung sind in Tabelle 2 zusammengefasst.
Gemäß den Leitlinien der American Diabetes Association (Diabetes Care 2012) gibt es eine Empfehlung für ein regelmäßiges Screening von Diabetikern auf das Vorliegen einer PAVK. So soll bei Patienten > 50 Jahre bei Vorliegen eines metabolischen Syndroms alle 5 Jahre eine ABI-Kontrolle durchgeführt werden. Fällt diese unauffällig aus und ist der Patient „klinisch asymptomatisch“, kann dieser Rhythmus beibehalten werden. Bei Patienten unter 50 Jahren und einer Diabetesdauer > 10 Jahren wird bei zusätzlichem Vorliegen eines vaskulären Risikofaktors wie Rauchen, arterielle Hypertonie oder Hyperlipidämie ebenfalls alle 5 Jahre eine ABI-Messung angeraten.
Auch in den Leitlinien der Österreichischen Diabetes Gesellschaft (ÖDG; Lechleitner et al., Wien Klin Wochenschr 2009) wird auf die Diagnostik der PAVK Bezug genommen, wobei bereits bei Diagnosestellung eines Diabetes mellitus die Erhebung eines aktuellen Gefäßstatus empfohlen wird.
Liegt aufgrund der Klinik und der ABI-Messung der Verdacht auf eine PAVK vor, so ist in einem nächsten diagnostischen Schritt die Durchführung einer farbkodierten Duplexsonografie (FCDS) anzustreben. Diese ermöglicht auf nichtinvasivem Weg die Lokalisation von Obstruktionen und Verschlüssen. Eine weiterführende Magnetresonanzangiographie kann vor allem bei Planung einer Gefäßintervention (entweder mittels Katheter oder chirurgisch) erwogen werden. Zu achten ist vor Initiierung derselben, ob der betroffene geriatrische Patient auch tatsächlich von einer möglichen Intervention hinsichtlich sekundärer Morbiditäten und auch der Lebensqualität profitiert. Ebenso ist primär zu prüfen, ob eine nachfolgend nötige Pharmakotherapie auch tatsächlich toleriert werden kann.
Therapieansätze bei geriatrischen Patienten
Die Therapie der PAVK erfolgt stadienorientiert:
Blutzucker- undLebensstilmodifikation. Im Stadium I einer PAVK empfiehlt die Österreichische Gesellschaft für Internistische Angiologie (ÖGIA, 2012) Ernährungsumstellung, Gewichtsreduktion und körperliche Aktivität. Bei geriatrischen Patienten, speziell mit Typ-2-Diabetes ist diese Empfehlung eher differenziert zu sehen. Die vermehrte Ausschüttung von Zytokinen im Rahmen des Diabetes mellitus und der Atherosklerose bedingt einen gesteigerten individuellen Eiweißabbau. Damit verbunden ist der Verlust an Muskelmasse und Muskelkraft, aber auch vielfach eine eingeschränkte Immunkompetenz. Diese Veränderungen bedingen den Abbau funktioneller Reserven und begünstigen beim geriatrischen Diabetiker – mit und ohne PAVK – die Entwicklung einer Frailty. Aus diesem Grund ist die Einhaltung von Diäten generell bei geriatrischen Patienten umstritten. Diese Haltung spiegelt sich auch in den ÖDG-Leitlinien (Fasching et al., Wien Klin Wochenschr 2009) wider. Auch die Empfehlung der Absenkung des LDL-Cholesterin auf < 100 mg/dl ist in diesem Zusammenhang differenziert zu beurteilen.
Sehr positiv ist allerdings die körperliche Aktivität in jedem Lebensalter zu bewerten. So konnte gezeigt werden, dass die Durchführung eines Ausdauertrainings unter geschulter Anleitung die schmerzfreie Gehstrecke bei Patienten mit PAVK statistisch signifikant zu verlängern vermag. Zudem wirkt das körperliche Training der Entwicklung eines Muskelverlustes entgegen, fördert die Koordination im Raum und verhindert oder verzögert effektiv die Entwicklung einer Frailty.
Blutzucker- und Blutdruckkontrolle. Unbestritten scheint in der Therapie der PAVK in jedem Stadium die Senkung des HbA1c und des systemischen Blutdrucks. Tatsächlich liefert die HYVET-Studie (Beckett et al., New Engl J Med 2008) erstmals den Hinweis auf einen kardiovaskulären Benefit auch von hochaltrigen Menschen bei einem Blutdruckwert um 140 mmHg. Daten für die PAVK liegen in diesem Zusammenhang nicht explizit als primärer Endpunkt vor. Aus der klinischen Routine ist aber zu erkennen, dass vor allem bei fortgeschrittenen Stadien der PAVK eine zu starke Absenkung des systemischen Blutdrucks für den einzelnen Betroffenen zu einer Verstärkung der Claudicatio- bzw. lokalen Schmerzsymptomatik in den Nachtstunden führt. Unabhängig von der klinischen Präsentation der PAVK fördert eine zu starke Absenkung des Blutdrucks bei Hochbetagten den Abbau kognitiver Kapazitäten und auch die Sturzneigung.
Nikotinkarenz wird ebenso empfohlen. Diese Strategie wird von hochbetagten Diabetikern oftmals mit nur geringer Compliance und Adherence angenommen und ist in der klinischen Routine, wiewohl in Fachkreisen unbestritten, schwierig zu erreichen.
Thrombozytenaggregationshemmung. Die Empfehlung der Gabe eines Thrombozytenaggregationshemmers, vorzugsweise Azetylsalizylsäure (ASS), ergänzt die Empfehlungen der ÖGIA. Bei geriatrischen Patienten ist die Verabreichung von ASS, vor allem in der Primärprophylaxe, hinsichtlich der zu erwartenden Polypharmazie und „Verschreibungskaskade“ kritisch zu bewerten. Unbestritten ist der Wert in der Sekundär- und Tertiärprophylaxe, sofern dies gastrointestinal toleriert wird (siehe auch DIABETES FORUM 3/2012).
Endovaskuläre Rekanalisation. Ab dem klinischen Stadium IIb einer PAVK kann prinzipiell die Durchführung einer endovaskulären Rekanalisation (EVR) erwogen werden. Zu beachten ist immer eine individuelle Risiko-Nutzen-Abschätzung. Befürworter dieser Therapieform argumentieren zu Recht mit einer niedrigen periinterventionellen Mortalitätsrate. Der Eingriff ist mit einer durchschnittlichen Restenoserate von 20–50 % behaftet, allerdings ist eine frühzeitige neuerliche EVR möglich und der Eingriff selbst für die Patienten nicht sehr belastend. Bei geriatrischen Patienten muss, abgesehen von der technischen Durchführbarkeit einer EVR betreffend die Gefäßmorphologie, auch die individuelle Compliance geprüft werden. Ein weiterer wesentlicher und entscheidender Faktor ist, ob die Patienten gefahrenfrei antikoaguliert werden können. Das fortgeschrittene Lebensalter selbst ist keine EVR-Kontraindikation. In jedem Fall muss das Risiko individuell erwogen werden, vergleichende Studien mit der chirurgischen Revaskularisation liegen derzeit explizit für geriatrische Patienten nicht vor. Eine wesentliche Innovation ist die vermehrte Durchführung von EVR von Unterschenkelgefäßen. Diese wird vor allem bei Patienten mit einer chronisch kritischen Extremitätenischämie und gleichzeitig bestehender koronarer Herzkrankheit (zum Erhalt oberflächlicher Venen für eventuell im weiteren Verlauf anzulegende aortokoronare Bypässe) durchgeführt.
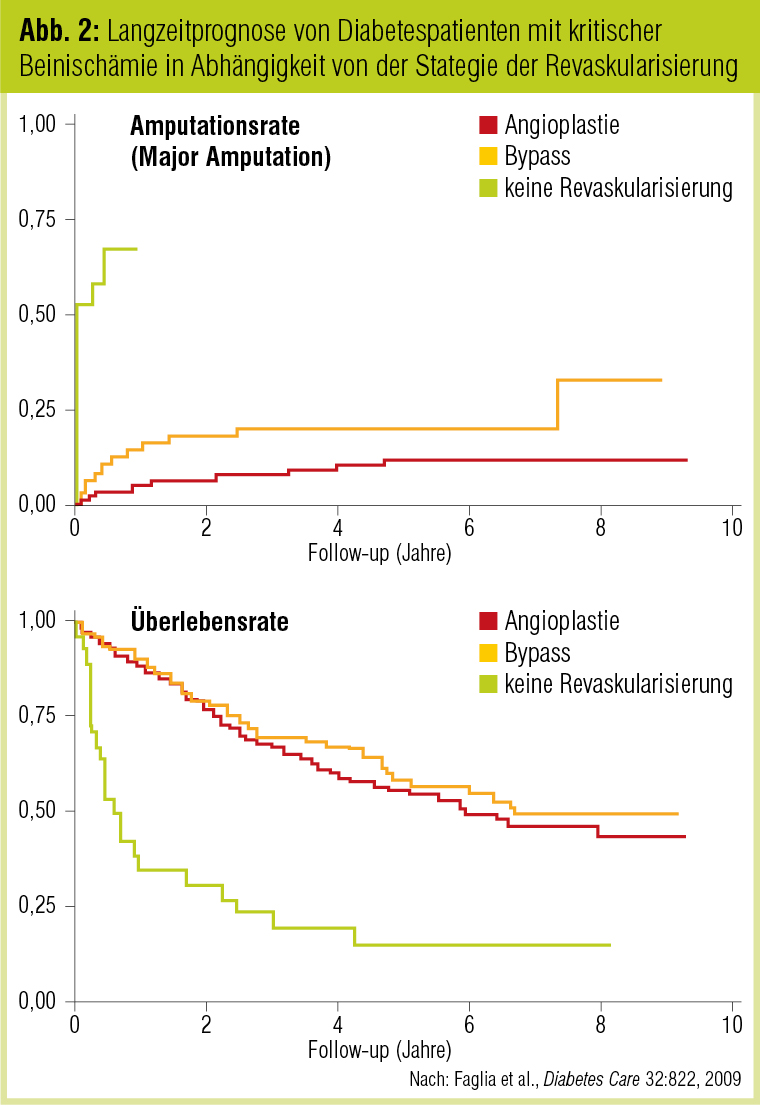
Chirurgische Intervention. Diese ist ohne Zweifel Methode der Wahl zur Rekonstruktion bei Patienten mit chronisch kritischer Extremitätenischämie, insbesondere zur Prävention einer Amputation. Bei Vorliegen einer Claudicatio intermittens ist man von Seiten der Gefäßchirurgie zurückhaltend, da die Gefahr des Verlusts einer Extremität nicht akut vorliegt. Technisch bedient man sich primär der Endarteriektomie oder der Anlage eines Bypasses. Mittels Endarteriektomie werden sehr lokalisierte Obstruktionen saniert; die infrainguinale Bypasschirurgie überbrückt längere arterielle Obstruktionen bevorzugt mit einem autologen Venengraft. Die Erfolgsraten nach 5 Jahren liegen bei 70–80 %. Auch bei der chirurgischen Sanierung ist neben der internistischen OP-Tauglichkeit auch die perioperative Antikoagulierbarkeit zu evaluieren. Als Sekundärprophylaxe ist in den meisten Fällen Aspirin ausreichend. Bei hohem Risiko einer thrombotischen Reokklusion im Bypassbereich wird oral antikoaguliert. Dieses systematische Vorgehen konnte nach Daten von Faglia et al. (Diabetes Care 2009; Abb. 2) die Rate an Major-Amputationen von 68 % auf 20 % bei Diabetespatienten mit PAVK senken; der Endpunkt „Tod“ wurde in dieser Studie von 75 % auf 50 % reduziert (siehe auch DIABETES FORUM 3/2012). Leider sind die Amputationsdaten in Mitteleuropa derzeit – trotz der aus den USA bekannten Datenlage – noch nicht rückläufig. Dieses Phänomen erklärt sich aus den allgemein zunehmenden Prävalenzzahlen für den Diabetes mellitus in Zentraleuropa. Erfreulich ist, dass das individuelle Amputationsrisiko für den einzelnen Patienten unter dem geschilderten Prozedere aber abzunehmen scheint.
Rheologika können alternativ angeboten werden. Heute werden in dieser Indikation auch bei geriatrischen Patienten Prostanoide eingesetzt. Diese sind klinisch gut wirksam und werden im Allgemeinen auch gut vertragen. Die Indikation zur Verabreichung von Prostanoiden besteht laut den TASC-II-Empfehlungen („Trans-Atlantic Inter-Society Consensus for the Management of Arterial Disease“; Norgren et al., Eur J Vasc Endovasc Surg 2007) für jene Patienten, bei welchen eine endovaskuläre Rekanalisation nicht möglich ist, und speziell bei drohender konsekutiver Amputation der Extremität. Ausnahmsweise können Prostanoide bei fehlender EVR-Möglichkeit auch bereits im Stadium II einer PAVK zur Verlängerung der schmerzfreien Gehstrecke eingesetzt werden. Zu Beginn einer Therapie sollte man langsam infundieren, da bekanntermaßen die zu erwartenden Nebenwirkungen wie Kopfschmerzen, Blutdruckabfall sowie Übelkeit und Erbrechen und Durchfall dosisabhängig auftreten. Man versucht auf diesem Weg, die individuell optimal verträgliche Dosis und Infusionsgeschwindigkeit zu finden. Unter stationären Bedingungen werden Prostanoide über 10–14 Tage verabreicht. Es konnte in Studien gezeigt werden, dass selbst niedrige, intermittierende Tagesdosen wirksam sind. Aus diesem Grund wird häufig im ambulanten Bereich von starren Dosierungsschemata abgegangen und der individuelle klinische Verlauf als Entscheidungsparameter für die Dauer und die Dosis der Therapie herangezogen. Für vasoaktive Substanzen wie Buflomedil, Cilostazol, Pentoxifyllin oder Naftidrofuril liegen widersprüchliche Daten vor, sodass der routinemäßige Einsatz in fortgeschrittenen Stadien einer PAVK derzeit nicht empfohlen werden kann.
Das diabetische Fußsyndrom
Das diabetische Fußsyndrom (DFS) ist eine multifaktoriell bedingte Spätkomplikation des Diabetes mellitus. Es ist bedingt durch eine Störung der neuronalen Versorgung (polyneuropathisches Plantarulkus), eine mögliche assoziierte arterielle Durchblutungsstörung der großen peripheren Versorgungsäste (diabetische Makroangiopathie, assoziierte diabetische Gangrän) und möglicherweise assoziiert mit einer Osteomyelitis. Vor allem Letztere bedingt eine strukturelle Veränderung des Fußaufbaus und bedeutet für den Betroffenen ausgeprägte Störungen in der individuellen Mobilität.
Das diabetische Fußsyndrom muss gegen eine Vielzahl von möglichen Differenzialdiagnosen abgegrenzt werden: Neuropathien anderer Ursachen, eine PAVK anderer Ursache, eine orthopädische Grunderkrankung oder eine Erysipel. Eine Tinea pedum oder ein Unguis incarnatus sind weitere zu erwägende Veränderungen im Vorfußbereich von Diabetikern. Eine der häufigsten Veränderungen im Nagelbereich ist die Candida-Paronychie, diese alleine prädisponiert für ein DFS, ist aber per se noch nicht zu einem DFS zu zählen. Immunologische Erkrankungen und Lues als Ursachen für Vorfußveränderungen sind bei geriatrischen Patienten vernachlässigbar selten.
Klinisch präsentieren sich geriatrische Patienten mit DFS in zwei Formen: Patienten mit einem neuropathischen Fußsyndrom weisen im Vorfußbereich eine verminderte Sensibilität auf, die meist an den Fußsohlen bestehenden Druckstellen sind schmerzlos und wirken wie „ausgestanzt“. Die Fußpulse sind meist tastbar, die Vorfüße warm. Meist bestehen bei den Betroffenen bei Inspektion an den Füßen Schwielen, gelegentlich kommt es aufgrund der zusätzlich gestörten Mikrozirkulation zu lokalen Wassereinlagerungen und Ödemen. Das Risiko für eine Begleitinfektion ist hoch. Der ischämisch-gangränöse diabetische Fuß ist gekennzeichnet durch blasse Akren und Vorfüße, die peripheren Fußpulse sind meist nicht tastbar. Die Sensibilität der Vorfüße bleibt erhalten, die meist an den Akren lokalisierten Ulzera sind schmerzhaft. Anamnestisch ist eventuell eine Claudicatio-Symptomatik, zumindest im Vorfeld der Ulzerationen, zu erheben.
Diagnostik des diabetischen Fußsyndroms
Die Stadieneinteilung des DFS folgt der Klassifikation nach Wagner (Tab. 3). Jeder Verdacht auf Vorliegen eines DFS muss hinsichtlich einer zugrunde liegenden Minderperfusion abgeklärt werden. Dabei folgt die Diagnostik dem bereits für die PAVK beschriebenen Algorithmus. Zusätzlich sollten Entzündungsparameter wie das C-reaktive Protein und ein Blutbild laborchemisch regelmäßig bestimmt werden. Liegen bereits Vorfußläsionen vor, sollte nach einem abgestuften Konzept immer eine Knochendiagnostik erfolgen. Primär sollte ein Vorfußröntgen erfasst werden. Zeigt dieses keine osteologische Mitbeteiligung und bestehen sehr hohe Entzündungsparameter bzw. ein ausgeprägter klinischer Befund mit schlechter Heilungstendenz unter einem konsequenten Therapieansatz, so sollte eine Skelettszintigrafie zum Nachweis oder Ausschluss einer Knochenmitbeteiligung durchgeführt werden. Ergänzend oder alternativ ist an die Durchführung einer Magnetresonanztomografie zu denken.
Therapie des diabetischen Fußsyndroms
Therapeutisch folgt man bei Vorliegen eines DFS dem DIRAS-Konzept (DIRAS: Druckentlastung, Infektionsbekämpfung, Revaskularisierung, Minor-Amputation und Sekundärprophylaxe).
Vor allem die Druckentlastung bedeutet für geriatrische Patienten mit DFS eine starke Belastung. Im Vordergrund steht das Anmessen eines druckentlastenden orthopädischen Schuhwerks.
Vorfußentlastungsschuhe, wie von den Fachgesellschaften empfohlen, sind für alte Menschen aufgrund einer bereits vorbestehenden Gangunsicherheit und gestörten Propriozeption im Fußbereich nicht anwendbar. Sie führen zu einer erhöhten Sturzneigung und bedingen vielfach eine ungewollte Immobilisierung. Zum Anziehen des orthopädischen Schuhwerks brauchen Betroffene vielfach die Unterstützung der Pflege oder der Angehörigen. Orthopädisches Schuhwerk erhält aber häufig die Möglichkeit einer partiellen Mobilisierung.
Die in den Leitlinien empfohlene Immobilisierung durch Bettruhe oder in Form einer Rollstuhlpflicht wird aus der Sicht der Geriatrie hinsichtlich der Entwicklung eines Frailty-Syndroms kritisch gesehen. Die unterstützend gedachten Unterarmstützen sind bei geriatrischen Diabetikern aufgrund der zusätzlich häufig bestehenden Sarkopenie und der damit reduzierten groben Kraft nur begrenzt einsetzbar. Jedenfalls muss deren Verwendung im Einzelfall unter Aufsicht getestet werden.
Besteht lokal zusätzlich eine Entzündung, wird gemäß den Leitlinien eine Infektionsbekämpfung eingeleitet. Die Antibiose besteht meist langfristig über Wochen und Monate und ist bei geriatrischen Patienten vielfach mit Nebenwirkungen assoziiert. Störungen der Darmflora bedingen ein unregelmäßiges Stuhlverhalten und – damit verbunden – eine gestörte Resorption von Mikro- und Makronährstoffen. Schleichend eintretende Minderversorgungen und Gewichtsverlust werden vielfach nicht bemerkt und begünstigen das Fortschreiten einer Sarkopenie und Frailty. Vielfach ist auch eine verminderte individuelle Nahrungsaufnahme, bedingt durch Inappetenz im Rahmen der Entzündung oder der Polypharmakotherapie, die Ursache für diese Veränderungen.
Prinzipiell werden zur Antibiose Clindamycin und Gyrasehemmer sowie bei Bedarf eine antimykotische Therapie als Mittel der Wahl beim DFS empfohlen. Bei geriatrischen Patienten sind in diesem Zusammenhang vor allem gastrointestinale Beschwerden, Verlängerungen der QT-Zeit und zentralnervöse Nebenwirkungen zu bedenken. Bei Therapie mit Chinolonen führt die gleichzeitige Einnahme von Kalzium, Magnesium und Eisen zu einer Verschlechterung der Substanzresorption. Es besteht eine Kontraindikation zur gleichzeitigen Therapie mit Duloxetin und Theophyllin aufgrund der zu erwartenden zentralnervösen Nebenwirkungen. Auch die Kombination mit ASS scheint die Wahrscheinlichkeit für das Auftreten von zentralnervösen Nebenwirkungen (Herabsetzung der Krampfschwelle, Delirneigung) zu begünstigen.
Ergänzt wird die Infektionsbekämpfung durch eine stadiengerecht angepasste Wundtherapie. Besteht zusätzlich im Rahmen des DFS eine Störung der Durchblutung im Bereich der großen versorgenden Arterien, sollte zur Optimierung des Heilungsprozesses unbedingt eine Revaskularisation angestrebt werden. Diese folgt denselben Kriterien wie bei einer PAVK.
Spricht der Lokalbefund des DFS trotz intensiver Therapiebemühungen nicht mit Heilungstendenz an, so muss die Amputation des betroffenen Gewebeabschnitts erwogen werden. Ziel muss es bei geriatrischen Diabetikern sein, den Amputationsbereich so klein wie möglich zu halten, da der Verlust einer Extremität für die Betroffenen vielfach eine eingeschränkte Mobilität und damit sekundäre Pflegeabhängigkeit bedeutet. Wird der Plan einer Amputation gefasst, so sollte bereits im Vorfeld des Eingriffs das individuelle Remobilisationspotenzial mit einem geriatrischen Assessment evaluiert werden. Vorzugsweise eignen sich dafür aufgrund der klinischen Erfahrung ein zweizeitiger Barthel-Index, die Esslinger Transferskala, die Bestimmung des Mini Nutritional Assessments (MNA) und der groben Handkraft mittels Dynamometer, ein Mini-Mental-Test sowie eine soziale Umfeldanamnese (z. B. mittels „SOS Hochzirl“).
Immer ist bei geriatrischen Diabetikern mit DFS und ischämisch gangränösen Füßen in regelmäßigen Abständen ein Schmerz-Assessment mitzuführen. Bei kommunikationsfähigen Patienten empfiehlt sich die Verwendung einer „verbal rating scale“, bei dementen Patienten kann die BESD-Skala („Beurteilung von Schmerzen bei Demenz“) eingesetzt werden. Die Schmerztherapie folgt den Empfehlungen der WHO, wobei deren „unhinterfragter“ Einsatz bei geriatrischen Patienten in Fachkreisen derzeit diskutiert wird.
Zusammenfassung
Die Betreuung geriatrischer Diabetiker mit PAVK bzw. DFS stellt nicht nur das Gesundheitssystem, sondern auch die betreuenden Ärzte, die Pflege, die Angehörigen und nicht zuletzt die Betroffenen selbst vor große Herausforderungen. Es bestehen klare nationale und internationale Leitlinien zur Therapie des Diabetes mellitus und seiner Spätkomplikationen ebenso wie zum Management der diabetischen PAVK. Allerdings wird in vielen dieser Leitlinien kein Bezug auf die Besonderheiten geriatrischer Patienten genommen. Eingeschränkte individuelle Reservekapazität, Frailty, soziale Desintegration, Inkontinenz, kognitive Einschränkungen und nicht zuletzt eine geänderte Pharmakokinetik und Pharmakodynamik machen die leitliniengerechte Betreuung dieser alten Menschen zu einer Conditio sine qua non. Der individuelle Zugang nicht nur im Primärversorgungsbereich, sondern auch bei Fachspezialisten hält vielfach nur zögerlich Einzug in unseren medizinischen Alltag. Voraussetzung für ein optimiertes Management dieser Patienten ist ein optimales Schnittstellenmanagement zwischen intra- und extramuralem Versorgungsbereich bzw. der mobilen Pflege. In diesem Sinne wäre es auch wünschenswert, jene Bereiche bei der Erstellung nationaler und internationaler Leitlinien, trotz derzeit spärlich verfügbarer medizinischer Evidenz im vaskulären Management geriatrischer Patienten, einzubeziehen. Zum gegebenen Zeitpunkt bleibt das Management dieser hochsensiblen Gruppe eine individuelle Entscheidung der betreuenden Ärzte. Die Autorin hofft, mit dem vorliegenden Artikel eine praxisnahe Hilfestellung für Kolleginnen und Kollegen geliefert zu haben.