Ovarialkarzinom – Aktuelle Perspektiven in der antiangiogenen Therapie
Die therapeutische Hemmung der Angiogenese ist ein wichtiges onkologisches Wirkprinzip, das insbesondere beim Ovarialkarzinom einen entscheidenden Faktor darstellt. Beispielsweise bedingt der VEGF-Hemmer Bevacizumab beim Rezidiv eine deutliche Verlängerung des krankheitsfreien Überlebens und wirkt in ähnlicher Weise auch in der Primärsituation günstig. Dies hat kürzlich auch zur Zulassung von Bevacizumab beim fortgeschrittenen Ovarialkarzinom geführt.
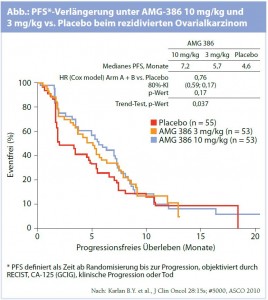
Peptibody gegen Gefäßdifferenzierung: Die Inhibition der Angiogenese ist nicht nur über die VEGFAchse möglich. Eine der Ansatzmöglichkeiten an der angiogenen Kaskade resultiert aus der Blockade des Tie-2-Rezeptors, der für die Ausdifferenzierung von Blut- und Lymphgefäßen Bedeutung besitzt. Mit dem Peptibody AMG-386 liegt nun eine Substanz vor, die am Tie-2-Rezeptor andockt und dadurch zu einer antiangiogenen Blockade führt. Am ASCO-Kongress präsentierte Phase-I-Daten demonstrierten eine Verbesserung des progressionsfreien Überlebens (PFS) durch AMG 386 bei vorbehandeltem Ovarialkarzinom.1 Im Rahmen einer Phase-II-Studie konnte bei Patientinnen mit rezidiviertem Ovarialkarzinom, Tubenkarzinom oder primärem Peritonealkarzinom, die eine Chemotherapie mit wöchentlichem Paclitaxel erhielten, ebenfalls eine PFS-Verlängerung unter den beiden AMG-386-Dosierungen von 3 mg/kg und 10 mg/kg gegenüber Placebo dokumentiert werden (7,2 bzw. 5,7 vs. 4,6 Monate; Abb.).2
Diese Erkenntnisse hatten die Konzipierung zweier randomisierter, doppelblinder Phase-III-Studien zur Folge, welche die Zugabe von AMG-386 zur Chemotherapie bei rezidiviertem partiell platinsensitivem oder platinresistentem Ovarialkarzinom, Tubenkarzinom oder primärem Peritonealkarzinom evaluieren. In TRINOVA 1 besteht die Chemotherapie aus wöchentlich verabreichtem Paclitaxel, in TRINOVA 2 aus pegyliertem liposomalem Doxorubicin (PLD). Die Studienleitung von TRINOVA 2 obliegt der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO). Mit der Leitung dieser großen Registrierungsstudie beweist die AGO internationale Präsenz und setzt damit ein wichtiges Zeichen.
TRINOVA 1 läuft derzeit weltweit in den Studienzentren. TRINOVA 2 befindet sich „on hold“; da PLD derzeit nicht produziert wird; die Studie wird fortgesetzt, sobald das Medikament wieder verfügbar ist, womit im dritten Quartal dieses Jahres gerechnet werden kann.
TRINOVA 3: Um zu studieren, ob AMG-386 nicht nur in der Rezidivsituation Effektivität entfaltet, wurde TRINOVA 3 initiiert. Im Rahmen dieser Phase-III-Studie kommt bei Patientinnen mit Ovarialkarzinom, primärem Peritonealkarzinom oder Tubenkarzinom die Standard-Chemotherapie mit Paclitaxel und Carboplatin zur Anwendung; zusätzlich wird randomisiert entweder mit AMG-386 oder Placebo behandelt. Die Rekrutierung hat bereits begonnen. Nun sind die österreichischen Zentren aufgerufen, sich an dieser internationalen Zulassungsstudie aktiv zu beteiligen und die gewonnenen Daten den hohen Qualitätsstandards entsprechend aufzuarbeiten.
Ein interessanter Aspekt resultiert aus den unterschiedlichen Nebenwirkungsmustern und -inzidenzen der einzelnen Angiogenesehemmer. So tritt etwa die klassische Nebenwirkung der Hypertonie nicht bei allen Wirkstoffen im selben Ausmaß in Erscheinung. In den ersten Studien mit AMG-386 wurde keine Häufung der aus den Bevacizumab-Studien bekannten unerwünschten Effekte (Darmperforation, Hypertonie, Thromboembolien, Proteinurie, Blutungen) beobachtet. Eine spezifische Nebenwirkung der Substanz ist dagegen die Entstehung von Ödemen und Ergüssen. Daher darf beispielsweise das Auftreten eines Aszites unter einer Therapie mit AMG-386 nicht als Kriterium für eine Progression eingestuft werden. Nachdem die Ergebnisse der Studien mit AMG-386 ebenso wie jene der Untersuchungen mit anderen in derselben Indikation geprüften Substanzen (Pazopanib, BIBF 1120) noch nicht vorliegen, können bezüglich der Positionierung der einzelnen zielgerichteten Therapien im Behandlungsalgorithmus des Ovarialkarzinoms derzeit noch keine definitiven Aussagen getroffen werden.
1 Wenham R.M. et al., J Clin Oncol 2010; 28:15s (suppl; abstr 5049)
2 Karlan B.Y. et al., J Clin Oncol 2010; 28:15s (suppl; abstr 5000)