Klinische und therapeutische Aspekte bei Kindern mit multipler Sklerose
Epidemiologie
Die multiple Sklerose (MS) im Kindesalter ist wie bei Erwachsenen eine chronisch-entzündliche Erkrankung des Gehirns und Rückenmarks, die durch ein unterschiedliches Ausmaß von Entzündung, Entmarkung und axonalem Schaden charakterisiert ist.
Man unterscheidet bei Kindern zwischen einem Auftreten der Erkrankung vor dem 10. Lebensjahr und der sehr viel häufigeren Manifestation zwischen dem 10. und 16. Lebensjahr mit einem Altersgipfel nach der Pubertät. Vor der Pubertät ist die Verteilung zwischen Jungen und Mädchen gleich, während und nach der Pubertät tritt die MS deutlich häufiger bei Mädchen auf. Ungefähr 5 % aller MS-Erkrankungen treten vor dem 16. Lebensjahr auf. In einer österreichweiten Erhebung konnte festgestellt werden, dass bei etwa 8 % aller PatientInnen bereits vor dem 18. Lebensjahr erste Symptome auftreten, dass es aber etwa doppelt so lange wie bei Erwachsenen dauert, bis die Diagnose gestellt wird (Kornek et al., unpublished).
Diagnosestellung
Ein wesentliches Merkmal auch der MS im Kindesalter ist die zeitliche und örtliche Dissemination, d. h. schubartiges Auftreten von Symptomen zu unterschiedlichen Zeitpunkten mit wechselnder neurologischer Symptomatik1, 2.
Neben der Anamnese und den typischen Symptomen in der neurologischen Untersuchung sind die charakteristischen Auffälligkeiten in der Bildgebung, Befunde der Neurophysiologie und Liquoruntersuchung wichtige Bausteine in der Diagnose3–5.
Auch bei Kindern gilt, dass ein Schub durch neue oder durch Reaktivierung bereits zuvor aufgetretener Ausfälle gekennzeichnet ist, die mindestens 24 Stunden anhalten. Es sollte ein Zeitintervall von 30 Tagen zwischen einem neuen und einem vorausgegangenen Schub bestehen, der nicht durch Änderungen der Körpertemperatur (Uhthoff-Phänomen) oder im Rahmen von Infektionen zu erklären ist.
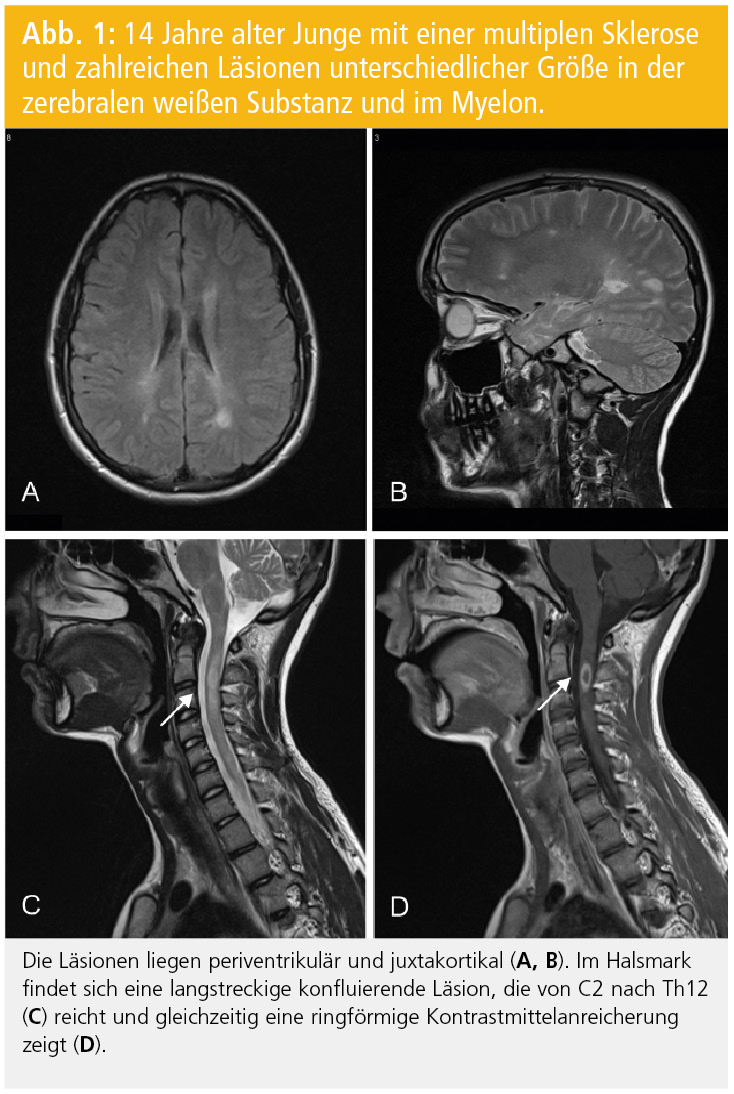
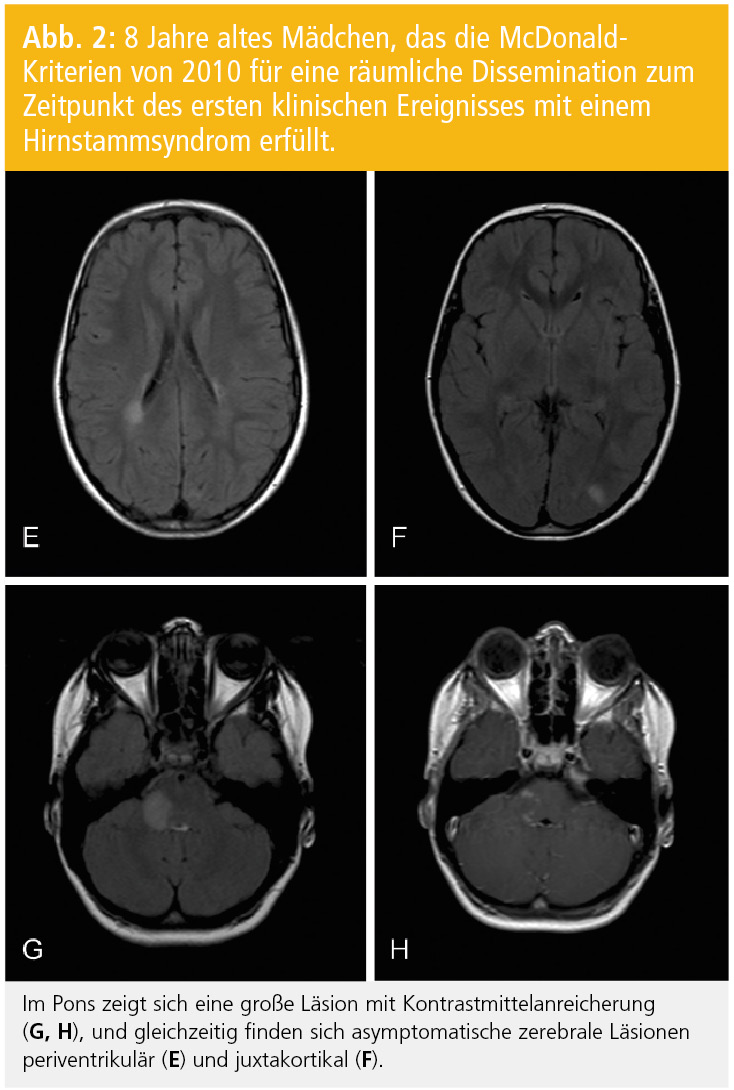
Diagnosekriterien: Nach den Kriterien der IPMSSG (International Pediatric MS Study Group) kann die Diagnose einer MS bei Kindern gestellt werden, wenn entweder zwei Schübe auftreten, die auf Läsionen an zwei Orten des ZNS zurückzuführen sind, oder nach einem erstmaligen klinischen Ereignis der Nachweis der zeitlichen und räumlichen Dissemination mittels MRT gelingt6. Die neuen McDonald-MS-Kriterien, deren Anwendung auch bei Kindern empfohlen wird, verlangen für den Nachweis der räumlichen Dissemination zumindest eine Läsion in zwei der folgenden Regionen: periventrikulär, juxtakortikal, infratentoriell oder spinal (symptomatische infratentorielle oder spinale Läsionen werden nicht miteinbezogen7; Abb. 1 und 2). In Einzelfällen kann bereits anhand des ersten MRT der Nachweis der zeitlichen Dissemination erfolgen; nämlich dann, wenn in diesem MRT gleichzeitig kontrastmittelaufnehmende asymptomatische und nicht-KM-aufnehmende Läsionen nachweisbar sind. Es konnte aber gezeigt werden, dass die Sensitivität für den Nachweis der zeitlichen Dissemination im ersten MRT deutlich geringer ist als bei einem Folge-MRT, das eine neue oder neue KM-aufnehmende Läsion aufweist8.
In den neuen Diagnosekriterien ist die Liquoruntersuchung für PatientInnen mit einem schubhaften Verlauf nicht mehr zwingend vorgesehen7. Die Liquoruntersuchung mit dem Nachweis oligoklonaler Banden bzw. einer intrathekalen IgG-Synthese kann besonders in atypischen Fällen sehr hilfreich sein, da bei dem überwiegenden Anteil der Kinder der Nachweis spätestens nach dem zweiten klinischen Ereignis gelingt4.
Verlauf
Neben diesen Gemeinsamkeiten unterscheidet sich die MS im Kindesalter aber in einigen wichtigen Punkten. Häufige Frühsymptome bei Kindern sind z. B. eine Ataxie mit Intentionstremor und Augenbewegungsstörungen, die bei Erwachsenen seltener auftreten9.
Kinder mit MS haben fast ausschließlich einen schubförmigen Verlauf, der nach durchschnittlich 20 Jahren in eine sekundär-chronische Phase einmündet, d. h. zu einer schleichenden Zunahme klinischer Symptome ohne zusätzliche Schübe führt10, 11.
Primär progrediente Verläufe im Kindesalter sind eher untypisch und sollten die Diagnose noch einmal überdenken lassen. Obwohl Kinder also ein wesentlich längeres Intervall zwischen Erstmanifestation und persistierenden Symptomen haben, erreichen sie doch 10 Jahre früher einen signifikanten Grad an Behinderung als Erwachsene, deren Erkrankungsbeginn nach dem 18. Lebensjahr erfolgte11. Auf der anderen Seite konnte gezeigt werden, dass PatientInnen mit einer kindlichen MS, deren Erkrankung in eine sekundäre Progression übergeht, sich im weiteren Verlauf klinisch nicht von PatientInnen unterscheiden, deren Erkrankung im Erwachsenenalter begann11. Diese Beobachtung lässt darauf schließen, dass die neurodegenerative Phase der MS sich nicht zwischen den beiden Gruppen unterscheidet.
Prognostisch ungünstige Faktoren bei Kindern scheinen eine polysymptomatische Manifestation, kurzes Intervall zwischen 1. und 2. Schub, viele Schübe in den ersten beiden Jahren der Erkrankung und der Nachweis von perpendikulären Läsionen in der weißen Substanz zu sein12.
Ein weiterer wichtiger Unterschied ist, dass Kinder mit MS in der Anfangsphase eine deutlich höhere Anzahl von Schüben haben als Erwachsene, unabhängig davon, ob sie mit einer immunmodulierenden Substanz behandelt werden13.
Differenzialdiagnosen
Weiters sind die sehr viel breiteren Differenzialdiagnosen hervorzuheben, die eine Vielzahl von seltenen Erkrankungen im Kindesalter erfassen, deren Symptome und MRT-Veränderungen in der weißen Substanz des Gehirns und des Rückenmarks Ähnlichkeiten aufweisen können14 (Tab. 1).
Die wichtigste Differenzialdiagnose stellt die akute disseminierte Enzephalomyelitis (ADEM) dar, die in der Regel monophasisch verläuft (Tab. 2)15. Zwingend für die Diagnose einer ADEM ist der Nachweis einer polyfokalen Symptomatik und einer Bewusstseinsstörung6. In Einzelfällen kann eine ADEM aber eine MS-Erstmanifestation darstellen und erst im Verlauf zwischen der monophasischen ADEM und der chronisch schubhaften MS unterschieden werden.
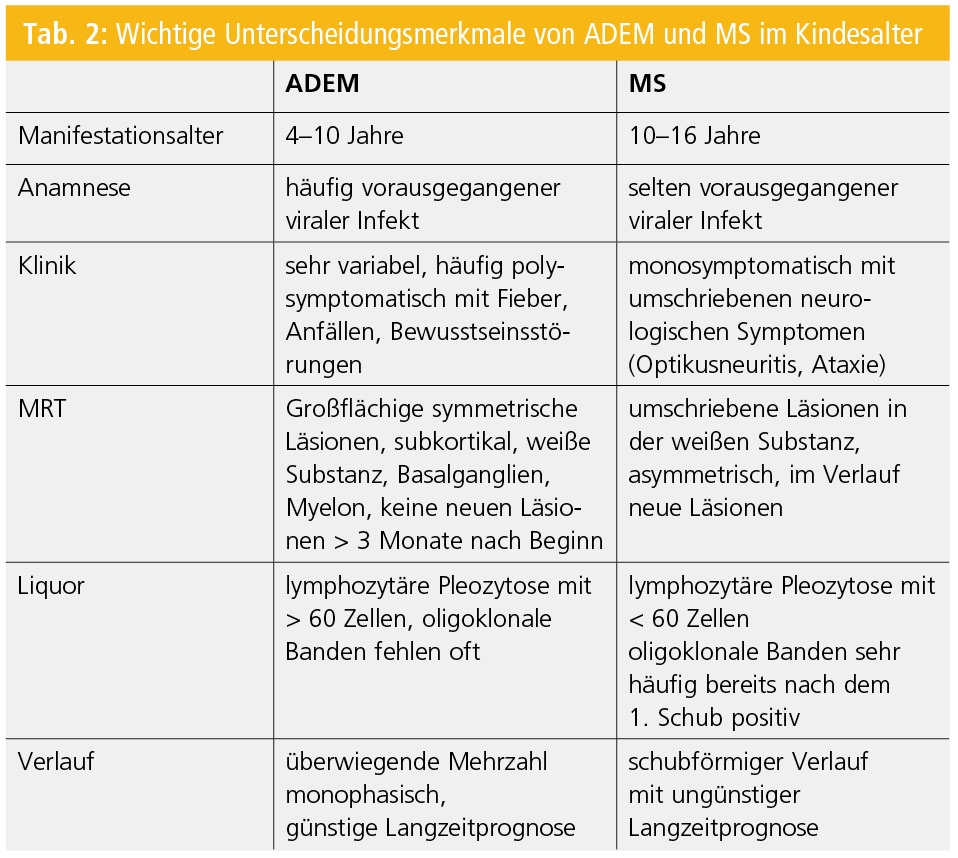
Kinder mit ADEM sind aber in der Regel jünger und haben ausgeprägtere Symptome (Anfälle, Bewusstseinstörung). Obwohl der Krankheitsverlauf bei der Mehrzahl der PatientInnen monophasisch ist, ist es wichtig, hervorzuheben, dass es in einzelnen Fällen, besonders nach abrupter Beendigung der Kortisontherapie, zu einer Verschlechterung kommen kann. Neuerliche Symptome oder Läsionen, die innerhalb von 3 Monaten nach Beginn der ADEM auftreten, werden dieser Episode zugerechnet und nicht als neuerliches Ereignis gewertet. Die Langzeitprognose von Kindern mit ADEM wird als gut erachtet. Kinder, die im Rahmen einer ADEM eine spinale Beteiligung haben, scheinen aber häufiger bleibende neurologische Symptome wie eine Paraparese oder eine Blasenfunktionsstörung zu haben16.
Therapie
Die IPMSSG empfiehlt den Beginn mit einer Basistherapie (Interferon-beta-Präparate und Glatiramerazetat) bei allen Kindern und Jugendlichen, die die Kriterien einer MS erfüllen17. Bei Kindern mit einem „klinisch isolierten Syndrom“ kann eine Therapie erwogen werden, sofern die Schubsymptomatik sich nicht vollständig zurückbildet und im MRT zahlreiche Läsionen in MS-typischer Lokalisation vorliegen17. Allerdings ist es wichtig, hervorzuheben, dass bis heute keine prospektiven Studien bei Kindern vorliegen und somit die Wirksamkeit der Interferon-beta-Präparate oder Glatiramerazetat im Gegensatz zu den Erwachsenen nicht nachgewiesen ist. Verschiedene retrospektive Studien haben aber gezeigt, dass das Nebenwirkungsprofil bei Kindern vergleichbar ist mit dem von Erwachsenen und dass es möglicherweise ebenso zu einer Schubreduktion unter der Behandlung kommt8–20 (Tab. 4).
Therapieversagen: Aufgrund der oft hohen Schubrate bei Kindern und Jugendlichen kommt der Definition des Therapieversagens der so genannten Basistherapien eine besondere Bedeutung zu. Die IPMSSG fordert zur Evaluierung der Therapie zumindest eine 6-monatige Behandlungsdauer mit einem Basistherapeutikum, unter dem die Compliance sichergestellt ist, und zwei oder mehr Schübe innerhalb von 12 Monaten oder eine gleichbleibende oder höhere Schubrate im Vergleich zur Periode vor Therapiebeginn mit neuen oder KM-aufnehmenden Läsionen im MRT.
Bei Erwachsenen mit ungenügendem Ansprechen auf Interferon-beta oder Glatiramerazetat wird derzeit eine Umstellung auf Natalizumab oder – seit kurzer Zeit – auch Fingolimod empfohlen. Die zuvor angewendeten Immunsuppressiva wie Zyklophosphamid und Mitoxantron sind aufgrund ihrer Sicherheitsprofile in den Hintergrund gerückt.
Natalizumab ist eine hocheffektive Therapie bei aktiver schubhafter MS bei Erwachsenen21. Bei Kindern und Jugendlichen gibt es neben kleineren Fallserien nur eine Klasse-IV-Studie, die ebenfalls auf eine deutliche Schubreduktion hinweist22. Der Einsatz dieser Substanz ist aber durch das Risiko, an einer PML (progressiven multifokalen Leukenzephalopathie) zu erkranken, limitiert und sollte deshalb nur ausgewählten PatientInnen nach ausführlicher Abwägung des Nutzen-Risiko-Profils gemeinsam mit der Familie angeboten werden. Mit Fingolimod, das kardiale Nebenwirkungen, ein Makulaödem und Blutbildveränderungen induzieren kann und über dessen Langzeitsicherheitsprofil noch keine Daten vorliegen, gibt es bei pädiatrischen MS-PatientInnen noch keine Erfahrung.