Dosisreduzierte Konditionierung, Nabelschnurblut, extrakorporale Photopherese bei GVHD – Neue Konzepte der Stammzelltransplantation
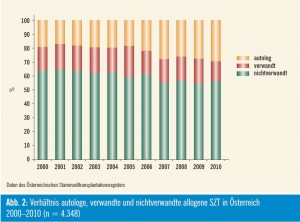
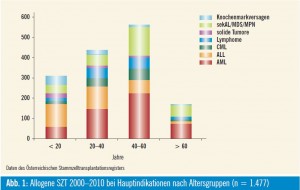 Seit 1978 werden in Österreich Knochenmark- und Blutstammzelltransplantationen (SZT) mit HLA-identen Spendern (allogene SZT) durchgeführt, wobei derzeit akute myeloische und lymphatische Leukämien die Hauptindikation darstellen (Abb. 1). Die Gesamtzahl an SZT im Jahr 2010 setzt sich aus 58 % autologen, 12 % allogenen verwandten und 30 % allogenen unverwandten SZT zusammen (Abb. 2). Die Dauer bis zur Identifizierung eines passenden unverwandten Spenders lag in den vergangenen Jahren bei durchschnittlich 1,7 Monaten, und für rund 85 Prozent aller Patienten konnte ein unverwandter Spender gefunden werden. In den vergangenen Jahren wurde bei Erwachsenen Knochenmark fast vollständig durch G-CSF-mobilisierte Blutstammzellen ersetzt, während bei kindlichen Patienten ca. 35 % aller allogenen SZT weiterhin mit Knochenmark durchgeführt wurden.
Seit 1978 werden in Österreich Knochenmark- und Blutstammzelltransplantationen (SZT) mit HLA-identen Spendern (allogene SZT) durchgeführt, wobei derzeit akute myeloische und lymphatische Leukämien die Hauptindikation darstellen (Abb. 1). Die Gesamtzahl an SZT im Jahr 2010 setzt sich aus 58 % autologen, 12 % allogenen verwandten und 30 % allogenen unverwandten SZT zusammen (Abb. 2). Die Dauer bis zur Identifizierung eines passenden unverwandten Spenders lag in den vergangenen Jahren bei durchschnittlich 1,7 Monaten, und für rund 85 Prozent aller Patienten konnte ein unverwandter Spender gefunden werden. In den vergangenen Jahren wurde bei Erwachsenen Knochenmark fast vollständig durch G-CSF-mobilisierte Blutstammzellen ersetzt, während bei kindlichen Patienten ca. 35 % aller allogenen SZT weiterhin mit Knochenmark durchgeführt wurden.
Allogene SZT mit dosis reduzierter Konditionierung
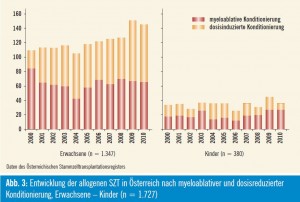 Historisch wurde die Vorbereitung der allogenen SZT mit myeloablativer Chemo- /Radiotherapie durchgeführt, wobei Patienten mit hämatologischen Neoplasien meist eine fraktionierte Ganzkörperbestrahlung von 12 bis 13,2 Gy in Kombination mit hoch dosiertem Cyclophosphamid verabreicht wurde. Seit dem Jahr 1999 können Patienten mit hämatologischen und onkologischen Erkrankungen eine dosisreduzierte Konditionierung im Rahmen der allogenen SZT erhalten. Diese Therapieform ermöglicht damit auch die Durchführung einer SZT bei älteren oder in ihrem Allgemeinbefinden aufgrund von schweren Vorerkrankungen stärker beeinträchtigten Patienten. So wurden in Österreich im Jahr 2010 56 % aller allogenen SZT mit dosisreduzierter Konditionierung durchgeführt (Abb. 3). Die Reduktion der Chemo-/ – Radiotherapie führte zu einer signifikanten Verminderung der Organtoxizitäten und transplantassoziierten Mortalität, und die im Transplantat enthaltenen Immunzellen des Spenders eradizieren neoplastische Erkrankung durch immunmediierte Effekte. Nach temporärer Immundefizienz regenerieren Hämatopoese und Immunsystem vom Spender. Nichtmyeloablative Konditionierungsregime bestehen aus Fludarabin mit niedrig dosierter Ganzkörperbestrahlung mit 2 Gy, dosisreduzierte aus Fludarabin-hältigen Kombinationen von Chemotherapeutika mit und ohne niedrig dosierter Ganzkörperbestrahlung.
Historisch wurde die Vorbereitung der allogenen SZT mit myeloablativer Chemo- /Radiotherapie durchgeführt, wobei Patienten mit hämatologischen Neoplasien meist eine fraktionierte Ganzkörperbestrahlung von 12 bis 13,2 Gy in Kombination mit hoch dosiertem Cyclophosphamid verabreicht wurde. Seit dem Jahr 1999 können Patienten mit hämatologischen und onkologischen Erkrankungen eine dosisreduzierte Konditionierung im Rahmen der allogenen SZT erhalten. Diese Therapieform ermöglicht damit auch die Durchführung einer SZT bei älteren oder in ihrem Allgemeinbefinden aufgrund von schweren Vorerkrankungen stärker beeinträchtigten Patienten. So wurden in Österreich im Jahr 2010 56 % aller allogenen SZT mit dosisreduzierter Konditionierung durchgeführt (Abb. 3). Die Reduktion der Chemo-/ – Radiotherapie führte zu einer signifikanten Verminderung der Organtoxizitäten und transplantassoziierten Mortalität, und die im Transplantat enthaltenen Immunzellen des Spenders eradizieren neoplastische Erkrankung durch immunmediierte Effekte. Nach temporärer Immundefizienz regenerieren Hämatopoese und Immunsystem vom Spender. Nichtmyeloablative Konditionierungsregime bestehen aus Fludarabin mit niedrig dosierter Ganzkörperbestrahlung mit 2 Gy, dosisreduzierte aus Fludarabin-hältigen Kombinationen von Chemotherapeutika mit und ohne niedrig dosierter Ganzkörperbestrahlung.
Akute myeloische Leukämie: Wir führten nichtmyeloablative Stammzelltransplantationen 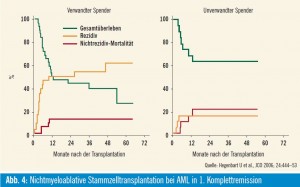 bei 122 Patienten mit akuter myeloischer Leukämie (AML) in Ko-
bei 122 Patienten mit akuter myeloischer Leukämie (AML) in Ko-
operation mit einem internationalen Forschungskonsortium durch (Hegenbart et al., JCO 2006). Lang dauernde hämatopoetische Rekonstitution wurde bei 95 % aller Patienten erzielt. Die Zwei-JahresÜberlebensrate für alle Patienten lag bei 48 % mit krankheitsfreiem Überleben von 44 %. Patienten in erster kompletter Remission (CR) zum Zeitpunkt der allogenen SZT erzielten eine Zwei-JahresÜberlebensrate von 44 % mit einem verwandten sowie 63 % mit einem unverwandten Spender (Abb. 4).
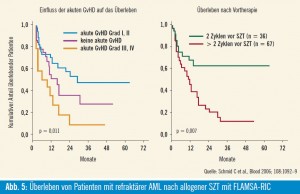
Die Wiener Resultate bei 103 Patienten mit refraktärer AML wurden in Zusammenarbeit mit deutschen SZT-Zentren erarbeitet (Schmid et al., Blood 2006). Nach Verabreichung einer dosisreduzierten Chemo-/Radiotherapie (FLAMSAProtokoll) und prophylaktischer Gabe von Spenderlymphozyten-Infusionen in eskalierter Dosierung wurde eine 4-Jahres- Überlebensrate von 32 % mit leukämiefreiem Überleben von 30 % bei Patienten mit ansonsten infauster Prognose erzielt. Bei Patienten, die mehr als zwei Kurse an konventionell dosierter Chemotherapie vor SZT erhalten hatten, war das Überleben signifikant schlechter, während Patienten nach Auftreten einer milden bis moderaten akuten Graft-versus- Host-Erkrankung (GVHD) einen signifikanten Überlebensvorteil hatten, womit der hochwirksame Graft-versus- Leukämie-Effekt eindrucksvoll klinisch bewiesen werden konnte (Abb. 5).
Multiples Myelom: Kürzlich veröffentlichten wir in Kooperation mit der European Group for Blood and Marrow Transplantation (EBMT) die Langzeitergebnisse einer prospektiv randomisierten Studie mit 357 Myelompatienten (Björkstrand et al., JCO 2011). Nach autologer gefolgt von allogener SZT mit nichtmyeloablativer Konditionierung waren das progressionsfreie Überleben (35 % versus 18 %, p = 0,001), das Gesamtüberleben (65 % versus 58 %, p = 0,047) und die Rezidivraten (49 % versus 78 %, p = 0,003) nach 60 Monaten signifikant besser als nach autologer SZT alleine.
Derzeit werden weltweit randomisierte Studien bei einzelnen Krankheitsentitäten durchgeführt, um den Stellenwert der dosisreduzierten bzw. nichtmyelo – ablativen Konditionierung zur allogenen SZT in Hinblick auf Langzeitüberleben und rezidivfreies Überleben evaluieren zu können. Eine signifikante Reduktion der Organtoxizitäten bei gesicherter hämatologischer Rekonstitution mit Erzielen eines kompletten Spenderchimärismus konnte jedoch bereits in vielen Studien eindrucksvoll demonstriert werden.
Allogene SZT mit Nabelschnurblut
Haben Patienten keinen HLA-identen verwandten Stammzellspender zur Verfügung, sollte umgehend nach einem passenden unverwandten Spender in nationalen und internationalen Spenderregistern gesucht werden. Wird in absehbarer Zeit kein unverwandter Spender gefunden, bei dem zumindest 9/10 HLAMerkmale ident sind, kann die allogene SZT mit allogenem Nabelschnurblut durchgeführt werden. In den vergangenen Jahren konnten durch die Verwendung von zwei Nabelschnurblutpräparaten anstelle von einem der Zeitraum der Aplasie nach SZT sowie das Risiko eines Transplantatversagens deutlich reduziert werden.
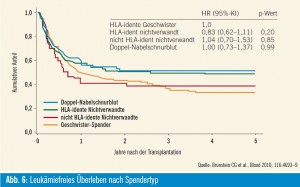 Ein Vergleich verschiedenster Stammzellquellen bei 536 Patienten mit hämatologischen Neoplasien ergab, dass der Zeitraum bis zum Erreichen von mehr als 500 Granulozyten/μl im peripheren Blut bei Patienten nach allogener SZT mit zwei Nabelschnurblutpräparaten signifikant länger war als bei Patienten, die einen unverwandten oder verwandten Stammzellspender hatten (26 vs. 19 vs. 16 Tage, p < 0,01). Das leukämiefreie Überleben nach 5 Jahren war für jeden Spendertyp vergleichbar: 51 % nach zwei Nabelschnurblutpräparaten, 48 % nach HLA-identem unverwandten Spender, 38 % nach HLA-nichtidentem unverwandten Spender und 33 % nach verwandtem Spender (Abb. 6). Das Rezidivrisiko war nach Verwendung von zwei Nabelschnurblutpräparaten am niedrigsten (15 % vs. 35 % nach HLA-nich – tidentem unverwandten Spender versus 37 % nach HLA-identem unverwandten Spender versus 43 % nach HLA-identem verwandtem Spender). Jedoch war auch die Nichtrezidivmortalität nach allogener SZT mit zwei Nabelschnurblutpräparaten höher (34 % vs. 14 % mit HLA-identem unverwandten Spender versus 24 % mit verwandtem Spender) (Brunstein et al., Blood 2010). Langfristig setzt sich nur ein Nabelschnurblutpräparat in Hinblick auf einen Chimärismus aller Zellreihen durch. Nach vorliegenden Ergebnissen ist der Graft-versus-Leukämie-Effekt nach Verwendung von zwei Nabelschnurblutpräparaten intensiver. Damit stellt die allogene SZT mit zwei Nabelschnurblutpräparaten eine sinnvolle und effiziente Therapieoption dar, wenn kein passender verwandter oder unverwandter Stammzellspender zur Verfügung steht.
Ein Vergleich verschiedenster Stammzellquellen bei 536 Patienten mit hämatologischen Neoplasien ergab, dass der Zeitraum bis zum Erreichen von mehr als 500 Granulozyten/μl im peripheren Blut bei Patienten nach allogener SZT mit zwei Nabelschnurblutpräparaten signifikant länger war als bei Patienten, die einen unverwandten oder verwandten Stammzellspender hatten (26 vs. 19 vs. 16 Tage, p < 0,01). Das leukämiefreie Überleben nach 5 Jahren war für jeden Spendertyp vergleichbar: 51 % nach zwei Nabelschnurblutpräparaten, 48 % nach HLA-identem unverwandten Spender, 38 % nach HLA-nichtidentem unverwandten Spender und 33 % nach verwandtem Spender (Abb. 6). Das Rezidivrisiko war nach Verwendung von zwei Nabelschnurblutpräparaten am niedrigsten (15 % vs. 35 % nach HLA-nich – tidentem unverwandten Spender versus 37 % nach HLA-identem unverwandten Spender versus 43 % nach HLA-identem verwandtem Spender). Jedoch war auch die Nichtrezidivmortalität nach allogener SZT mit zwei Nabelschnurblutpräparaten höher (34 % vs. 14 % mit HLA-identem unverwandten Spender versus 24 % mit verwandtem Spender) (Brunstein et al., Blood 2010). Langfristig setzt sich nur ein Nabelschnurblutpräparat in Hinblick auf einen Chimärismus aller Zellreihen durch. Nach vorliegenden Ergebnissen ist der Graft-versus-Leukämie-Effekt nach Verwendung von zwei Nabelschnurblutpräparaten intensiver. Damit stellt die allogene SZT mit zwei Nabelschnurblutpräparaten eine sinnvolle und effiziente Therapieoption dar, wenn kein passender verwandter oder unverwandter Stammzellspender zur Verfügung steht.
Die Auswahl der Nabelschnurblutpräparate für die allogene SZT sollte nach Übereinstimmung der HLA-Merkmale (HLA-A, -B-Antigen und DRB1-Allel) und der vorhandenen Zahl an nukleären Zellen erfolgen, wobei zwischen beiden Nabelschnurblutpräparaten sowie den Präparaten und dem Patienten nicht mehr als zwei Gewebemerkmalsunterschiede bestehen sollten.
Effiziente Prophylaxe und Therapie der Graft-versus-Host-Erkrankung
Die GVHD stellt nach wie vor eine schwere Komplikation nach allogener SZT dar und ist mit signifikant erhöhter Morbidität und Mortalität assoziiert. Routinemäßig werden Calcineurininhibitoren wie Zyklosporin A oder Tacrolimus in Kombination mit Methotrexat oder Mycophenolat Mofetil zur Prophylaxe einer GVHD eingesetzt. In einer prospektivrandomisierten, multizentrischen Phase- III-Studie konnten Finke und Mitarbeiter bei 201 Patienten, die eine myeloablative Konditionierung zur allogenen SZT mit einem HLA-identen unverwandten Spender erhielten, zeigen, dass die zusätzliche Verabreichung von Antithymozytenglobulin (ATG) an den Tagen –3 bis –1 vor SZT zu einer signifikanten Reduktion der akuten GVHD Grad II–IV (33 % vs. 51 %, p = 0,011) sowie zu einer signi fikanten Reduktion der chronischen extensiven GVHD (12,2 % vs. 42,6 %, p < 0,0001) führte.
Neue GVHD-Definition: Eine Konsensus- Konferenz der National Institutes of Health (NIH) der USA erarbeitete unter Mitwirkung unserer Studiengruppe neue Definitionen für die akute und chronische GVHD (Filipovich AH et al., BBMT 2005). Insbesondere wird die akute GVHD in klassische, persistierende, rekurrierende und spät auftretende unterschieden. Für die Diagnose einer chronischen GVHD sind definierte Kriterien und klinische Maßnahmen erforderlich, die bereits an vielen SZT-Zentren routinemäßig etabliert sind (Greinix et al., BBMT 2011). Wir konnten kürzlich in einer prospektiven Studie mit 178 konsekutiven Patienten zeigen, dass Patienten mit chronischer GVHD und Thrombozytopenie oder progressivem Beginn ein signifikant schlechteres Überleben haben (Kuzmina et al., Leukemia 2011). Jedoch hatten Patienten mit chronischer GVHD verglichen mit Patienten ohne GVHD auch ein signifikant niedrigeres Rezidivrisiko (13 % vs. 32 %) und ein verbessertes Überleben (83 % vs. 62 %, p = 0,003), womit der potente Graftversus- Leukämie-Effekt der allogenen SZT eindrucksvoll nachgewiesen werden konnte.
Salvage-Therapie der steroidrefraktären GVHD: Während die anerkannte Erstlinientherapie der akuten GVHD aus Kortison besteht, gibt es aufgrund fehlender Studiendaten keine standardisierte Salvage-Therapie der steroidrefraktären GVHD, die bis zu 60 % aller Patienten betrifft. Der Einsatz von ATG, Antikörpern gegen inflammatorische Zytokine wie Interleukin- 2 oder Tumor-Nekrose-Faktor alpha, mTor-Inhibitoren und Pentostatin bei Patienten mit steroidrefraktärer akuter GVHD ist mit ausgeprägten Nebenwirkungen wie schweren opportunistischen Infektionen, EBV-assoziierten lymphoproliferativen Erkrankungen, Myelosuppression und renaler Toxizität verbunden. Wir führen seit Jahren bei Patienten mit steroidrefraktärer akuter GVHD die extrakorporale Photopherese (ECP) in Kooperation mit der Universitätsklinik für Dermatologie und der Klinischen Abteilung für Transfusionsmedizin durch, auf die 82 % aller Patienten mit akuter GVDHassoziierter Hautbeteiligung sowie 61 % der Patienten mit akuter GVHD-assoziierter Leber- und Darmbeteiligung komplett ansprachen und ein signifikant verbessertes Überleben nach 4 Jahren (59 % versus 11 %, p < 0,0001) hatten (Greinix et al., Haematologica 2006).
Auch in der Therapie der steroidrefraktären chronischen GVHD hat sich die ECP als sehr effizient und sicher mit geringen Nebenwirkungen herausgestellt, sodass die deutsch-österreichisch-schweizerische Studiengruppe zur chronischen GVHD, der auch wir angehören, die ECP als sehr wirksam in der Zweitlinientherapie der chronischen GVHD einstufte (Wolff et al., BBMT 2011). Es sollten jedoch dringlich weitere prospektive Studien durchgeführt werden, um das Therapieansprechen von Patienten mit GVHD zu verbessern, denn nur dadurch kann deren Langzeitüberleben mit guter Lebensqualität gewährleistet werden.
Zusammenfassung
Die allogene SZT stellt eine wirksame, kurative Therapieoption für Patienten mit ausgewählten hämatologischen und onkologischen Erkrankungen dar. In den vergangenen Jahren konnten entscheidende Fortschritte bei der Reduktion der transplantassoziierten Morbidität und Mortalität durch die Anwendung dosisreduzierter Konditionierungsregime, durch verbesserte Supportivtherapiemaßnahmen und eine verbesserte Spenderauswahl erzielt werden. Die allogene SZT ermöglicht eine effiziente und lang dauernde Eradizierung von neoplastischen Erkrankungen. Eine Separationsmöglichkeit der Graft-versus-Host-Erkrankung vom Graft-versus-Leukämie- Effekt wäre jedoch wünschenswert, um die transplantassoziierte Morbidität weiter zu reduzieren und die wirksame Elimination maligner Erkrankung sicherzustellen.
FACT-BOX
• Die allogene SZT ist eine kurative Therapieoption für Patienten mit hämatologischen und onkologischen Erkrankungen.
• Akute Leukämien stellen derzeit die Hauptindikation für eine allogene SZT dar.
• Bei Erwachsenen haben G-CSF-mobilisierte Blutstammzellen Knochenmark als Stammzellquelle weitgehend ersetzt.
• Mittels dosisreduzierter oder nichtmyeloablativer Konditionierung konnte die transplantassoziierte Morbidität und Mortalität signifikant reduziert werden.
• Bei fehlendem verwandten oder unverwandten Stammzellspender ist die allogene SZT mit zwei Nabelschnurblutpräparaten eine wirksame und sinnvolle Therapieoption.
• Die Graft-versus-Host-Erkrankung stellt eine schwere Komplikation der allogenen SZT dar.
• Extrakorporale Photopherese ist eine effiziente und sichere Therapie der steroidrefraktären akuten und chronischen GVHD.
• Eine Separationsmöglichkeit der Graft-versus- Host-Erkrankung vom Graft-versus- Leukämie-Effekt wäre wünschenswert.
Literatur:
– Hegenbart U et al., Treatment for acute myelogenous leukemia by lowdose, total-body, irradiation-based conditioning and hematopoietic cell transplantation from related and unrelated donors. J Clin Oncol 2006; 24:444–453
– Schmid C et al., Long-term survival in refractory acute myeloid leukemia after sequential treatment with chemotherapy and reduced-intensity conditioning for allogeneic stem cell transplantation. Blood 2006; 108:1092–1099
– Björkstrand B et al., Tandem autologous/reduced-intensity conditioning allogeneic stem-cell transplantation versus autologous transplantation in myeloma: long-term follow-up. J Clin Oncol 2011; 29:3016–3022
– Brunstein CG et al., Allogeneic hematopoietic cell transplantation for hematologic malignancy: relative risks and benefits of double umbilical cord blood. Blood 2010; 116:4693–4699
– Finke J et al., Standard graft-versus-host disease prophylaxis with or without anti-T-cell globulin in haematopoietic cell transplantation from matched unrelated donors: a randomised, open-label, multicentre phase 3 trial. Lancet Oncol 2009; 10:855–864
– Filipovich AH et al., National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease. I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005, 11:945–956
– Greinix HT et al., Diagnosis and staging of chronic graft-versus-host disease in the clinical practice. Biol Blood Marrow Transplant 2011; 17:167–175
– Kuzmina Z et al., Significantly worse survival of patients with NIH-defined chronic graft-versus-host disease and thrombocytopenia or progressive onset type: results of a prospective study. Leukemia Sept 16 doi: 10.1038/leu.2011.257 epublished ahead of print.
– Greinix HT et al., The effect of intensified extracorporeal photochemotherapy on long-term survival in patients with severe acute graft-versushost disease. Haematologica 2006; 91:405–408
– Wolff D et al., Consensus conference on clinical practice in chronic GVHD: Second-line treatment of chronic graft-versus-host disease. Biol Blood Marrow Transplant 2011; 17:1–17