„Unsterblichkeit“ von Tumorstammzellen?
CSC zeichnen sich durch eine nahezu unbegrenzte Fähigkeit zur Proliferation und Selbsterneuerung aus, die therapeutisch nur schwer überwunden werden kann. Ein Grund dafür ist, dass die Regulation der Zellproliferation durch ein komplexes molekulares Netzwerk gesteuert wird, das unter anderem auf Signaltransduktion und Chromatin-Modifikation sowie epigenetischen Mechanismen basiert. Vor allem die Signaltransduktionsmoleküle sind beliebte Angriffsziele für so genannte zielgerichtete Krebsmedikamente. Weitere wichtige Angriffspunkte bieten bestimmte Oberflächen- Moleküle, vor allem wenn diese vorzugsweise auf Tumorstammzellen oder Leukämie-Stammzellen (LSC) zur Expression kommen.
Im Forschungscluster Ludwig-Boltzmann- Cluster Oncology, LB-CO, wurden vor Kurzem etliche interessante Zielstrukturen in leukämischen Stammzellen entdeckt. Beispielsweise konnte kürzlich im Rahmen von LB-CO-Projekten gezeigt werden, dass leukämische Stammzellen in der akuten und chronischen myeloischen Leukämie (AML, CML) die Targetantigene CD33 und CD52 exprimieren. In der AML wurde vor allem auch untersucht, welche „Heat-Shock-Proteine“ (HSP) in den leukämischen Stammzellen zur Expression kommen, da diese Proteine ganz besonders zum Überleben und zur Resistenz der Stammzellen beitragen. In diesen Studien konnte der LBCO vor Kurzem zeigen, dass das HSP 32 in den AML-Stammzellen zur Expression kommt und als Überlebensmolekül und Resistenzantigen fungiert.
MYC-Onkogen, BRD4 und JQ1: Ein zentrales Steuerungsmolekül, das kontinuierliches Wachstum und Unsterblichkeit von Tumorzellen vermittelt, ist das Onkogen MYC. Für die Synthese des MYC-Onkoproteins ist eine Anzahl von zum Teil unbekannten Regulatoren verantwortlich, inklusive bestimmter chromatinmodifizierender Moleküle. Bereits im Jahr 1987 konnte mittels In-situ-Hybridisierung nachgewiesen werden, dass sich das humane Papillomavirus 18 bei den bereits erwähnten HeLa-Zellen exakt
in jene Region des Chromosoms 8 eingenistet hat, in der sich das MYC-Onkogen befindet, und auf diese Weise zu einer Aktivierung dieses Gens beiträgt, was wahrscheinlich eine zentrale Rolle für die „Unsterblichkeit“ dieser Zellen spielt (Ambros and Karlic, 1987).
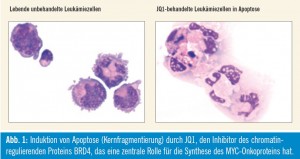
Wissenschaftler in den USA haben gezeigt, dass das chromatinregulierende Protein BRD4 die Synthese von MYC in leukämischen Zellen steuert und deshalb eine viel versprechende Zielstruktur für die Leukämietherapie darstellt. Die Arbeiten an humanen AML-Zellen wurden zum Teil in Kooperation mit dem Ludwig- Boltzmann-Cluster Oncology durchgeführt und im Fachjournal Nature gemeinsam mit einer internationalen Arbeitsgruppe publiziert (Zuber et al., 2011). Die BRD4-blockierende Substanz JQ1, die bereits als Modellsubstanz zur Entwicklung neuer antileukämischer Medikamente gehandelt wird, inaktiviert in diesen Zellen das MYC-Onkogen und löst auf diese Weise in den Leukämiezellen einen Wachstumsstopp und den gerichteten Zelltod (Apoptose) aus (Abb. 1). In einem weiteren Schritt ist es nun Mitarbeitern des LB-CO gelungen, nachzuweisen, dass auch die Stammzellen der AML BRD4 exprimieren, und dass JQ1 auch in diesen Zellen die Apoptose auslösen kann.
Zur Bedeutung und Pathogenese der AML
Die akute myeloische Leukämie (AML) ist eine Leukämie, deren Entstehung aus Stammzellen bereits sehr gut dokumentiert ist. Ein Charakteristikum dieser Erkrankung ist die unkontrollierte Proliferation und Anhäufung von Myeloblasten in blutbildenden Geweben. Der klinische Verlauf und die Prognose der AML variiert, je nachdem, welche Gene bzw. welche Zelltypen betroffen sind und welche biologischen Eigenschaften die entstehenden Klone aufweisen. In den meisten Varianten der AML stellt die Komplexität und Heterogenität des „Onkogenoms“ eine besondere Herausforderung für die Entwicklung effizienter Therapiekonzepte dar. Eine interessante Tatsache ist dabei, dass dieselben biologischen Funktionen einer Zelle durch verschiedenste genetische Aberrationen in ähnlicher Weise beeinträchtigt werden können: Ein Beispiel dafür ist die wiederkehrende Störung der normalen Differenzierungsprogramme in den Leukämiestammzellen (LSC), die sich im Gegensatz zu normalen Stammzellen ständig unkontrolliert „selbsterneuern“. Strategien, die darauf abzielen, diesen Selbsterneuerungsprozess zu beenden und auf diese Weise die LSC zu vernichten, sind daher von zentraler Bedeutung für die Entwicklung von effizienteren (kurativen) Therapien der AML.
Angesichts der zentralen Bedeutung epigenetischer Parameter für die Entstehung von Krebserkrankungen wurden systematisch Gene analysiert, die im Inneren des Zellkerns – in der epigenetisch gesteuerten „Maschinerie“ der Genregulation (Chromatin) – eine Rolle spielen.
Entdeckung und Entwicklung von BRD4 als therapeutische Zielstruktur
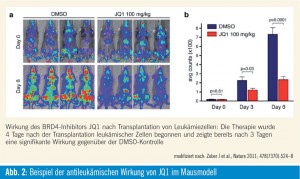 Zunächst wurde im Tiermodell mittels einer neuen Technologie, der so genannten RNA-Interferenz (RNAi), systematisch nach epigenetischen Schwachstellen der Leukämie gesucht. Durch diesen Screen wurde das Regulatorgen BRD4 als eine viel versprechende Zielstruktur für die Therapie der AML entdeckt. Eine Hemmung von BRD4 mittels RNAi oder dem molekularen Inhibitor JQ1 blockierte die Bindung von BRD4 an wichtige regulatorische Elemente des Chromatins (azetylierte Histone) und induzierte auf diese Weise eine antileukämische Wirkung in allen getesteten AML-Modellen der Maus, in allen untersuchten humanen Leukämie-Zelllinien (n = 8) sowie in primären AML-Zellen (Abb. 2). In diesen Modellen bewirkte die BRD4-Hemmung sowohl den programmierten Zelltod (Apoptose) als auch eine gewisse (oft signifikante) myeloische Differenzierung und unterdrückte somit die wichtigsten Stammzelleigenschaften in diesen Zellen. Einer der wichtigsten Effekte war eine Hemmung der Transkription des MYC-Onkogens, das eine zentrale Rolle für die Persistenz der LSC spielt.
Zunächst wurde im Tiermodell mittels einer neuen Technologie, der so genannten RNA-Interferenz (RNAi), systematisch nach epigenetischen Schwachstellen der Leukämie gesucht. Durch diesen Screen wurde das Regulatorgen BRD4 als eine viel versprechende Zielstruktur für die Therapie der AML entdeckt. Eine Hemmung von BRD4 mittels RNAi oder dem molekularen Inhibitor JQ1 blockierte die Bindung von BRD4 an wichtige regulatorische Elemente des Chromatins (azetylierte Histone) und induzierte auf diese Weise eine antileukämische Wirkung in allen getesteten AML-Modellen der Maus, in allen untersuchten humanen Leukämie-Zelllinien (n = 8) sowie in primären AML-Zellen (Abb. 2). In diesen Modellen bewirkte die BRD4-Hemmung sowohl den programmierten Zelltod (Apoptose) als auch eine gewisse (oft signifikante) myeloische Differenzierung und unterdrückte somit die wichtigsten Stammzelleigenschaften in diesen Zellen. Einer der wichtigsten Effekte war eine Hemmung der Transkription des MYC-Onkogens, das eine zentrale Rolle für die Persistenz der LSC spielt.
Um die Hemmung von BRD4 als potenziellen therapeutischen Ansatz zur Vernichtung von LSC in der AML zu evaluieren, testeten Mitarbeiter des LB-CO die Wirkung von JQ1 auf primäre AML-Zellen in 17 PatientInnen mit frisch diagnostizierter oder therapieresistenter AML (5 Frauen, 12 Männer, medianes Alter 54 Jahre; Range: 21–80 Jahre). In den primären Zellen der AML konnte bereits mit sehr geringen Mengen JQ1 eine deutliche Wachstumshemmung erzielt werden (IC50 0,05–0,5 μM). Die Anwesenheit von wachstumsstimulierenden Faktoren (Zytokine wie G-CSF, IL-3 oder SCF) spielte dabei keine Rolle. Weiters induzierte JQ1 sehr effizient die Apoptose in den Leukämiezellen der PatientInnen, wobei die Wirkung von JQ1 unabhängig vom Krankheitsstatus (frisch diagnostiziert oder therapieresistent) war.
In einem zweiten Schritt wurde die Wirkung von JQ1 auf AML LSC getestet. Es konnte dabei gezeigt werden, dass JQ1 nicht nur Vorläuferzellen (CD34+/CD38+), sondern auch unreife Stammzellen (CD34+/CD38–) der AML in die Apoptose treiben kann. Außerdem induzierte JQ1 in 6 von 7 PatientInnen eine Ausreifung der Leukämiezellen, womit die Beobachtungen im Tiermodell grundsätzlich bestätigt wurden. Schließlich konnte auch noch gezeigt werden, dass JQ1 synergistisch mit ARA-C, einem effektiven Chemotherapeutikum, das in der AML-Therapie sehr häufig eingesetzt wird, eine Wachstumshemmung in den Leukämiezellen hervorrufen kann.
Zusammenfassend kann daher festgestellt werden, dass man mit der molekularen Hemmung von BRD4 einen ausgeprägten antileukämischen Effekt in zahlreichen AML-Varianten erzielen kann, wobei der Wirkung von JQ1 auf die LSC eine besondere Bedeutung zukommt. Der Nachweis des Brd4 in der (AML) und deren Stammzellen durch das LBCO ist somit ein möglicher weiterer Schritt zur Optimierung der AML-Therapie. Ein Teil der Forschungsergebnisse wurde vor Kurzem in der Fachzeitschrift „Nature“ publiziert (Zuber et al., 2011), zum Teil sind die Daten zur Publikation eingereicht und werden auf diversen Kongressen präsentiert.
Zelluläre Umgebung von Tumorstammzellen
Systemische Modelle der Kanzerogenese messen der zellulären Umgebung von (potenziellen) Tumorzellen generell eine große Bedeutung für Selektionsprozesse in Richtung „Unsterblichkeit“ bei und beziehen immer mehr Aspekte ein, welche sich aus der intra- und interzellulären molekularen Kommunikation ergeben.
Ein Beispiel dafür findet sich in einer aktuellen Ausgabe der Zeitschrift „Nature“: Die Autoren konnten zeigen, dass der von Hautkrebszellen freigesetzte Wachstumsfaktor VEGF (vascular endothelial growth factor) nicht nur die Blutzufuhr (Angiogenese) zum Tumor stimuliert, sondern in autokriner Manier auch die Selbsterneuerungsfähigkeit der Stammzellen aufrecht erhält. Mit einer Blockade des VEGF könnte man also „zwei Fliegen auf einen Schlag“ treffen, nämlich die Stammzellen parakrin „aushungern“ und gleichzeitig auch autokrin den Sterbeprozess beschleunigen (Beck et al., 2011).
Die immanente Bedeutung der zellulären Umgebung von Tumorstammzellen wird auch dadurch verdeutlicht, dass eine isolierte In-vitro-Kultur dieser Zellen nicht möglich ist. Auch bei der Transplantation von Tumorstammzellen in immunsupprimierte Mäuse müssen Substanzen zugegeben werden, die das so genannte „Homing“ also das Einnisten in diverse Nischen, fördern. Alle diese Befunde machen also deutlich, dass systemische Aspekte bei der Behandlung unbedingt einbezogen werden müssen, wenn man die Tumorstammzellen vernichten will und die Genese neuer Tumorstammzellen aus differenzierteren Tumorzellen oder (normalen) Vorstufenzellen nachhaltig verhindern will.
FACT-BOX
Strategien zur ständigen Selbsterneuerung und zum langfristigen Überleben von Tumorstammzellen, möglicherweise aber auch von differenzierteren (Tumor-)Zellen, aus denen unter bestimmten Bedingungen Tumorstammzellen hervorgehen können, sind:
• Ruhephasen – oft in Kontakt mit der Stammzell-Nische
• das Potenzial zur Veränderung des Phänotyps (Plastizität)
• genetische und epigenetische Veränderungen von Onkogenen und Tumorsuppres – sorgenen
• Mechanismen zur Entwicklung von Therapieresistenz
Literatur:
– Ambros PF, Karlic HI, Chromosomal insertion of human papillomavirus 18 sequences in HeLa cells detected by nonisotopic in situ hybridization and reflection contrast microscopy. Hum Genet 1987; 77:251–254
– Beck B, Driessens G et al., A vascular niche and a VEGF-Nrp1 loop regulate the initiation and stemness of skin tumours. Nature 2011; 478:399–403
– Hyman AH, Simons K, The new cell biology: Beyond HeLa cells. Nature 2011; 480:34
– Skloot R, 2010; Die Unsterblichkeit der Henrietta Lacks. irisiana-verlag.
– Zuber J, Shi J et al., Nature 2011; 478(7370):524–8