Entstehung von Tumorstammzellen: Bedeutung von Umweltfaktoren, Ernährung, DNA-Reparatur-Enzymen und Epigenetik
DNA-Reparatur-Mechanismen
So wie das Immunsystem den Organismus vor schädlichen Einflüssen schützt, können die DNA-Reparatur-Maschinerien viele Arten von Schäden aufspüren und haben sehr unterschiedliche Möglichkeiten zur Wiederstellung der normalen Funktion. Die Stimulation oder Regulierung der DNA-Reparatur kann als Therapie gegen Krankheiten gesehen werden.
In Säugetierzellen ist das Mismatch-Repair- System (MMR-System) für die Korrektur von Fehlern während der DNA-Replikation zuständig. Zusätzlich zur „Proof – reading“-Funktion hat sich gezeigt, dass es an der Reparatur oder Beseitigung von oxidativen DNA-Schäden beteiligt ist. Dies beinhaltet auch Chemikalien wie Alkylierungsmittel, Cisplatin und 5-Fluorouracil. MLH1 und MSH2 sind die häufigsten MMR-Proteine, die mit MMRMangel in Zusammenhang gebracht werden. MMR-Gene (MSH2, MSH3, MSH6, MLH1, MLH3, PMS1, PMS2) werden durch Hypermethylierung ihres Promotors, also des Steuerungsbereiches der betreffenden Gene inaktiviert.
Die O-6-Methylguanin-DNA-Methyltrans – ferase (MGMT) ist ein „Suicidal DNA Repair“- Protein, das Alkylierungen an der DNA entfernt und damit die Transkription der betroffenen Gene wieder ermöglicht. Das MGMT-Enzym wird dabei alkyliert und kann nicht mehr recycelt werden. Es muss ständig synthetisiert werden.
Eine gesunde Zelle antwortet auf DNASchäden mit einer adäquaten Expression von DNA-Repair-Enzymen und befindet sich somit im genotoxischen Gleichgewichtszustand (steady state). Wird dieser genotoxische steady state gestört, steigt das Krebsrisiko dramatisch an.
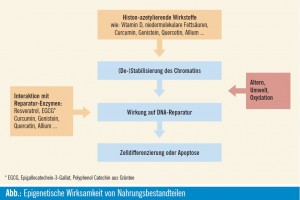
Zwei komplementäre Forschungsansätze beschäftigen sich mit möglichen Steuerungsmechanismen von DNA-Reparatur- Enzymen (Hegi et al., 2009). Wege und Möglichkeiten, DNA-Schäden zu vermeiden bzw. eingetretene Schäden zu beheben, sind Ziele molekularer Forschung, pharmazeutischer, kosmetischer Anstrengungen und ein wichtiger Bestandteil von Ernährungsstrategien (Abb.). In der Krebstherapie ist das Bestreben groß, eine adjuvante Therapie für alle Krebspatienten anzubieten, die Tumorstammzellen daran hindert, durch Zytostatika hervorgerufene DNA-Schäden zu reparieren. Neue Erkenntnisse aus der epigenetischen Forschung bieten Ansätze über die Beeinflussung epigenetisch wirksamer Enzyme, über Prävention und DNA-Reparatur.
Ernährung und Epigenetik
Epigenetisch wirksame Substanzen und im Speziellen DNA-methylierende Agentien können endogenen Ursprungs sein, wobei insbesondere von Darmbakterien produzierte, aber auch exogen mit der Nahrung zugeführte niedermolekulare Fettsäuren eine Rolle spielen. Ernährungsgewohnheiten und Lebensstil prägen also das Mikrobiom nachhaltig und damit auch die Produktion epigenetisch wirksamer Substanzen (Goncalves et al., 2011).
CpG-Methylierungen in der Promotorregion diverser DNA-Reparatur-Gene können die Transkription und somit die Expression dieser Gene inhibieren und damit den genotoxischen steady state aus dem Gleichgewicht bringen. Ernährung und Lebensstil spielen an dieser Stelle eine doppelte Funktion, denn einerseits können sie DNA-Schäden beeinflussen und andererseits das Epigenom verändern. Studien haben gezeigt, dass eine Ernährung, die reich an Antioxidanten wie Vitamin C und E sowie Carotinoiden und Flavonoiden ist, die oxidativen DNASchäden verringern kann (Collins et al., 2003).
Für die epigenetische Regulation der Genexpression spielen pflanzliche Nahrungsbestandteile wie Polyphenole (z. B. aus roten Früchten), organische Schwefel- und Selenverbindungen (z. B. aus Zwiebelgewächsen) oder Isothiocyanate und Indole (z. B. aus Kohlgewächsen) eine eminente Rolle (Rajendran et al., 2011), aber auch das – vor allem mit Hilfe des Sonnenlichts synthetisierte – Vitamin D (Karlic & Varga, 2011).
Mehrere mit der Nahrung zugeführte Verbindungen sind direkt an der Regulation von DNA-Methylierungen beteiligt. Vitamin B12 ist ein Cofaktor in der folatvermittelten Remethylierung von Homo – cystein zu Methionin. Es wird weiter zu S-Adenosylmethionin aktiviert (SAM), das als Methylspender für die DNA-Methylierung wirkt. SAM wird nach der DNA-Methylierung zu S-Adenosylhomocystein (SAH) umgewandelt. Mit der reversiblen Hydrolyse von SAH zu Homocystein schließt sich der Kreis. Bei erhöhter Homocysteinkonzentration wird diese Reaktion rückgängig gemacht, was zu einer erhöhte Konzentration des potenten SAM-Inhibitors SAH führt. Ein Mangel an Vitamin B12 führt zu einer Akkumulation von Serum-Homocystein (Thaler et al., 2009).
FACT-BOX
- Substanzen, die das Erbgut schädigen, sind einerseits ein entscheidender Faktor für die Entstehung von Krebserkrankungen, andererseits reagieren Tumorzellen meist auch empfindlicher auf Schädigungen der DNA und deren Reparaturmechanismen.
- Die Epigenetik – vor allem der Methylierungsstatus der DNA und die Stabilität des Chromatins – ist wichtig für die Stabilisierung des Genoms.
- Von Darmbakterien produzierte Substanzen wie niedermolekulare Fettsäuren und vor allem pflanzliche Nahrungsbestandteile wie Polyphenole (z. B. aus roten Früchten), organische Schwefel- und Selenverbindungen (z. B. aus Zwiebelgewächsen) oder Isothiocyanate und Indole (z. B. aus Kohlgewächsen), aber auch Vitamin D wirken über (epi)genetische Mechanismen und können einerseits chemopräventiv die Entstehung von Tumorstammzellen verhindern, andererseits als Radio- bzw. Chemosensitizer die Therapie von Krebserkrankungen unterstützen.
Literatur:
– Bingham, SA et al., Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet 2003; 361:1496–501
– Collins AR et al., Nutritional modulation of DNA repair in a human intervention study. Carcinogenesis 2003; 24:511–15
– Goncalves P et al., The short-chain fatty acid butyrate is a substrate of breast cancer resistance protein. American Journal of Physiology-Cell Physiology 2011; 301:C984–C994
– Hegi ME et al., Epigenetic deregulation of DNA repair and its potential for therapy. Clin Cancer Res 2009; 15:5026–31
– Karlic H et al., Impact of vitamin D metabolism on clinical epignetics. Clinical Epigenetics 2011; 2:55–61
– Rajendran P et al., Dietary phytochemicals, HDAC inhibition, and DNA damage/repair defects in cancer cells. Clinical Epigenetics 2011; 3:4 (open access online)
– Thaler R, Karlic H, Rust P, Haslberger AG, Epigenetic regulation of human buccal mucosa mitochondrial superoxide dismutase gene expression by diet. Br J Nutr 2009; 101:743–9