Adjuvante oder Salvage-Radiotherapie nach radikaler Prostatektomie?
Mehrere Studien haben gezeigt, dass eine (adjuvante) Strahlentherapie nach radikaler Prostatektomie bei Patienten mit ungünstigen histopathologischen Ergebnissen das Risiko für ein biochemisches Rezidiv senken kann. Es existieren allerdings keine prospektiven Daten randomisiert-kontrollierter Studien, die eine Aussage darüber zulassen, ob in solchen Fällen eine sofortige, adjuvante Strahlentherapie notwendig ist oder auch eine verzögerte, sogenannte „Salvage“-Strahlentherapie vergleichbar gute Ergebnisse erzielt.
Hintergrund: Die Mehrheit der Männer, die wegen eines lokal begrenzten Prostatakarzinoms mittels radikaler Prostatektomie behandelt werden, wird kein (biochemisches) Rezidiv erleiden, so dass keine weitere Therapie, z. B. im Sinne einer Nachbestrahlung notwendig ist. Mit lokal fortschreitendem Tumorwachstum steigt jedoch das Risiko eines (bei Infiltration der Samenblasen sogar auf etwa 75–80 %1) biochemischen Rezidives (Anstieg des Prostataspezifischen Antigens [PSA] auf > 0,2 ng/ml). Dieses Risiko wird im Wesentlichen von Tumorstadium (Infiltration des periprostatischen Fettgewebes und/oder der Samenblasen) und dem chirurgischem Absetzungsrand bestimmt.2
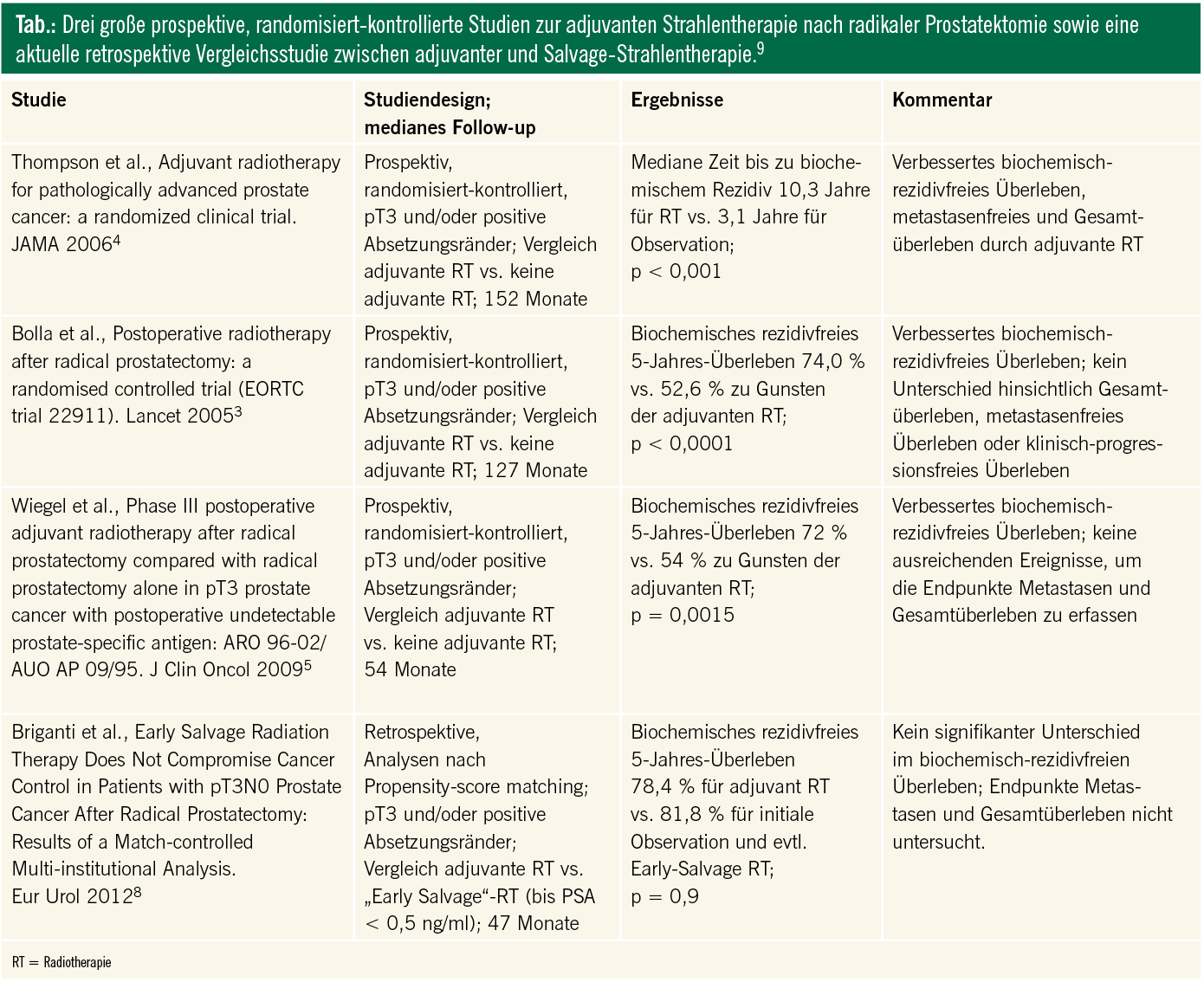
Unumstritten führt eine additive Therapie im Sinne einer adjuvanten Bestrahlung bei anderen Tumorentitäten wie bei kolorektalen Tumoren oder aber dem Mammakarzinom zu einer signifikanten Reduktion des Rezidivrisikos. In drei prospektiv randomisiert kontrollierten Studien konnte auch für das Prostatakarzinom gezeigt werden, dass durch die Anwendung einer adjuvanten, also unmittelbar nach Operation stattfindenden Strahlentherapie das Risiko für ein biochemisches Rezidiv um 50–60 % gesenkt werden kann (Tab.).3–5
Beim Prostatakarzinom steht dem betreuenden Arzt mit dem PSA-Test ein sehr sensitives Instrument in der Nachsorge nach Lokaltherapie zur Verfügung. Die Erhöhung des PSA-Wertes nach Prostatektomie geht einer systemischen Metastasierung im Mittel um 8 Jahre voraus. Aufgrund dieser sehr langen „lead-time“ ist ein steigender PSA-Wert nicht mit Metastasierung und Tod (viele Männer versterben zuvor aus anderer Ursache) gleichzusetzen. Umgekehrt kann jedoch festgestellt werden, dass PSA-Negativität postoperativ mit Heilung gleichzusetzen ist. Dies ist deswegen von Bedeutung, da ein hoher Anteil der Patienten trotz ungünstigem histopathologischen Befundes kein biochemisches Rezidiv erleidet. Würde man zur Verbesserung der Prognose jeden Risikopatienten pauschal nachbestrahlen, würde Übertherapie und somit unnötige therapieassoziierte Morbidität wie Verschlechterung der Urinkontinenzsituation, Potenz oder strahlenbedingter Proktitis resultieren. Und gerade vor dem Hintergrund möglicher strahlentherapieassoziierter Komplikationen und Nebenwirkungen ist es nicht einhelliger Konsens, dass jeder Mann mit ungünstigem histopathologischen Befund einer adjuvanten Strahlentherapie zugeführt werden sollte.
Studienlage
In einer detaillierten Studie von van der Kwast und Kollegen, die 2007 im Journal of Clinical Oncology veröffentlicht wurde, wurden die histopathologischen Präparate von 552 Patienten des EORTC Trial 22911 zentral nachuntersucht.2 Ziel dieser Studie war es, nochmals detailliert herauszuarbeiten, bei welchen Risikofaktoren (Infiltration des periprostatischen Fettgewebes mit/ohne positivem Absetzungsrand, Samenblaseninfiltration etc.) am ehesten ein positives Ansprechen einer adjuvanten Strahlentherapie zu erwarten ist. Im Rahmen dieser Arbeit hat sich gezeigt, dass besonders Männer mit positivem Absetzungsrand einen signifikanten Benefit haben, nahezu unabhängig vom Tumorstadium.2 Allerdings findet sich auch hier keine Antwort auf die Frage nach dem besten Zeitpunkt der Strahlentherapie, Therapieeffekt und Nebenwirkungen berücksichtigend. Gemäß den Richtlinien der European Urological Asscoiation (EAU) kommen sowohl eine unverzügliche, adjuvante als auch eine verzögerte, PSA-gesteuerte Nachbestrahlung in Betracht. Beide Optionen sollten mit den Patienten diskutiert werden.6
Eine verzögerte, PSA-gesteuerte Salvage-Therapie stellt also auch Leitlinien zufolge eine Alternative zu einer unmittelbaren, adjuvanten Strahlentherapie dar. Eine solche „Salvage“-Strahlentherapie würde erst bei einem PSA-Anstieg im Verlauf der Nachsorge bei zuvor nicht nachweisbarem PSA-Wert nach radikaler Prostatektomie erfolgen. Der Vorteil eines solchen, abwartenden Managements liegt auf der Hand, da hierbei nur diejenigen Patienten eine Bestrahlungstherapie erhielten, bei denen ein biochemisches Rezidiv nachgewiesen wurde, und somit das Risiko einer metastatischen Progression besteht.
Allerdings gibt es bisher keine Ergebnisse prospektiver Studien, welche die Effektivität von adjuvanter und Salvage-Strahlentherapie nach radikaler Prostatektomie prospektiv, randomisiert-kontrolliert verglichen hätten. Daher lässt sich die Frage, ob eine der beiden Therapieoptionen der anderen überlegen oder ebenbürtig ist, anhand der derzeitigen Datenlage nicht eindeutig beantworten.
Kürzlich wurde von einer internationalen, multiinstitutionalen Arbeitsgruppe eine retrospektive Studie veröffentlicht, in deren Rahmen adjuvante und Salvage-Strahlentherapie miteinander verglichen wurden. Untersucht wurden Daten von Männern mit klinischem Hochrisiko-Prostatakarzinom entsprechend der Risikoeinteilung nach D’Amico7, die allesamt primär mittels radikaler Prostatektomie behandelt wurden. Im Rahmen dieser Studie konnte kein signifikanter Unterschied hinsichtlich des Risikos eines biochemischen Rezidivs zwischen Patienten gezeigt werden, die entweder eine adjuvante Strahlentherapie erhielten, und denen, die entweder gar nicht bestrahlt wurden oder nur im Falle eines PSA-Anstiegs einer Salvage-Strahlentherapie zugeführt wurden. Dabei ist wichtig zu beachten, dass die Patienten mit Salvage-Strahlentherapie alle einen PSA-Wert <0,5ng/ml zum Beginn der Strahlentherapie aufwiesen im Sinne einer „Early-Salvage“-Therapie.7 Im Rahmen dieser Studie von Briganti und Kollegen wurden 2- und 5-Jahres-PSA-Rezidivfreiheitsraten für eine adjuvante Strahlentherapie von 91,4 % und 78,4 % berichtet sowie 92,8 % und 81,8 % für Männer, die einen PSA-kontrollierten Verlauf hatten und ggf. bei einem PSA-Anstieg nachbestrahlt wurden.8
Diese Ergebnisse lassen die Annahme zu, dass ein zunächst abwartender, PSA-kontrollierter Verlauf nach radikaler Prostatektomie bei Patienten mit pT3a/pT3b-Tumoren und/oder positiven Absetzungrändern zu vergleichbaren Ergebnissen hinsichtlich der Rezidivfreiheit führt wie eine unmittelbare, adjuvante Strahlentherapie. Dabei ist entscheidend, dass vergleichbare Ergebnisse nur dann erreicht werden, sofern eine Salvage-Strahlentherapie frühzeitig, d. h. bei einem PSA < 0,5 ng/ml eingeleitet wird.8
Zum gegenwärtigen Zeitpunkt sind noch keine Ergebnisse von prospektiven randomisiert-kontrollierten Studien verfügbar, die direkt eine adjuvante Strahlentherapie mit einer Salvage-Strahlentherapie vergleichen. Allerdings laufen aktuell solche prospektiven Studien:
- „Triptorelin and Radiation Therapy in Treating Patients Who Have Undergone Surgery for Intermediate-Risk Stage III or Stage IV Prostate Cancer“, ClinicalTrials.gov identifier: NCT00667069
- „Radiotherapy and Androgen Deprivation In Combination After Local Surgery“ (RADICALS), ClinicalTrials.gov identifier: NCT00541047
- „Postoperative or Salvage Radiotherapy for Node Negative Prostate Cancer Following Radical Prostatectomy“, ClinicalTrials.gov identifier: NCT00969111
- „Radiotherapy Adjuvant Versus Early Salvage (RAVES)“, ClinicalTrials.gov identifier: NCT00860652
Die Ergebnisse dieser Arbeiten dürfen mit Spannung erwartet werden.
1 Pierorazio PM et al., J Urol 2011; 185:1691–7
2 Van der Kwast TH et al., J Clin Oncol 2007; 25:4178–86
3 Bolla M et al., Lancet 2005; 366:572–8
4 Thompson IM Jr. et al., JAMA 2006; 296:2329–35
5 Wiegel T et al., JCO 2009; 27:2924–30
6 Heidenreich A et al., Eur Urol 2011; 59:61–71
7 D’Amico AV et al., JAMA 1998; 280:969–74
8 Briganti A et al., Eur Urol 2012; 62:472–87
9 Stephenson AJ et al.,. Eur Urol 61:443–51, 2012