Management von PCa-Patienten mit positiven lokoregionalen Lymphknoten
Über die Definition des lokal fortgeschrittenen Prostatakarzinoms (PCa) gibt es unter den Experten keinen Konsens. Manche reduzieren diese auf T3- (die Organkapsel-Überschreitung und/oder Samenblaseninvasion) oder T4-Tumoren (Invasion von angrenzenden Organen/Gewebe) ohne Lymphknotenbefall (LK-Befall), während andere auch das lymphknotenpositive Stadium (N+) in diese Definition inkludieren1. Solche Unstimmigkeiten erstrecken sich auch auf das Behandlungsmanagement bei N+-PCa-Patienten.
Patienten mit lokalisierter Erkrankung werden üblicherweise mit einer auf die Prostata beschränkten Therapie behandelt, Patienten mit fortgeschrittener Erkrankung erhalten meist eine Kombinationstherapie, basierend auf der geringen Wahrscheinlichkeit einer vollständigen Eliminierung des Karzinoms mit einer singulären Therapiemodalität. Patienten mit metastasierter Erkrankung werden mit systemischen Therapien behandelt2.
Staging-Systeme und Nomogramme erleichtern diese Entscheidungen und dienen der Verminderung der eventuellen Behandlungsfehler bei N+-PCa. Ist das so?
Im Jahr 1998 präsentierten d’Amico et al. ihr Staging-System, das die PCa-Patienten in 3 Risikogruppen (low, intermediate und high risk) für biochemische Rezidive nach definitiver Therapie einteilt3. Patienten in der High-Risk-Gruppe für Therapieversagen waren jene mit Tumorstadium ≥ cT2c oder Serum PSA > 20 ng/ml oder Gleason-Score ≥ 8 und/oder > 50 % positiven Stanzen bei der Prostatabiopsie4. Setzt man bei diesen High-Risk-Patienten eine Monotherapie ein, beträgt die 5-Jahres-Überlebensrate 30–50 %, die Indikation für eine Monotherapie ist somit sehr kontrovers3.
Chirurgische Behandlung bei N+-PCa
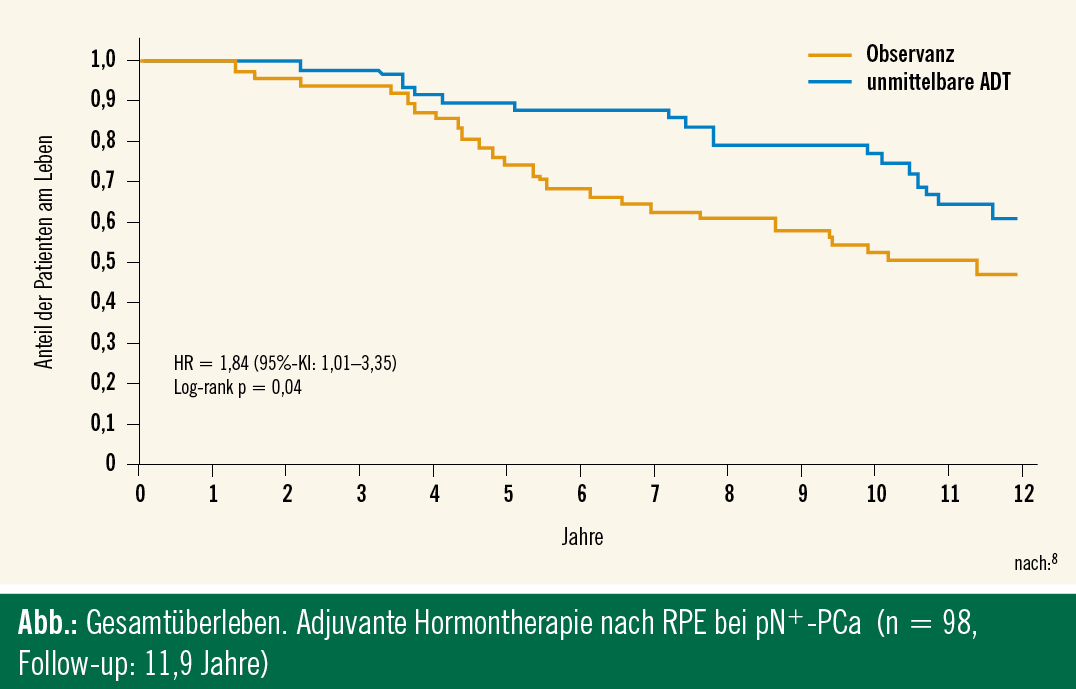
Die meisten Urologen sind abgeneigt, eine radikale Prostatektomie (RPE) bei cN+-Patienten durchzuführen oder brechen die Operation bei einem intraoperativ positiven LK-Gefrierschnitt ab5. Nichtsdestotrotz haben mehrere Studien gezeigt, dass die Kombinationstherapie (RPE und frühe adjuvante Hormontherapie) bei N+-PCa-Patienten zu einem karzinomspezifischen Überleben von 80 % führt6–8 (Abb.). Die Auswertung Münchener Tumorregisterdaten aus dem Jahr 2010 zeigte Vorteile hinsichtlich der karzinomspezifischen Überlebensraten bei Patienten nach RPE, bei intraoperativem N+, verglichen mit Patienten, bei denen die Operation abgebrochen wurde9. Diese Ergebnisse untermauern bei intraoperativem N+-PCa die Entscheidung zugunsten der Durchführung einer RPE als wichtigen Anteil der Kombinationstherapie.
Neoadjuvante Hormontherapie
Seit 1980 wurde die Wirksamkeit der neoadjuvanten Hormontherapie in mehreren prospektiven randomisierten Studien präsentiert. Diese Therapiemodelle waren mit einem Abfall positiver chirurgischer Resektionsränder, Lymphknotenmetastasen sowie mit einer steigenden Inzidenz „pathologischer“ pT0-Tumoren assoziiert10. Weitere Studienergebnisse suggerieren, dass zumindest 65 % der nach Hormontherapie als pT0 klassifizierten Präparate immer noch persistierende Tumorzellen aufweisen11. Am wichtigsten erscheint die Tatsache, dass es keine Langzeitdaten bezüglich neoadjuvanter Hormontherapie gibt, die Vorteile bezogen auf das biochemische rezidivfreie Überleben oder das Gesamtüberleben aufweisen.
Neoadjuvante Chemotherapie
Es gibt wenige randomisierte Studien mit adäquater statistischer „Power“, die eine neoadjuvante Chemotherapie vor RPE evaluiert haben. Pettaway et al. untersuchten die Wirkung von Ketoconazol und Doxorubicin alternierend mit Vinblastin, Estramustin und Androgen-Ablation vor RPE12. Die pathologische Evaluierung nach RPE zeigte folgende Ergebnisse: 33 % der Patienten hatten organbegrenzte Tumoren, 63 % hatten negative LK und 17 % hatten positive Resektionsränder. Das primäre Ziel der Studie (pT0 bei 20 % der Präparate) wurde nicht erreicht12.
Nach der Zulassung von Docetaxel für hormonrefraktäre PCa wurden viele Studien auch im neoadjuvanten Setting durchgeführt, jedoch meist mit dem primären Ziel, die Sicherheit der Therapie nachzuweisen13, 14. Eine Phase-II-Studie von Dreicer et al. beinhaltete 29 Patienten mit High-grade-PCa. Alle Patienten unterzogen sich im Anschluss an sechs Zyklen Docetaxel (40 mg/m2) einmal wöchentlich einer RPE. Histologisch fand sich nur bei 11 % der Patienten ein organbegrenztes PCa, 89 % zeigten eine Kapselüberschreitung, und 14 % der Patienten hatten LK-Metastasen. Keiner der Patienten zeigte eine komplette Remission nach Docetaxel15. Die erfolgreiche Anwendung von Docetaxel bei hormonrefraktärem PCa, kombiniert mit den Ergebnissen aus abgeschlossenen Phase-II-Studien, mündete in einer Phase-III-Studie. Diese wurde von der Cancer and Leukemia Group B (CALGB 90203) entwickelt. Die Einschlusskriterien waren: High-grade-PCa und Gleason-Score ≥ 8 oder die Wahrscheinlichkeit eines biochemischen progressionsfreien Überlebens 5 Jahre nach RPE < 60 % nach dem Kattan-Nomogramm16. Patienten mit klinischem T1–T3a NxM0-PCa wurden in zwei Gruppen randomisiert: RPE als einzige Therapie oder chemo-hormonelle Therapie (Leuprorelinazetat oder Goserelin für 18–24 Monate sowie sechs Zyklen Docetaxel) mit nachfolgende RPE. Ziel der Studie ist es, 750 randomisierte Studienteilnehmer zu akquirieren und die ersten Ergebnisse nach einem Beobachtungszeitraum von 3 Jahren auszuwerten. Der offizielle Studienbeginn war im Juli 2007, im Oktober 2011 zählte die Datenbank jedoch nur 75 Patienten.
Adjuvante Hormontherapie
Bei den Patienten mit High-grade-PCa liegt die Wahrscheinlichkeit eines biochemischen Rezidivs bei 67 % 5 Jahre nach RPE. Der Sinnhaftigkeit einer adjuvanten Hormontherapie liegen folgende Überlegungen zugrunde: Elimination von Mikrometastasen, Reduktion von Lokalrezidiven und Fernmetastasen. Messing et al. zeigten ein signifikant besseres Überleben bei N+-PCa-Patienten, die unmittelbar nach RPE eine Hormondeprivationstherapie erhielten (3,6 mg Goserelin s. c. alle 28 Tage oder bilaterale subkapsuläre Orchiektomie)7. Die Studie wurde wegen ihrer geringen Teilnehmerzahl (98 Patienten), der nicht zentralisierten Pathologie und einer inadäquaten Randomisierung kritisiert17. In der Studie von Wirth et al.18 waren die N+-PCa-Patienten ausgeschlossen. Die Ergebnisse zeigten signifikante Unterschiede im rezidivfreien Überleben, aber keine Unterschiede im gesamten Überleben. Die besseren Ergebnisse im rezidivfreien Überleben in der adjuvanten Therapiegruppe (250 mg Flutamid 3-mal täglich) waren bei 43 % der Patienten mit Nebenwirkungen (Nausea, Erbrechen und Hepatotoxizität) begleitet18. Die Metaanalyse von Messing und Wirth konnte keine signifikanten Unterschiede im Gesamtüberleben nach 5 Jahren demonstrieren19.
Adjuvante Chemotherapie
SWOG 9921 (Phase-III-Studie) wurde zum Vergleich der Therapieeffekte (Hormontherapie und Hormontherapie + Chemotherapie) bei Patienten mit lokal fortgeschrittenem PCa (Gleason-Score ≥ 8, pT3b–pT4 oder N1, Gleason-Score 7 mit positivem Resektionsrand, präoperativem PSA ≥ 15 ng/ml oder PSA > 10 ng/ml bei Gleason-Score ≥ 8) nach RPE entwickelt. Hormontherapie war als Bicalutamid 50 mg/d + Goserelinazetat 10,8 mg/12 Wochen s. c. für zwei Jahre definiert. Die zweite Gruppe wurde mit Hormontherapie + Mitoxantron 12 mg/m2 alle 21 Tage für 6 Zyklen mit 5 mg Prednison 2/d für 6 Zyklen20 behandelt. 983 Patienten wurden randomisiert. In der Mitoxantron-Gruppe (487 Patienten) zeigten sich 3 Fälle (0,6 %) einer akuten myeloischen Leukämie (AML). Die Studie wurde abgebrochen und die Teilnehmer befinden sich in der Nachsorge. Die AML wurde, ähnlich wie in den Mammakarzinomstudien, mit Mitoxantron behandelt. In erster Linie wurden die Studienteilnehmer auf eine latente Entwicklung einer AML beobachtet, jedoch ist eine Auswertung der beiden Gruppen geplant, um eventuelle Therapieunterschiede zwischen beiden Gruppen nachzuweisen20.
TAX-3501-Studie: Anlässlich der Jahresversammlung der ASCO 2012 in Chicago erfolgte die Präsentation der vorläufigen Daten der TAX-3501-Studie von Eisenberger MA. Die Patienten waren in folgenden drei Gruppen randomisiert: 1. Observation, 2. Leuprorelinazetat für 18 Monate, 3. Leuprorelinazetat + Docetaxel 75mg/m2 alle 3 Wochen für 6 Zyklen nach RPE. Endpunkt ist das progressionsfreie Überleben. Zum jetzigen Zeitpunkt ist eine klare Aussage nicht möglich, jedoch ist zum wiederholten Mal die Komplexität der Organisation und Durchführung solcher prospektiver multizentrischer Projekte in den Vordergrund geraten (lokale Pathologie, keinen Konsens bzgl. Patienten und Therapieselektion usw.)21.
Die CSP-553-Studie22 wurde zum prospektiven Vergleich der High-Risk-PCa-Patienten nach RPE entwickelt. Die Randomisierung erfolgte in frühe adjuvante Chemotherapie (Docetaxel 75 mg/m2 alle 3 Wochen + Prednison 5mg 2/d für 6 Zyklen) oder Observation bei Patienten, die ein hohes Rezidivrisiko nach potenziell kurativer RPE aufwiesen. Das hohe Rezidivrisiko wurde definiert als biochemisches Rezidivrisiko > 50 % 5 Jahre nach RPE. Die Studie begann im Jahr 2006 mit dem Ziel, 636 Patienten zu randomisieren. Primärer Endpunkt ist das progressionsfreie Überleben und im weiteren Sinne auch das metastasenfreie Überleben, das karzinomspezifische Überleben, das Gesamtüberleben, Lebensqualität und die Toxizität. Es wird auch das Intervall zum Beginn der Androgendeprivationstherapie beobachtet. Dies ist bisher die einzige Studie, welche die Wirksamkeit der Chemotherapie ohne Androgendeprivationstherapie zu evaluieren versucht. Die Studie wird 2012 abgeschlossen.
Adjuvante Radiotherapie
Zielsetzung der adjuvanten Radiotherapie (RX) ist die Elimination residualer PCa-Zellen in der OP-Loge nach dem chirurgischen Eingriff. Das ultimative Ziel ist die Senkung lokaler und biochemischer Rezidivraten sowie die Verbesserung des Gesamtüberlebens. Einige prospektive Studien haben die Vorteile im biochemischen progressionsfreien Überleben gezeigt17, 23. Die Identifikation der Patienten, die mit einem vorteilhaften Verlauf auf eine adjuvante Radiotherapie nach RPE ansprachen, erwies sich als komplex.
Die EORTC-22911-Studie konnte die Empfehlung für adjuvante RX bei Patienten mit negativen chirurgischen Rändern nicht abgeben24.
Noch eine interessantere Frage stellt sich vielleicht auch bezogen auf den Zeitpunkt der Radiotherapie nach RPE, unabhängig vom Vorhandensein des positiven Resektionsrandes (R1). RX bei nichtdetektierbarem PSA (adjuvante RX) oder bei detektierbarem PSA nach RPE (Salvage-RX). Die SWOG-8794-Studie zeigte die Überlegenheit der adjuvanten RX gegenüber einer Salvage-RX im metastasenfreien Überleben. Weitere retrospektive Studien führten zum selben Ergebnis25. Im Jahr 2011 wurde die Studie von Briganti et al. publiziert, wobei die pN1-Patienten bei adjuvanter Hormontherapie und RX nicht exkludiert wurden26. Diese „matched“ Analyse könnte die Vorteile im biochemischen progressionsfreien Überleben zeigen, jedoch ist das derzeitige Nachsorge-Zeitintervall zu kurz, um die Gesamtüberlebensraten zu präsentieren.
1 Ago CT, Clin Oncol (R Coll Radiol)1999; 11(5):361.
2 Shariat SF, Rink M, Fajkovic H, Spectrum Urologie 1/2012; 8–12.
3 D’Amico AV et al., JAMA 1998; 280(11):969–974.
4 Lee AK et al., Int J Radiat Oncol Biol Phys 2001; 49(3):673–677.
5 Heidenreich A et al., In: EAU Guidelines, edition presented at the 27th EAU Annual Congress, Paris 2012. ISBN/EAN 978-90-79754-83-0:Update February 2012:p49.
6 Ghavamian R et al., J Urol 1999; 161(4):1223–1227; discussion 1227–1228.
7 Messing EM et al., NEJM 1999; 341(24):1781–1788.
8 Messing EM et al., Lancet Oncol 2006; 7(6):472–479.
9 Engel J et al., Eur Urol 2010; 57(5):754–761.
10 Köllermann J et al., Eur Urol 2000; 38(6):714–720.
11 Köllermann J et al., Eur Urol 2004; 45(1):42–45.
12 Pettaway CA et al., JCO 2000; 18(5):1050–1057.
13 Oh WK et al., Semin Oncol 2001; 28(4 Suppl 15):40–44.
14 Berger AP et al., Urol Int 2004; 73(2):110–112.
15 Dreicer RC et al., Urology 2004; 63(6):1138–1142.
16 Kattan MW et al., JCO 1999; 17(5):1499–1507.
17 Thompson IM et al., JAMA 2006; 296(19):2329–2335.
18 Wirth MP et al., J Urol 2004; 172(5 Pt 1):1865–1870.
19 Kumar S et al., Cochrane Database Syst Rev 2006; 4:CD006019.
20 Flaig TW et al., JCO 2008; 26(9):1532–1536.
21 Eisenberger MA et al., JCO 30, 2012 (suppl; abstr 4570).
22 Montgomery BP et al., Urology 2008; 72(3):474–480.
23 Bolla M et al., Lancet 2005; 366(9485):572–578.
24 Van der Kwast TH et al., JCO 2007; 25(27):4178–4186.
25 Anscher MS, Int J Cancer 2001; 96(2):91–93.
26 Briganti A et al., Eur Urol 2011; 59(5):832–840