Studie M10-440: Chemotherapie und PARP-Hemmung mit Veliparib – Wirksynergismus beim metastasierten Melanom?
Mittlerweile stehen beim metastasierten Melanom zielgerichtete Therapien zur Verfügung, die bei einem umschriebenen Patientenkollektiv zur Wirkung kommen. Als neuer Therapieansatz wurde eine Verstärkung der Temozolomid-Chemotherapie durch den PARP-Hemmer Veliparib untersucht.
Resistenzen umgehen: PARP sind Enzyme, die für DNA-Reparatur, Replikation, Transkription und Zelltod eine essenzielle Rolle spielen. „In Bezug auf die DNA-Reparatur zeigen Krebszellen eine größere Abhängigkeit von PARP als normale Zellen“, erläuterte Prof. Dr. Mark Middleton, Universität Oxford, UK. „Eine PARPHemmung kann die durch Chemotherapie und Bestrahlung herbeigeführte DNA-Schädigung verstärken.“
Veliparib, ein Inhibitor von PARP-1 und PARP-2, potenziert die Wirkung von Temozolomid über einen in der Monotherapie nicht genutzten Pathway. „Bei de – fektem Mismatch-Repair oder hoher MGMT-Expression wird durch das Umgehen dieser Resistenzmechanismen die Temozolomid-Sensitivität wiederhergestellt“, erklärte Middleton.
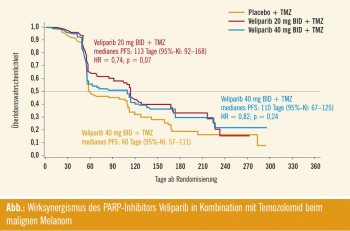
Studie M10-440: Die randomisierte, doppelblinde, dreiarmige Phase-II-Studie M10-440 evaluierte die Wirksamkeit von Veliparib 20 mg zweimal täglich bzw. 40 mg zweimal täglich in Kombination mit Temozolomid vs. Temozolomid alleine beim metastasierten Melanom im Stadium III/IV. „Das progressionsfreie Überleben fiel in den beiden Veliparib-Armen besser aus, wenn auch nicht signifikant“, bezog sich Middleton auf den primären Endpunkt (Abb.). Hinsichtlich des Gesamtüberlebens resultierte kein Unterschied zwischen dem 20-mg-Arm und dem Kontrollarm, während im 40-mg- Kollektiv eine nichtsignifikante Verbesserung mit einer Mortalitätsreduktion um 21 % auffiel. Für das Ansprechen wurden ebenfalls keine Signifikanzen erhoben.
Das Sicherheitsprofil ähnelte jenem der Temozolomid-Studien. Den Hauptunterschied gegenüber dem Kontrollarm machten höhere Raten hämatologischer Toxizitäten unter Veliparib aus. Nebenwirkungen der Grade 3 und 4 überwogen signifikant, allerdings führte dies nicht häufiger zu schweren Ereignissen oder Therapieabbrüchen. Mittels Biomarkeranalyse wird derzeit versucht, Subpopulationen zu definieren, die besonders gut auf die Kombination ansprechen.
Efficacy of Veliparib (ABT-888) Plus Temozolomide Versus Temozolomide Alone: a Randomized, Double-blind, Placebo-controlled Trial in Patients with Metastatic Melanoma, M. Middleton
KOMMENTAR
Poly(ADP-ribose)-Polymerase 1 (PARP-1) ist ein körpereigenes Enzym, das an der DNA-Reparatur beteiligt ist. Fehlt PARP-1 in der Zelle oder erfolgt eine medikamentöse Hemmung des Enzyms, können DNA-Schäden nur noch mithilfe der so genannten homologen Rekombination behoben werden. In Tumorzellen ist eine homologe Rekombination zur DNA-Reparatur häufig gestört. Daher besteht die berechtigte Hoffnung, dass PARP-1-In – hibitoren den genotoxischen Stress von alkylierenden Zytostatika, wie z. B. dem oral wirksamen Temozolomid soweit verstärken, dass es zu einem Absterben der Tumorzellen kommt. Eine solche synergistische Wirkung konnte bereits in vitro und in präklinischen In-vivo-Modellen demonstriert werden. Dabei waren insbesondere die Effekte auf Leukämiezellen oder Glioblastome adressiert worden. In der vorliegenden Arbeit wurde nun ein potentiell synergistischer Effekt des PARP-1-Inhibitors Veliparib/ ABT-888 in Kombination mit Temozolomid beim metastasierten Melanom adressiert. Hierbei zeigt sich leider keine signifikante Verbesserung des klinischen Erfolges von Temozolomid durch die Zugabe des PARP-1- Inhibitors. Leider wurde in der Studie keine Anreicherung von Patienten angestrebt, für die ein besseres Ansprechen auf die getesteten Substanzen zu erwarten gewesen wäre. Es konnte kürzlich gezeigt werden, dass ein Verlust von Phosphatase PTEN (Phosphatase and Tensin homolog), wie er in einer Subgruppe von Melanomen beobachtet wird, nicht nur die Empfindlichkeit gegenüber Temozolomid erhöht, sondern auch zu einer besonderen Sensibilität für den PARP-1-Inhibitor Veliparib/ABT-888 und somit zur synthetischen Letalität der Zellen führt. Diese Beobachtung ist insbesondere deswegen wesentlich, da Zellen mit einem PTEN-Verlust häufiger resistent gegen mutationsspezifische B-raf-Inhibitoren sind, selbst wenn die Zellen die V600E-B-raf-Mutation aufweisen. Es ist zu hoffen, dass die angekündigten Biomarker-Untersuchungen auch diese Möglichkeit abdecken.
Quelle: European Multidisciplinary Cancer Congress (EMCC), Presidential Sessions, 24.-27. September 2011, Stockholm