Aktuelles zur Therapie des multiplen Myeloms und des Non-Hodgkin-Lymphoms
Multiples Myelom
Therapiesequenzen in Zeiten neuer Substanzen: Das mediane Alter bei Diagnosestellung des multiplen Myeloms beträgt 70 Jahre, bedingt durch diese Tatsache und die daraus resultierenden Komorbiditäten gilt es für diese Patientenpopulation die richtigen Therapieoptionen auszuwählen, beginnt Dr. Salwender, Hamburg, seine Ausführungen. Wichtig sei es, führt Salwender weiter aus, die optimale Therapiesequenz für Myelom-Patienten zu finden, wobei man bei den jüngeren Patienten, die für eine Hochdosistherapie in Frage kommen, nach momentaner Datenlage eine Dreierkombination in der Induktionstherapie zum Einsatz bringt. Die Studiengruppe um Michele Cavo aus Bologna präsentierte am letztjährigen ASH-Daten, die aufzeigten (Terragna et al., Blood 2010), dass nach einer erfolgreichen Induktionstherapie mit der Kombination Bortezomib- Thalidomid-Dexamethason durch eine anschließende Konsolidierungstherapie eine vertiefte molekulare Remission erzielt werden konnte. Bezogen auf den Großteil der Myelom-Patienten – jener, welche nicht für eine Stammzelltransplantation geeignet sind – demonstriert ein Studienupdate (Mateos et al., JCO 2011) der VISTA-Studie (der Zulassungsstudie für Bortezomib beim älteren Patienten, San Miguel et al., 2008), dass Patienten im VMP-Studienarm (Velcade ®/Melphalan/Prednison) tendenziell ein längeres Überleben ab dem ersten Rezidiv haben (VMP 30,2 Monate versus MP 21,9 Monate). Der Überlebensvorteil mit VMP ergab sich trotz Bortezomib-Behandlung von ca. 50 % der Melphalan+ Prednisolon-Patienten im Rückfall. Patienten können nach aktueller Datenlage (Mateos et al., JCO 2011), so Salwender, nach einer VMP-Therapie entweder mit einer IMID-basierenden Therapie oder aber mit einer neuerlichen Bortezomib-Therapie effektiv wiederbehandelt werden.
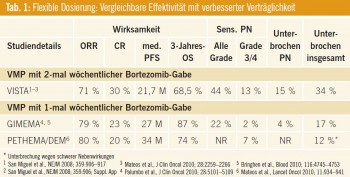
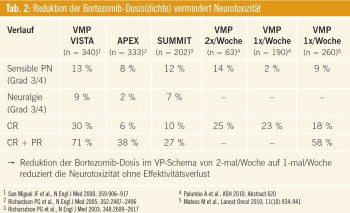
Möglichkeiten der Verringerung/Vermeidung von Bortezomib-bedingten peripheren Neuropathien: Aufgrund der zum Teil erhöhten Rate an peripheren Neuropathien bzw. des fortgeschrittenen Alters der Patienten wurden in den letzen Jahren dosismodifizierte VMP-Schemata untersucht. Anstatt der 6-wöchigen Therapiezyklen (Bortezomib-Gabe 2-mal wöchentlich) wurden die Patienten in 5- wöchigen Therapiezyklen (Bortezomib Gabe einmal wöchentlich) therapiert. Die Vorteile der wöchentlichen Bortezomib- Gabe beziehen sich vor allem auf die Verringerung der Grad-3/4-peripheren-Neuropathie (Palumbo et al., ASH 2009), die mit 2 % deutlich niedriger als in den zweimal wöchentlichen Therapiearmen (13 % bzw. 14 %) lag. Bezogen auf die insgesamt verabreichte Bortezomib-Dosis gab es keinen Unterschied zwischen dem zweimal wöchentlichen und dem einmal wöchentlichen Behandlungsarm. Spanische und italienische Studiengruppen konnten aufzeigen, dass eine flexible (wöchentliche) Bortezomib-Dosierung bei nahezu gleich bleibender Effektivität zu einer verbesserten Verträglichkeit führt (Tab. 1). Die subkutane Gabe von Bortezomib stellt eine weitere Therapieoption zur Minimierung einer schwerwiegenden peripheren Neuropathie dar. Die von Prof. Moreau Nantes publizierten Daten der Phase-III-Studie (Moreau et al., Lancet 2011) zeigten eine signifikant niedrigere Rate an peripheren Neuropathien bei subkutaner Applikation der Substanz verglichen mit der intravenösen Gabe (_ Grade 3 16 % bei i. v. Applikation vs. 6 % bei s. c. Gabe). Hinsichtlich der Vielzahl von neuen Subs tanzen ist ein richtiges Management der wichtigsten Nebenwirkungen von größter Bedeutung, meint Prof. Martin Kropff, Münster. Eine Bortezomib-basierte Therapie führt zumeist zu sensorischen Neuropathien, daher gilt es vor allem für ältere Patienten eine altersadaptierte Dosierung (wie zum Beispiel die wöchentliche oder subkutane Bortezomib-Gabe) in Erwägung zu ziehen, führt Kropff weiter aus. Eine Einhaltung der Guidelines zur Dosismodifikation, Mitarbeiterschulungen sowie erhöhte Aufmerksamkeit können bei Bortezomib-therapierten Patienten zu einer zumindest partiellen Reversibilität der peripheren Neuropathie führen. Eine Reduktion der Dosisdichte sowie eine subkutane Applikation der Substanz reduzieren, resümiert Kropff, die Neurotoxizität, ohne an Effektivität einzubüßen (Tab. 2).
Non-Hodgkin-Lymphom
Stellenwert von Bortezomib: Bortezomib kommt nicht nur in der Therapie des multiplen Myeloms zum Einsatz. Prof. Mathias Rummerl, Gießen, präsentierte eine Übersicht zum Einsatz der Substanz im breiten Spektrum der Lymphome. Am ASH-Meeting 2010 wurde die so genannte VERTICAL-Studie (Friedberg et al., Blood 2011) bei relapsiertem oder refraktärem follikulärem Lymphom präsentiert. Bei diesem Studiendesign wurden folgende Substanzen miteinander kombiniert: Rituximab (Standarddosierung von 375 mg/m2, im ersten Therapiezyklus einmal wöchentlich, in den folgenden Zyklen nur an Tag 1; Bendamustin (90 mg/m2) jeweils an den Tagen 1 und 2 sowie Bortezomib (1,6 mg/m2) injiziert an den Tagen 1, 8, 15 sowie 22. Das Gesamtansprechen lag bei 83 %, die Rate am progressionsfreien 2-JahresÜberleben beträgt 47 %. VBR verbessert somit sowohl die Ansprechraten als auch die Tiefe des Ansprechens verglichen mit der vorangegangen Therapie. Die meisten behandlungsassoziierten Nebenwirkungen waren vom Schweregrad 1/2. Nachdem die Herpes-zoster-Reaktivierung in dieser Studie mit 13 % angegeben wurde, wies Prof. Rummel einmal mehr auf die Bedeutung einer prophylaktischen antiviralen Therapie bei Patienten unter Bortezomib-Therapie hin. Eine mögliche subkutane Applikation von Bortezomib (Moreau P et al., ASH 2010) könnte, führt Prof. Rummel weiter aus, ähnlich wie bei Myelom-Patienten die Rate an peripheren Neuropathien mindern.
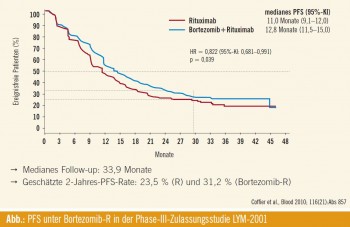
Am letztjährigen ASH-Meeting wurden die Resultate der LYM-2001-Phase-III-Zulassungsstudie bei refraktären/rezidivierten follikulären Lymphomen präsentiert. Verglichen wurden die beiden Behandlungsarme Rituximab+Bortezomib (1,6 mg/m2, Tag 1, 8, 15 und 22) vs. Rituximab- Monotherapie. In dieser Studie wurden 673 Patienten mit refraktärem/rezidiviertem follikulärem Lymphom (Grad 1, 2) randomisiert, die Patienten mussten Rituximab- naiv/-sensitiv sein, eine vorangegangene Bortezomib-Therapie war nicht erlaubt. Als primärer Studienendpunkt wurde eine Verlängerung des PFS (progressionsfreies Überleben) definiert. Das Gesamtansprechen lag im Studienarm Bortezomib+Rituximab bei 63 % verglichen mit 49 % im Rituximab-Monotherapie- Arm; die Rate an kompletten Remissionen betrug im Kombinationsstudienarm 25 % verglichen mit 18 % im Rituximab-Arm. Das anhaltende Gesamtansprechen (definiert als Ansprechen > 6 Monate) konnte im Brote zomib+ Rituximab- Studienarm mit 50 % vs. 38 % im Vergleichsarm berichtet werden, die Raten an anhaltenden kompletten Remissionen betrug in der Bortezomib+Rituximab- Kombinationstherapie 24 % versus 17 % in der Vergleichsgruppe. Das mediane Follow- up lag bei 33,9 Monaten (Abb.). Die geschätzte 2-Jahres-Rate für das progressionsfreie Überleben beträgt 31,2 % (Bortezomib+ Rituximab) verglichen mit 23,5 % unter Rituximab-Monotherapie. Patienten mit einem hohen FLIPI-Score (_ 3) sowie einer hohen Tumorlast profitierten von einer Bortezomib+Rituximab-Kombinationstherapie. 17 % der Patienten im Bortezomib-Studienarm wiesen eine periphere Neuropathie auf (sensorisch), unter einer Rituximab-Behandlung konnte diese Nebenwirkung nur bei 1 % der Patienten festgestellt werden; eine Verbesserung oder eine vollständige Rückbildung der Neuropathien konnte bei 78 % der Patienten beobachtet werden, die mediane Zeitspanne bis zur Verbesserung lag bei 58 Tagen.
Quelle: Gemeinsame Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Onkologie 2011 in Basel