Studien COMFORT II, ENESTnd, RECORD 1, CHANGE, BOLERO 2, RADIANT 3 – Zielgerichtete Therapien bei MPN, CML und soliden Tumoren
Zu den myeloproliferativen Neoplasien (MPN) zählen die essenzielle Thrombozythämie (ET), die Polycythaemia vera (PV) und die Myelofibrose (MF), wobei die MF die schlechteste Prognose aufweist. Eine gemeinsame pathogenetische Grundlage bildet die beim Großteil der MPN-Patienten nachweisbare JAK2-V617F-Mutation. Als erste Therapie, die an diesem Angelpunkt ansetzt, wurde der selektive orale JAK1- und JAK2-Hemmer Ruxolitinib (INC424) entwickelt. In der europäischen Phase-IIIStudie COMFORT II erhielten (Interme – diär-2- oder Hochrisiko-)Patienten mit primärer MF bzw. Post-ET-/PV-MF randomisiert entweder Ruxolitinib (15 mg bzw. 20 mg zweimal täglich) oder die beste verfügbare Therapie (Hydroxyharnstoff, Steroide, Erythropoietin, Imide, Inter – feron). „In beiden Armen lag eine JAK2- V617F-Mutation in 70 Prozent vor, und alle Patienten wiesen bei obligater Splenomegalie eine vergleichbare Milzgröße auf“, erklärte Prof. Dr. Konstanze Döhner, Universitätsklinikum Ulm.
COMFORT-II-Studie bei MPN
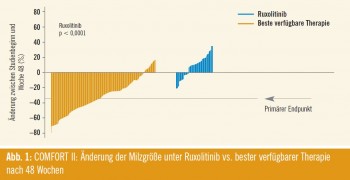
Signifikanter Rückgang der Splenomegalie: Die erste große Zwischenanalyse von COMFORT II wurde von Harrison et al. erstmals beim ASCO-Kongress 2011 (Abstract LBA6501) präsentiert. „Während nach 48 Wochen im Kontrollarm bei keinem Patienten eine mehr als 35- prozentige Milzreduktion erreichbar war, betrug dieser Anteil im Ruxolitinib-Arm 28,5 Prozent“, verwies Döhner auf den hochsignifikanten Unterschied in Bezug auf den primären Endpunkt (p < 0,0001). Ein ähnliches Muster fand sich für den Anteil der Patienten, bei denen eine 35%ige Reduktion bereits in Woche 24 evident war (31,9 % vs. 0 %; p < 0,0001). Während 97 % der mit Ruxolitinib behandelten Teilnehmer eine Reduktion des Milzvolumens erfuhren, zeigte der Großteil im Kontrollarm einen Anstieg (Abb. 1). Ansprechen zeigte sich unabhängig vom Vorliegen der V617F-Muta – tion. Konstitutionelle Symptome (Appetitlosigkeit, Schlaflosigkeit, Dyspnoe, Knochen- und Muskelschmerzen, Müdigkeit) besserten sich im Ruxolitinib-Arm zum Teil signifikant, wogegen sie in der Kontrollgruppe durchwegs zunahmen.
Grad-3/4-Nebenwirkungen traten in vergleichbar geringem Ausmaß in beiden Kollektiven auf. Im experimentellen Arm waren Grad-1/2-Nebenwirkungen wie Übelkeit, Gelenksschmerzen, Kopfschmerzen und Durchfall häufiger, ebenso wie Grad-2- (Thrombopenie) bzw. Grad-3-Hämatotoxizitäten (Anämie). Döhner: „Alle Patienten hatten bei Studieneinschluss mindestens eine Grad-1/2- Anämie und mindestens eine Grad-1- Thrombopenie.“ Die Abbruchrate betrug im Ruxolitinib-Arm 18 %, im Kontrollkollektiv 33 %.
Basierend auf diesen Daten wurde bis zur Zulassung der Substanz ein Expanded- Access-Programm in Form einer einarmigen Phase-IIIB-Multicenterstudie aufgelegt. Es können auch Intermediär- 1-Patienten eingeschlossen werden, wenn sie eine tastbare Milzvergrößerung aufweisen, weiters ist eine Erstlinienbehandlung ebenso möglich wie spätere Therapielinien.
Therapieziel dauerhafte Vollremission bei CML
Mit der Einführung von Imatinib (Glivec®) in die Therapie der CML wurde ein maßgeblicher Schritt zur Chronifizierung der früher nur schwer behandelbaren Erkrankung gesetzt, dennoch weist der Tyrosinkinasehemmer Limitationen auf“, erklärte Prof. Dr. Tim Brümmendorf, Universitätsklinikum Aachen. Dem 8-Jahres- Update der IRIS-Studie zufolge zeigen 37 % der Patienten nach acht Jahren ein „inakzeptables Ergebnis“, d. h. sie befinden sich in keiner CCyR, haben einen CCyR-Verlust oder vertragen Imatinib nicht1. Verbesserungen wurden durch Nilotinib (Tasigna®) möglich, das in der ENESTnd-Studie gegenüber Imatinib ein tieferes molekulares Ansprechen2 in kürzerer Zeit ermöglichte (MMR nach 12 Monaten: 55 % vs. 27 %, p < 0,0001) und damit bessere Voraussetzung für das progressionsfreie Überleben schaffte3. Eine Hypothese besteht darin, dass man bei Patienten, die eine komplette molekulare Remission (CMR) über eine gewisse Zeitspanne hinweg beibehalten, die Behandlung absetzen könnte. Die Hypothese wurde in der STIM-Studie bei einer ausgewählten Subgruppe von Imatinib- Patienten untersucht, „allerdings hatten die meisten Patienten (61 %) nach Absetzen des Tyrosinkinasehemmers einen Rückfall“, schränkte Brümmendorf ein4. Hoffnung gibt in diesem Szenario das in jedem Respons-Kriterium bessere Abschneiden von Nilotinib, mit dem in der ENESTnd-Studie auch signifikant höhere CMR-Raten (4-log- und 4,5-log-Reduktionen) möglich waren5. Derzeit wird in der Studie V der deutschen CML-Studiengruppe (TIGER-Studie) nach Erreichen einer MMR unter Nilotinib (+/– PEG-IFN) eine Erhaltungstherapie mit Peg-Interferon oder Nilotinib geprüft.
mTOR-Inhibition bei Nierenzell-, Mammakarzinom und NET
RECORD-1, CHANGE: Die Effektivität des mTOR-Inhibitors Everolimus (Afi – nitor®) beim metastasierten Nierenzellkarzinom konnte in der RECORD-1-Studie demonstriert werden. In der nichtinterventionellen CHANGE-Studie wurde nun die Effizienz und Sicherheit der Therapie in der routinemäßigen Behandlung evaluiert, wobei Everolimus meist in der Zweitlinie nach Anti-VEGF- oder TKITherapie zum Einsatz kam. Eine geplante Interimsanalyse erbrachte für 99 auswertbare Patienten ein progressionsfreies Überleben (PFS) von 9,7 Monaten6, „was für eine Second-Line-Therapie in dieser Indikation einen sehr langen Zeitraum darstellt“, betonte Dr. Norbert Marschner, Praxis für interdisziplinäre Onkologie und Hämatologie, Freiburg. Unerwünschte Effekte manifestierten sich in 61 %, waren jedoch nur in 7 % der Grund für einen Therapiestopp. Bei 80 % musste keine Dosisänderung vorgenommen werden, Therapiepausen waren nur bei 9 Personen erforderlich. Alle Verlaufskontrollen erbrachten eine hohe Therapietreue. „Die CHANGE-Daten bestätigen die Wirksamkeit von Everolimus im klinischen Alltag“, fasste Marschner zusammen.
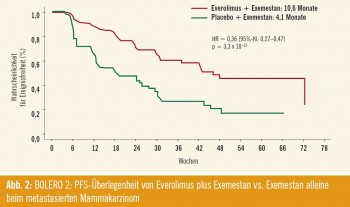
BOLERO-2: Viel versprechend sind Daten zu Everolimus bei 724 postmenopausalen Patientinnen mit fortgeschrittenem Mammakarzinom, die gegenüber nichtsteroidalen Aromatasehemmern (AI) refraktär waren. In der Phase-III-Studie BOLERO 2 wurde die Zugabe von Everolimus zum steroidalen AI Exemestan getestet. „Im Vergleich zu Exemestan alleine resultierte laut zentralem Review ein hochsignifikanter Benefit für die Zeit bis zur Progression“, erläuterte Marschner (10,6 vs. 4,1 Monate; p = 3,3 x 10–15; Abb. 2)7. Die Sicherheitsdaten entsprachen dem beim Nierenzellkarzinom bekannten Profil. „Damit ist Everolimus die erste Substanz, die eine echte Steigerung der Wirksamkeit eines steroidalen Aromataseinhibitors bewirkt.“
RADIANT-3: Operative Resektion, lokoregionale ablative Verfahren, Biotherapie (Somatostatinanaloga, Interferon) und Radiorezeptortherapie stellen die gängigen Optionen bei neuroendokrinen Tumoren (NET) dar. Pankreatische neuroendokrine Tumoren werden häufig in einem späten und bereits metastasierten Stadium diagnos tiziert, was laut Prof. Dr. Marianne Pavel, Charité Universitätsmedizin Berlin, den Bedarf für neue Therapien unterstreichen kann.
Everolimus bewirkte in der placebokontrollierten, doppelblinden Phase-III-Studie RADIANT-3 bei Patienten mit fortgeschrittenen pankreatischen NET verglichen mit Placebo eine Verlängerung des PFS von 4,6 auf 11,0 Monate mit einer Reduk – tion des Progressionsrisikos um 65 % (p < 0,001)8. „Nach 18 Monaten war noch ein Drittel der Patienten unter Everolimus progressionsfrei, im Placeboarm nur mehr 9 Prozent“, berichtete Marianne Pavel. Die Effektivität der mTOR-Therapie war entsprechend einer Subgruppenanalyse unabhängig von einer vorausgegangenen Chemotherapie9. Basierend auf diesen Resultaten wurde Everolimus im August von der EMA zur Therapie inoperabler oder metastasierter NET pankreatischen Ursprungs zugelassen.
Quelle: Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Onkologie, Symposium „Therapieinno – vationen – Zusatznutzen für den Patienten“, 2. 10. 2011, Basel
1 Deininger M et al., ASH 2009; Abstract 1126
2 Kantarijan HM et al., Lancet Oncol 2011; 12:841–851
3 Hochhaus A et al., Haematologica 2011; 96(s2):203–204 (Abstract 484)
4 Mahon FX et al., Lancet Oncol 2010; 11:1029–1035
5 Larson RA et al., J Clin Oncol 2011; 29(15s): 421s (Abstract 6511)
6 Bergmann L et al., ASCO 2011; Abstract 4552
7 Baselga J et al., EMCC 2011; Abstract 9LBA
8 Yao J et al., N Engl J Med 2011; 364:514–523
9 Pommier RF et al., ASCO 2011; Abstract 4103