ÖGN 2012: Aktuelle Aspekte der Ernährungstherapie auf Stroke Units und Neurointensivstationen
Patientinnen, deren Akutkrankheit die Aufnahme auf eine Stroke Unit oder Neurointensivstation erfordert, haben ein potenzielles Risiko für die Entwicklung bzw. Aggravierung einer Mangelernährung. Die Ursachen sind vielfältig und umfassen insbesondere quantitative Bewusstseinsstörungen und fokalneurologische Defizite mit Herabsetzung bzw. Verlust der Schutzreflexe und konsekutiver Aspirationsgefahr. Weiters sind die systemischen Auswirkungen von primären Erkrankungen des zentralen Nervensystems, die in einen hyperkatabolen Postaggressionsstoffwechsel münden können, zu berücksichtigen. Auch nach Überwinden der akuten Krankheitsphase erreichen viele PatientInnen, die eine intensivpflichtige neurologische Krankheit überstanden haben, nicht wieder den Zustand der Restitutio ad integrum, sondern verbleiben in einem mehr oder minder ausgeprägten Defektzustand mit Notwendigkeit einer längerfristigen neurologischen Akutnachbehandlung und Rehabilitationstherapie.
Es ist offensichtlich, dass der Ernährungsstatus von PatientInnen auch in diesen Behandlungsphasen einen relevanten Outcome-Parameter darstellt. Daraus folgend hat, unterstützt durch rezente wissenschaftliche Publikationen, die Ernährung von SchlaganfallpatientInnen und neurologischen IntensivpatientInnen als relevante Therapiemaßnahme einen höheren Stellenwert erreicht.
Ernährungsstatus und Prognose
Zahlreiche Studien konnten eindrucksvoll den Einfluss des Ernährungsstatus auf die Inzidenz von Komplikationen, insbesondere auf die Infektionsrate, kardiopulmonale Organdysfunktionen und die Wundheilung bei IntensivpatientInnen belegen. Auch bei SchlaganfallpatientInnen besteht ein klarer Zusammenhang zwischen Ernährungsstatus und Prognose. Mangelernährte SchlaganfallpatientInnen haben eine höhere Mortalität und längere Verweildauer im Krankenhaus. Im Vergleich mit PatientInnen mit normalem Ernährungsstatus benötigen SchlaganfallpatientInnen mit Mangelernährung eine längere Zeit, um die gleiche Verbesserung der Selbständigkeit zu erreichen.
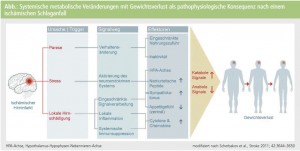
Obesity paradox: Ein in der Akutphase aufgebautes Kaloriendefizit kann häufig erst nach Wochen bzw. Monaten wieder ausgeglichen werden. Mittlerweile werden die komplexen pathophysiologischen Veränderungen, die zu einem progredienten Gewichtsverlust nach einer schweren Hirnschädigung führen, besser verstanden (Abb.).
Letztlich ist ein Ungleichgewicht zwischen anabolen und katabolen Faktoren entscheidend. Daraus leitet sich auch das so genannte „Paradoxon der Übergewichtigkeit“ (engl. obesity paradox) ab: Obwohl das metabolische Syndrom mit Übergewicht sowie Störungen des Fett- und Blutzuckerstoffwechsels einen anerkannten (modifizierbaren) Risikofaktor für Atherosklerose und in weiterer Folge zerebrovaskuläre Ereignisse repräsentiert, haben nach einem erlittenen Schlaganfall übergewichtige PatientInnen einen „Startvorteil“ für die weitere Neurorehabilitation verglichen mit zum Zeitpunkt des Schlaganfallereignisses normal- oder gar untergewichtigen PatientInnen.
Management des Ernährungsrisikos
Für die Praxis ist es daher relevant, so früh wie möglich nach Aufnahme auf eine Schlaganfalleinheit oder Intensivstation eine Erhebung des Ernährungszustandes sowie eine Risikostratifizierung bezüglich Mangelernährung vorzunehmen. Als geeignetes Instrument wird von den internationalen Ernährungsfachgesellschaften das Nutritional-Risk-Screening-Instrument (NRS 2002) nach Kondrup und Mitarbeitern empfohlen. Bei Vorliegen eines Ernährungsrisikos sollte ein auf die Bedürfnisse des Patienten/der Patientin abgestimmter Ernährungsplan ausgearbeitet werden.
An dieser Stelle soll betont werden, dass die Ernährungstherapie das Paradebeispiel einer interdisziplinären Intervention repräsentiert und folglich eine koordinierte Interaktion zwischen Ärzten und Ärztinnen, Pflegepersonal, SpezialistInnen der neurologischen Therapiedisziplinen (insbesondere Logotherapie) und ExpertInnen auf dem Gebiet der Diätologie bzw. Ernährungsmedizin erforderlich ist. Die Notwendigkeit einer individuellen Analyse des patientenspezifischen Ernährungsrisikos wird durch die Tatsache, dass die unkritische Anwendung von ernährungstherapeutischen Interventionen in der Gesamtgruppe der SchlaganfallpatientInnen zu keiner signifikanten Prognoseverbesserung beiträgt, untermauert.
Ernährungstherapie
Unbestritten ist, dass PatientInnen mit einer protrahierten Vigilanzstörung und beatmete PatientInnen längere Zeit auf eine „künstliche“ Ernährung angewiesen sind. Wesentliche Entscheidungskriterien bei der praktischen Durchführung der Ernährungstherapie sind dabei:
- Energiebedarf von PatientInnen mit „kritischer“ neurologischer Krankheit;
- Optimaler Zeitpunkt, die Ernährungstherapie zu beginnen;
- Enteraler, parenteraler oder gemischt enteral/parenteraler Ernährungszugang;
- Geschwindigkeit des Ernährungsaufbaus sowie
- Zusammensetzung der „künstlichen“ Ernährung.
Der Kalorienbedarf von Schlaganfall- und IntensivpatientInnen ist keine statische, sondern eine mit dem Krankheitsverlauf variable Größe. Goldstandard zur Ermittlung des tatsächlichen Kalorienbedarfs wäre die indirekte Kalorimetrie, dieses Verfahren ist jedoch recht komplex und daher wohl eher Einzelfällen vorbehalten.
Näherungsweise kann die Höhe des Kalorienbedarfs durch so genannte „Ernährungsformeln“, wie z. B. nach Harris und Benedict, abgeschätzt werden. Als „Faustregel“ nennen die internationalen Fachgesellschaften für beatmete IntensivpatientInnen etwa 20–25 kcal/kg Körpergewicht pro Tag (unter Berücksichtigung des PatientInnenalters und so genannter Stressfaktoren) als Kalorienziel. Zur Berechnung sollte das aktuelle Körpergewicht des/der Patienten/-in herangezogen werden, lediglich bei adipösen PatientInnen (BMI > 30 mg/m2) ist das ideale Körpergewicht zugrunde zu legen.
Makro- und Mikronährstoffe: Die empfohlenen Zufuhrmengen der Makronährstoffe (Tab. 1) liegen für Glukose bei 3–4 (max. 5) g/kg/d, für Fette bei 0,7–1,5 (max. 1,8) g/kg/d und für Aminosäuren bei 1–1,5 g/kg/d. Das Glukose-Fett-Kalorienverhältnis sollte ungefähr 70 : 30 betragen und kann in Abhängigkeit von der Stoffwechselsituation bis auf 50 : 50 adaptiert werden. Daneben ist eine adäquate Zufuhr von Mikronährstoffen (Vitamine und Spurenelemente), Elektrolyten und Flüssigkeit zu gewährleisten. Wie bei anderen intensivmedizinischen Interventionen ist auch bei der künstlichen Ernährung ein entsprechendes (metabolisches) Monitoring unabdingbar (Tab. 2).
Enterale Ernährung: Leitlinien zur Ernährungstherapie betonen den Stellenwert der frühzeitigen enteralen Ernährung, nicht zuletzt zum Erhalt der mechanischen und funktionellen Integrität des Darmes. Sofern keine Kontraindikationen vorliegen, sollte binnen 24 Stunden mit dem enteralen Ernährungsaufbau begonnen werden. Maßnahmen zur Förderung der gastrointestinalen Toleranz, wie die Gabe von Prokinetika (unter anderem Domperidon, Metoclopramid und Erythromycin), sind dabei frühzeitig in Erwägung zu ziehen.
In den ersten 48–72 Stunden ist die Ernährung hypokalorisch, binnen 96–120 Stunden sollte die errechnete Zielkalorienmenge erreicht werden. Unter allen Umständen ist in der akuten Phase einer schweren Erkrankung eine Hyperalimentation durch hyperkalorische Ernährung zu vermeiden, da dies in rezenten Studien mit einer signifikant erhöhten Sterblichkeit in Zusammenhang gebracht wurde.
Für die praktische Durchführung der enteralen Ernährung wird eine langsame Steigerung der Zufuhrrate in 10–20-ml-Schritten während der ersten 72 Stunden unter Beobachtung der Toleranz anhand Refluxmenge und abdomineller Distension empfohlen. Es sollten hochmolekulare Sondendiäten unter ausreichender Flüssigkeitszufuhr angewendet werden. Auch bei hohem gastrischem Residualvolumen sollte eine minimale enterale Ernährung (so genannte „Zottenernährung“) beibehalten werden.
Parenterale Ernährung: Bei Schwierigkeiten mit dem enteralen Ernährungsaufbau, zum Beispiel durch Reflux und hohes gastrales Residualvolumen, sollte zur Vermeidung eines zu großen Defizits zwischen Kalorienbedarf und tatsächlicher Zufuhr eine supplementierende parenterale Ernährung begonnen werden, wenn nach ca. 4 Tagen das Kalorienziel durch enterale Ernährung nicht gedeckt werden kann. Die Implementierung von Protokollen im Ernährungsmanagement trägt deutlich zu einer Qualitätsverbesserung bei.
Bei parenteraler Substratzufuhr ist umso mehr auf die metabolische Toleranz der „künstlichen“ Ernährung zu achten. Unter metabolischer Toleranz versteht man die aktuelle Kapazität des Stoffwechsels, die angebotenen Substrate metabolisieren zu können. Als relevante Zielparameter wurden dabei die Blutglukose und Serumtriacylglyceride definiert. Während weitgehender Konsens besteht, dass ein Triacylglyceridspiegel von unter 300 mg/dl angestrebt werden soll, ist die Höhe des optimalen Blutglukosewerts wegen teils kontroverser Studienergebnisse nach wie vor nicht genau definiert. Das Risiko einer strengen Blutzuckereinstellung liegt in einer Steigerung der Rate kritischer Hypoglykämien. Für neurologische IntensivpatientInnen konnte mittels zerebraler Mikrodialyse gezeigt werden, dass bereits bei Serumglukosewerten im unteren Normbereich die interstitielle Glukosekonzentration im Hirnparenchym auf hypoglykämische Werte abfallen kann. Wichtig ist ferner, dass neben Hypoglykämien die Variabilität der Glukosekonzentration Einfluss auf die Prognose nehmen kann. Neuere Empfehlungen zur Glukosekontrolle raten zu einer Einstellung < 180 mg/dl unter Vermeidung von starken Schwankungen des Glukosewerts.
Resümee
Zusammenfassend ist festzuhalten, dass Mangel- und Fehlernährung modifizierbare Risikofaktoren für ein ungünstiges Outcome nach zerebrovaskulären Ereignissen und traumatischen Schädigungen des zentralen Nervensystems repräsentieren. Daher müssen diese Risikofaktoren frühzeitig erkannt und durch adäquate ernährungstherapeutische Interventionen behoben werden. Weitere kontrollierte Studien sind jedoch erforderlich, um in diesem PatientInnenkollektiv die metabolischen Zielparameter, die mit einer Prognoseverbesserung einhergehen und mittels Ernährungstherapie beeinflussbar sind, zu definieren.
Autorenerklärung/potenzielle Interessenkonflikte:
R. B. hat Vortragshonorare von den Firmen Fresenius Kabi Austria GmbH und Baxter Healthcare GmbH erhalten
Ausführliches Literaturverzeichnis beim Autor
Weiterführende Literatur: – Berger MM, Pichard C, Best timing for energy provision during critical illness. Crit Care 2012; 16:215.
– Deutsche Gesellschaft für Ernährungsmedizin, Deutsche Gesellschaft für Geriatrie, Deutsche Gesellschaft für Neurologie: Leitlinie „Enterale Ernährung bei Patienten mit Schlaganfall“. AWMF Leitlinienregister 073/017.
– Kondrup J, Rasmussen HH, Hamberg O, Stanga Z, Ad hoc ESPEN Working Group, Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003; 22:321–36.
– Mayer K, Weigand MA, Seeger W, Ernährung in der Intensivmedizin. Dt Med Wochenschr 2011; 136:1180–83.
– Scherbakov N, Dirnagl U, Doehner W, Body Weight After Stroke: Lessons From the Obesity Paradox. Stroke 2011; 42:3646–50.
– Schütz T, Valentini L, Herbst B, Lochs H, ESPEN-Leitlinien Enterale Ernährung – Zusammenfassung. Aktuel Ernaehr Med 2006; 31:196–210.
– Weimann A, Andrä J, Sablotzki A, Ernährung bei Intensivpatienten. Dt Med Wochenschr 2011; 136:2251–62.