ÖGN 2012: Strukturelles MR bei normalem Altern und bei Alzheimer-Erkrankung: Weiße und schwarze Flecken
Häufigkeit von WML und MB
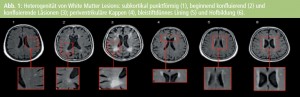
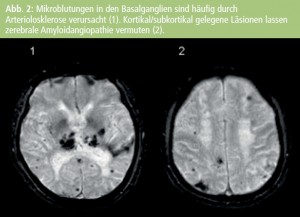
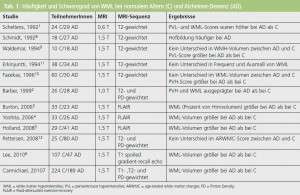
Die Abbildungen 1 und 2 zeigen die unterschiedlichen Typen von WML und MB. In Tabelle 1 werden die Unterschiede in der Frequenz der Läsionen zwischen normalem Altern und Alzheimer-PatientInnen dargestellt. Die meisten AutorInnen berichten über ein größeres Volumen von periventrikulären und subkortikalen Marklagerhyperintensitäten bei Alzheimer-Erkrankung1–7, es gibt aber auch Berichte, die vor allem periventrikuläre Hyperintensitäten als Alzheimer-assoziiert beschreiben8–10. Nur wenige Studien fanden keinen Unterschied zwischen normalem Altern und Alzheimer-Demenz in Hinblick auf WML7, 11, 12. MB sind ebenfalls häufiger bei AD als beim normalen Altern (Tab. 2). Die Prävalenz dieser Veränderungen variiert je nach Studie zwischen 18 % und 29 %. Multiple MB sind häufiger bei Alzheimer- PatientInnen als bei normalen Kontrollpersonen12– 14.
Räumliche Verteilung von WML und MB
Nur eine4 von 3 Studien4, 5, 12 beschreibt Alzheimer-spezifische Verteilung von WML mit ausgeprägteren Läsionen in der posterioren periventrikulären Region des Gehirns. Ein kortikaler/subkortikaler Lokalisationstyp mit okzipitaler Betonung wird ebenso als Alzheimer-typisch beschrieben12.
Progression von WML und MB
Konfluierende Marklagerhyperintensitäten haben die Tendenz zur Progredienz. Alzheimer- PatientInnen scheinen höhere Progressionsraten zu haben7.
Erste Daten zeigen, dass bei bis zu einem Viertel aller Kontrollpersonen innerhalb von 3 Jahren neue MB auftreten15. Es besteht diesbezüglich nahezu kein Unterschied zwischen Kontrollpersonen und Alzheimer-PatientInnen16.
Klinische Relevanz von WML und MB bei AD
Die Progression von WML bei Alzheimer- PatientInnen führt zu einem rascheren kognitiven Abbau7. Der Nachweis von MB ist ebenso mit schlechterer kognitiver Leistung assoziiert14. MB sind der stärkste Prädiktor von Mortalität in einer Gedächtnisambulanzpopulation17.
Konklusionen
WML und MB sind häufiger bei Alzheimer- PatientInnen als bei Kontrollen, und beide Läsionstypen zeigen eine raschere Progredienz bei AD. Die hohe Rate von neu auftretenden MB hat wichtige Auswirkungen für Anti-Amyloid-Studien bei Alzheimer- Demenz. Solche Studien verwenden häufig neu auftretende MB als Sicherheitskriterium. Kenntnis über den natürlichen Verlauf von MB kann daher eine Überschätzung von therapieassoziiertem Blutungsrisiko verhindern. Die Evidenz, dass WML und MB den klinischen Verlauf von Alzheimer- PatientInnen beeinflussen, ist nicht endgültig und erfordert weitere Untersuchungen. Wenn diese Befunde in größeren Studien mit längerer Laufzeit bestätigt werden, können sowohl WML als auch MB als therapeutische Ziele in Hinblick auf die Modifikation der Progression einer Alzheimer- Demenz dienen.
1 Scheltens P, Barkhof F, Valk J, Algra PR, van der Hoop RG, Nauta J, Wolters EC, White matter lesions on magnetic resonance imaging in clinically diagnosed Alzheimer‘s disease. Evidence for heterogeneity. Brain 1992; 115( Pt 3):735–48.
2 Barber R, Scheltens P, Gholkar A, Ballard C, McKeith I, Ince P, Perry R, O‘Brien J, White matter lesions on magnetic resonance imaging in dementia with Lewy bodies, Alzheimer‘s disease, vascular dementia, and normal aging. J Neurol Neurosurg Psychiatry 1999; 67(1):66–72.
3 Burton EJ, McKeith IG, Burn DJ, Firbank MJ, O‘Brien JT, Progression of white matter hyperintensities in Alzheimer disease, dementia with lewy bodies, and Parkinson disease dementia: a comparison with normal aging. Am J Geriatr Psychiatry. 2006; 14(10):842–9.
4 Yoshita M, Fletcher E, Harvey D, Ortega M, Martinez O, Mungas DM, Reed BR, DeCarli CS, Extent and distribution of white matter hyperintensities in normal aging, MCI, and AD. Neurology 2006 Dec 26; 67(12):2192–8.
5 Holland CM, Smith EE, Csapo I, Gurol ME, Brylka DA, Killiany RJ, Blacker D, Albert MS, Guttmann CR, Greenberg SM, Spatial distribution of white-matter hyperintensities in Alzheimer disease, cerebral amyloid angiopathy, and healthy aging. Stroke 2008; 39(4):1127–33.
6 Lee DY, Fletcher E, Martinez O, Zozulya N, Kim J, Tran J, Buonocore M, Carmichael O, DeCarli C, Vascular and degenerative processes differentially affect regional interhemispheric connections in normal aging, mild cognitive impairment, and Alzheimer disease. Stroke. 2010 Aug; 41(8):1791–7.
7 Carmichael O, Schwarz C, Drucker D, Fletcher E, Harvey D, Beckett L, Jack CR Jr, Weiner M, DeCarli C, Alzheimer‘s Disease Neuroimaging Initiative. Longitu dinal changes in white matter disease and cognition in the first year of the Alzheimer disease neuroimaging initiative. Arch Neurol 2010; 67(11):1370–8.
8 Schmidt R, Comparison of magnetic resonance imaging in Alzheimer’s Disease, vascular dementia and normal aging. Eur Neurol 1992; 32(3):164–9.
9 Waldemar G, Christiansen P, Larsson HB, Høgh P, Laursen H, Lassen NA, Paulson OB, White matter magnetic resonance hyperintensities in dementia of the Alzheimer type: morphological and regional cerebral blood flow correlates. J Neurol Neurosurg Psychiatry 1994; 57(12):1458–65.
10 Fazekas F, Kapeller P, Schmidt R, Offenbacher H, Payer F, Fazekas G, The relation of cerebral magnetic resonance signal hyperintensities to Alzheimer‘s disease. J Neurol Sci 1996; 142(1–2):121–5.
11 Erkinjuntti T, Gao F, Lee DH, Eliasziw M, Merskey H, Hachinski VC, Lack of difference in brain hyperinten sities between patients with early Alzheimer‘s disease and control subjects. Arch Neurol 1994 Mar; 51(3):260–8.
12 Pettersen JA, Sathiyamoorthy G, Gao FQ, Szilagyi G, Nadkarni NK, St George-Hyslop P, Rogaeva E, Black SE, Microbleed topography, leukoaraiosis, and cognition in probable Alzheimer disease from the Sunnybrook dementia study. Arch Neurol 2008; 65(6):790–5.
13 Atri A, Locascio JJ, Lin JM, Yap L, Dickerson BC, Grodstein F, Irizarry MC, Growdon JH, Greenberg SM, Prevalence and effects of lobar microhemorrhages in early-stage dementia. Neurodegener Dis 2005; 2(6):305–12.
14 Cordonnier C, van der Flier WM, Sluimer JD, Leys D, Barkhof F, Scheltens P, Prevalence and severity of microbleeds in a memory clinic setting. Neurology 2006; 66:1356–1360.
15 Poels MM, Ikram MA, van der Lugt A, Hofman A, Krestin GP, Breteler MM, Vernooij MW, Incidence of cerebral microbleeds in the general population: the Rotterdam Scan Study. Stroke 2011; 42(3):656–61.
16 Goos JDC, Henneman WJP, Sluimer JD, Vrenken H, Sluimer IC, Barkhof F, Blankenstein MA, Scheltens PH, van der Flier WM, Incidence of cerebral microbleeds. A longitudinal study in a memory clinic population. Neurology 2010; 74:1954–1960.
17 Henneman WJ, Sluimer JD, Cordonnier C, Baak MM, Scheltens P, Barkhof F, van der Flier WM, MRI biomarkers of vascular damage and atrophy predicting mortality in a memory clinic population. Stroke. 2009 Feb; 40(2):492–8.