ÖGN 2012: Schlaganfall-Prodromi: Unterschätzen wir die Häufigkeit vaskulärer Hirnschäden?
In ausgeprägterer Form sind „white matter lesions“ neben lakunären Infarkten und Mikroblutungen auch ein Teil jener morphologischen Veränderungen, die mit zerebralen Kleingefäßerkrankungen assoziiert werden. Derartige fleckförmige oder gar konfluierende Marklagerveränderungen haben dann Bedeutung als Ursache oder zumindest Risikofaktor für die raschere Entwicklung kognitiver Beeinträchtigung, von Gehstörungen aber auch von Depression.1, 2
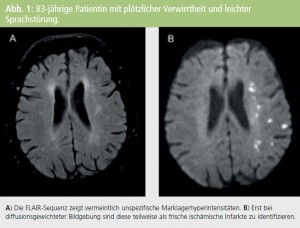
Grundsätzlich wird angenommen, dass sich die „white matter lesions“ oder „white matter hyperintensities“ allmählich entwickeln, entweder aufgrund einer Permeabilitätsstörung geschädigter Gefäßwände und/ oder einer globalen Minderdurchblutung entstehen und sich allmählich ausdehnen. Bei PatientInnen mit weniger ausgeprägtem Schlaganfall oder transienter ischämischer Attacke finden sich aber immer wieder auch kleine akute ischämische Läsionen, die letztendlich bei Verlaufsuntersuchungen von derartigen „white matter lesions“ nicht abzugrenzen sind. Es ist daher durchaus wahrscheinlich, dass ein Teil der Marklagerveränderungen auch aus einer akuten fokalischämischen Schädigung resultiert (Abb. 1).
Klinisch stumme Infarkte
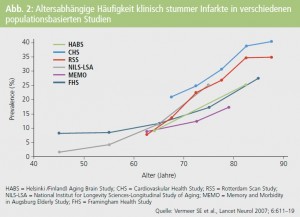
Auch die hohe Rate klinisch stummer Infarkte, die in bevölkerungsbasierten Untersuchungen berichtet wird, stimmt nachdenklich in Bezug auf das ausreichende Erkennen vaskulärer Gehirnschäden.3 Diese wird in Populationen mit einem mittleren Lebensalter von 60–75 Jahren zwischen 8 und 28 % angegeben und steigt, wie zu erwarten, mit zunehmendem Lebensalter an (Abb. 2). Noch deutlich häufiger sind stumme Hirninfarkte bei der Untersuchung von Risikogruppen, das heißt etwa von PatientInnen mit hohem Blutdruck, mit einem Diabetes mellitus, koronarer Herzkrankheit oder anderen Risikofaktoren für eine Gefäßerkrankung. Dann liegt die Häufigkeit stummer Hirninfarkte sogar zwischen 30 und 40 %.
Selbst bei der Untersuchung jüngerer PatientInnen mit Schlaganfall finden sich schon häufig stumme Hirninfarkte. In der so genannten SIFAP-Studie (Stroke-in-Young-Fabry- Patients-Studie), welche Personen mit einem Schlaganfall im Alter von 18 bis 55 Jahren untersuchte, konnten wir in der Altersgruppe von 18–24 Jahren bei 8 % der Personen ohne erinnerbares vorhergehendes zerebrovaskuläres Ereignis einen alten Infarkt nachweisen. In der Altersgruppe von 45–55 Jahren zeigte sogar bereits ein Viertel der PatientInnen mit einem klinisch erstmaligen Schlaganfall oder einer transienten ischämischen Attacke (TIA) alte Infarkte.
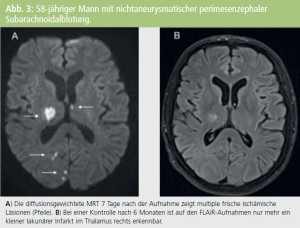
Dabei ist anzunehmen, dass wir nur einen Teil fokaler ischämischer Schäden mit Parenchymuntergang auch tatsächlich als Infarkte erkennen. So mehren sich die Untersuchungen, die darauf hinweisen, dass akute lakunäre Infarkte, d. h. subkortikale ischämische Schädigungen mit einem Durchmesser < 1,5 cm, nach mehreren Monaten bis Jahren zu einem guten Teil überhaupt nicht mehr als Infarkte zu erkennen sind.4 Das Gleiche gilt vermutlich auch für kleine kortikale ischämische Läsionen, wie neuropathologische Untersuchungen und eigene Beobachtungen vermuten lassen5 (Abb. 3).
Bei all diesen Hinweisen auf eine wesentlich häufigere und offensichtlich auch akute vaskuläre Schädigung des Gehirns als klinisch vermutet, bestehen zwei wesentliche Erklärungsmöglichkeiten:
Zum einen können die morphologisch nachweisbaren Schäden klinisch tatsächlich völlig stumm verlaufen sein. Dies erscheint insbesondere dann wahrscheinlich, wenn Hirnareale betroffen sind, die keine unmittelbare klinische Repräsentanz besitzen. In diesen Fällen wird durch die Gewebszerstörung oft wohl nur eine gewisse Beeinträchtigung der Netzwerkfunktionen im Gehirn bewirkt, woraus keine unmittelbare Beeinträchtigung, aber möglicherweise eine Reduktion im Kompensationsvermögen anderer und weiterer Schäden des Gehirns resultiert. Dies dürfte auch erklären, warum Verluste komplexerer zerebrale Fähigkeiten bei vaskulär vorgeschädigtem Gehirn mit höherer Wahrscheinlichkeit auftreten. Es besteht aber auch die Möglichkeit, dass wir aus klinischer Sicht die Korrelate einer akuten vaskulären Schädigung oft nicht richtig erkennen oder deuten, weil sie zu unspezifisch sind.
Transiente ischämische Attacke
Als klare Prodromi eines Schlaganfalls sind uns üblicherweise nur die Symptome der so genannten transienten ischämischen Attacke oder TIA bekannt. Diese wird derzeit noch immer als plötzlich eintretendes fokales neurologisches Defizit – vermutlich ischämischer Ursache – definiert, welches weniger als 24 Stunden anhält.
Mittlerweile wissen wir aus Untersuchungen, vorwiegend mittels MRT und so genannter diffusionsgewichteter Bildgebung, dass auch bei derart kurzem Bestehen neurologischer Symptomatik in etwa einem Drittel der Fälle doch ischämische Areale im Gehirn nachzuweisen sind. Aus diesem Grund wird auch eine Neudefinition der TIA diskutiert, der zufolge als TIA nur Attacken ohne nachweisbare morphologische Schädigung verstanden werden sollten und in der auf die meist weniger als eine Stunde betragende Dauer der klinischen Symptome hingewiesen wird.6 Einige Untersuchungen lassen zudem annehmen, dass recht häufig nicht nur fokale Symptome einen Schlaganfall ankündigen. Solche Daten kommen z. B. aus einer Studie zu möglichen Geschlechtsunterschieden in Bezug auf Prodromalsymptome des Schlaganfalls, in der 1107 konsekutive PatientInnen mit einem akuten ischämischen Schlaganfall befragt wurden. Jene Symptome, die mehr als 24 Stunden vor der Spitalsaufnahme beobachtet wurden, definierten die AutorInnen als Prodromalsymptome. Solche wurden von insgesamt 35 % der PatientInnen berichtet. Klassische Schlaganfallsymptome wie eine halbseitige Schwäche oder ein Taubheitsgefühl, Schwierigkeiten beim Sprechen oder Sehprobleme wurden zwar von über 90 % der Betroffenen berichtet. Daneben gaben 75 % der Frauen und 65 % der Männer aber auch eine oder mehrere diffuse Beschwerden wie Kopfschmerzen, Übelkeit, Müdigkeit, Verhaltensänderungen oder Schwierigkeiten im Verstehen an.7
Transiente neurologische Attacke
In der bevölkerungsbasierten Rotterdam-Studie wurde darüber hinaus die Wertigkeit von nicht klar als fokal neurologisch definierbaren Symptomen in Hinblick auf das Risiko eines nachfolgenden Schlaganfalls, einer ischämischen Herzerkrankung oder der Entwicklung einer Demenz untersucht. Als so genannte diffuse transiente neurologische Attacke (TNA) wurden u. a. Bewusstseinseintrübung, Verwirrtheit, Unsicherheit und diffuser Schwindel gewertet. Über einen Beobachtungszeitraum von 11–14 Jahren zeigte sich, dass nicht nur Personen mit einer fokalen TNA (definiert wie eine TIA) ein höheres Schlaganfallrisiko aufwiesen, sondern auch solche, die mindestens einmal eine diffuse TNA erlitten hatten. Das höchste Schlaganfallrisiko hatten interessanterweise jene Personen, bei denen sowohl fokale als auch nichtfokale (diffuse) TNA aufgetreten waren.8
Resümee
Zusammenfassend kann festgestellt werden, dass mittels moderner Bildgebung diffuse und fokale zerebral ischämische Schäden häufiger nachweisbar sind, als wir dies klinisch vermuten. Ein Teil dieser Veränderungen dürfte sich wohl chronisch entwickeln oder wirklich auch akut ohne entsprechende Symptomatik auftreten. Zu einem gewissen Teil sind fokalischämische Hirnschäden vermutlich aber auch mit diffuseren Symptomen verbunden, die wir klinisch nicht als fokalneurologisches Ereignis einstufen und entsprechend unserem derzeitigen Verständnis nicht unbedingt mit einer fokalen zerebralen Ischämie assoziieren würden. Es erscheint daher gerechtfertigt, vor allem in Hochrisikogruppen, d. h. bei Personen mit vermutlicher Prädisposition für vaskuläre Erkrankungen, auch bei unspezifischen Symptomen öfter an ein fokalzerebrales ischämisches Ereignis zu denken und eine entsprechende MRT-Untersuchung großzügiger zu indizieren.
1 Schmidt R et al., MRI detected white matter lesions: do they really matter? J Neural Transmission 2011; 118:673–681.
2 The LADIS Study Group. 2001–2011: a decade of the LADIS (Leukoaraiosis And DISability) Study: what have we learned about white matter changes and small-vessel disease? Cerebrovasc Dis 2011; 32:577–588.
3 Vermeer SE, Longstreth WT Jr., Koudstaal P, Silent brain infarcts: a systematic review, Lancet Neurol 2007; 6:611–19.
4 Koch S, McClendon MS, Bhatia R, Imaging evolution of acute lacunar infarction: leukoaraiosis or lacune? Neurology 2011; 77:1091–1095.
5 Smith EE et al., Cerebral microinfarcts: the invisible lesions. Lancet Neurol 2012; 11:272–282.
6 Easton JD et al., Definition and evaluation of transient ischemic attack – A Scientific Statement for Healthcare Professionals. Stroke 2009; 40:2276–2293.
7 Stuart-Shor EM et al., Gender differences in presenting and prodromal stroke symptoms. Stroke 2009; 40:1121–1126.
8 Bos MJ et al., Incidence and prognosis of transient neurological attacks. JAMA 2007; 298:2877–2885.