EHA 2012: Myelodysplastisches Syndrom, MDS
Biologie
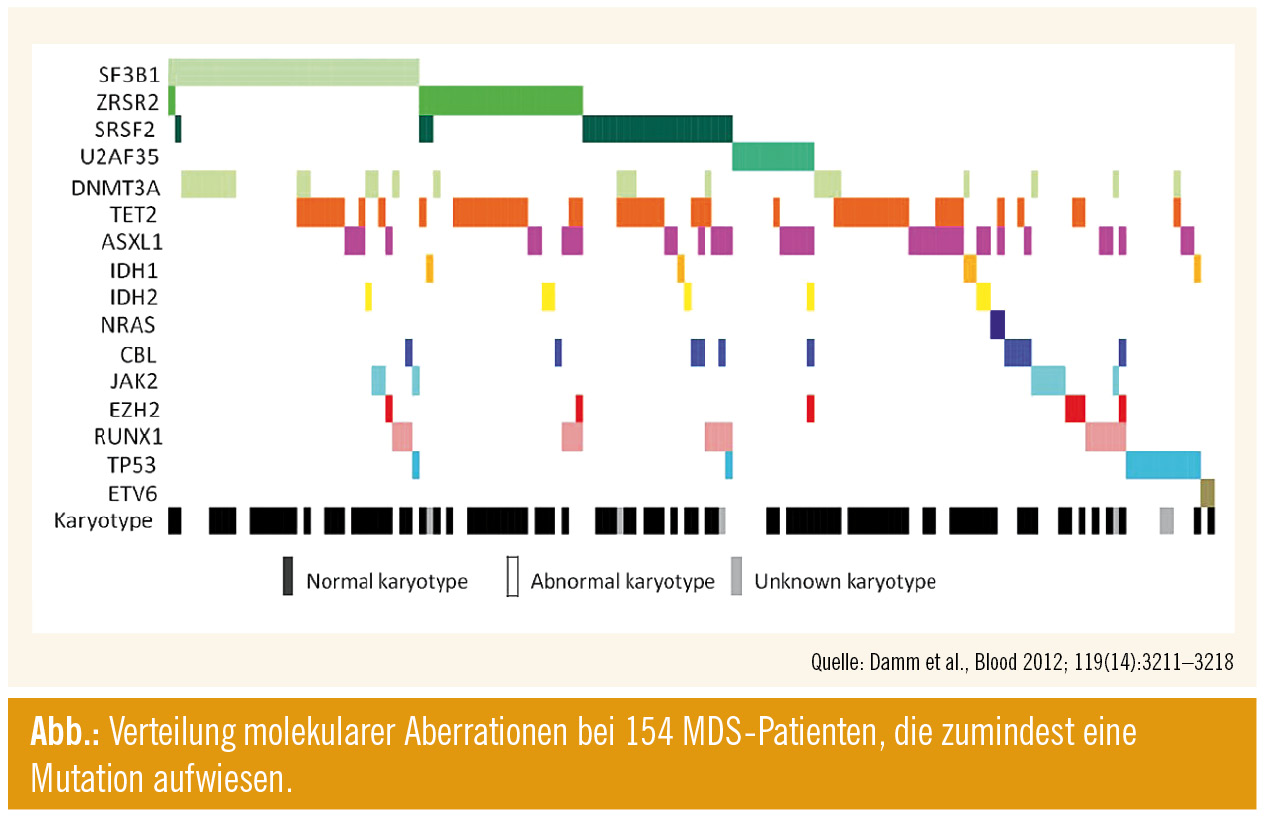
Nachdem 2011 die Erstbeschreibung der Bedeutung von somatischen Mutationen im Splicing-Apparat erfolgte, war diesem wesentlichen Phänomen in der Pathogenese des MDS heuer bereits eine ganze Session gewidmet. Ca. 40–50 % aller MDS-Patienten weisen eine solche Mutation auf, wobei die häufigsten SF3B1 (15 %), SRSF2 (10 %), ZRSR2 (10 %) und U2AF35 (5 %) sein dürften. Auch konnte die Assoziation von SF3B1-Mutationen mit dem Vorhandensein von Ringsideroblasten bestätigt werden, vor allem mit dem Phänotyp RARS (ca. 80 % aller Patienten). Diese Patienten wiesen auch eine überdurchschnittlich gute Prognose auf. Weitere Analysen zeigten bei diesen Patienten die Herunterregulierung von Genen, die die mitochondrialen Funktionen beeinflussen.
Zudem scheinen diese Mutationen nahezu nie kombiniert vorzuliegen; illustriert wird dies in der Abbildung. Interessanterweise findet man diese Spliceosom-Mutationen in geringer Frequenz auch bei anderen Neoplasien (z. B. AML 5 %, CLL 5 %, Mammakarzinom 1 %, Nierenzellkarzinom 3 %), wobei deren Bedeutung dort noch nicht eindeutig determiniert werden kann; bei der CLL konnte jedoch bereits gezeigt werden, dass das Vorliegen einer SF3B1-Mutation mit einem aggressiveren Krankheitsverlauf assoziiert ist.
Schließlich konnten eindeutige Korrelationen mit epigenetischen Regulatoren detektiert werden, wie beispielsweise SF3B1 und DNMT3A (Details in Abb.).
Auch zu den Mutationen dieser epigenetischen Regulatorgene wurden neue Daten, auch teilweise mit bereits klinischer Relevanz präsentiert. Bereits bekannt war, dass TET2 das am häufigsten mutierte Gen ist, nämlich bei 25 % aller MDS- und 50 % aller CMML-Patienten. Neue Analysen zeigen, dass TET2 ein Tumorsuppressorgen sein dürfte und dass die TET2-Mutation bei zugleich JAK2-mutierten Patienten (CMML und andere MPN) früher auftreten dürfte. Zufällig konnte auch nachgewiesen werden, dass TET2 bei gewissen seltenen T-Zell-Lymphomen gehäuft mutiert ist (33 % bei peripheren T-Zell-Lymphomen, AILD).
Während TET2-Mutationen häufig mit einem unauffälligen Karyotyp assoziiert sind, weisen Patienten mit TP53-Mutationen häufig einen komplexen Karyotyp, einen höheren Blastzellgehalt im Knochenmark, verminderte Thrombozytenzahlen und ein signifikant verkürztes Überleben auf. Patienten mit einer gleichzeitigen Deletion 5q und einer TP53-Mutation dürften zudem von einer immunmodulatorischen Therapie mit Lenalidomid nicht profitieren.
Therapie und Prognose
Eisenchelation: Dass adäquate Eisenchelation bei transfusionsbedingter Eisenüberladung eine sinnvolle Therapieoption bei vielen MDS-Patienten darstellt, ist durch eine gute Datenlage untermauert. Durch Elimination des überschüssigen Eisens kann eine Verbesserung diverser Organfunktionen, im speziellen von Herz und Leber, erreicht werden. Nun mehren sich die Berichte, so auch bei diesem Meeting, dass es zu Verbesserung der Zytopenien kommen kann, wenn eine konsequente Chelationsbehandlung durchgeführt wird. Dies konnte zuletzt auch in einer Post-hoc-Analyse der EPIC-Studie dokumentiert werden, je nach Zellreihe war ein Ansprechen zwischen 15 und 22 % zu beobachten. Zudem zeigen viele retrospektive Registerdaten eine Verbesserung des Gesamtüberlebens für diese Patienten. Um jedoch den Bias auszuschließen, dass per se nur Patienten mit primär besserer Prognose adäquat cheliert werden, sind hier prospektiv randomisierte Studien zu fordern.
5-Azacytidin: Entgegen ersten Berichten vom ASH 2010 scheinen EPO-refraktäre Patienten durch eine zugegeben erfolgreiche 5-Azacytidin-Behandlung nicht sensitiv auf eine EPO-Wiederbehandlung zu werden.
GEPARD-Studie: Neuerlich wurde im Rahmen einer Posterpräsentation gezeigt, dass Histondeazetylase-Inhibitoren in der Monotherapie keinen wirklichen Stellenwert in der Behandlung des MDS haben dürften. Präsentiert wurde die deutsche GEPARD-Studie, die 40 mg Panobinostat 3-mal wöchentlich bei 34 Niedrigrisiko-MDS-Patienten untersuchte und nahezu keinerlei objektives Ansprechen zeigen konnte (keine CR oder PR, 1 HI-E bei insgesamt 18 auswertbaren Patienten) – bei jedoch erheblicher Toxizität. Für eine eventuelle Kombinationstherapie wird eine Dosis von 20 mg 3-mal pro Woche empfohlen.
TPO-Rezeptor-Agonisten: Für Patienten aller Risikogruppen mit ausgeprägter Thrombozytopenie gibt es möglicherweise einen Silberstreif am Horizont. Nachdem im Frühjahr 2011 die initial vielversprechende Phase-III-Studie mit dem TPO-Rezeptor-Agonisten Romiplostim aufgrund vermehrter AML-Übergänge im experimentellen Arm vorzeitig gestoppt werden musste, wurde die Weiterentwicklung dieser Substanz beim MDS eingestellt.
Beim EHA-Meeting wurden im Rahmen einer oralen Sitzung erste präliminäre Ergebnisse einer randomisierten, placebokontrollierten multizentrischen Studie mit dem oralen TPO-Rezeptor-Agonisten Eltrombopag bei Niedrigrisiko-MDS-Patienten mit Thrombozytenwerten unter 30.000/µl präsentiert. Die Starttagesdosis betrug 50 mg und konnte schrittweise bis auf 300 mg erhöht werden. Von den ersten 9 Patienten im Prüfarm sprachen 6 an, 5 erzielten sogar eine komplette Remission, definiert durch eine Thrombozytenzahl > 100.000/µl. Die mediane Tagesdosis betrug 50 mg und das Ansprechen konnte bereits spätestens nach 2 Wochen beobachtet werden. Die Verträglichkeit war insgesamt sehr gut, insbesondere war bisher keinerlei Progression der Grunderkrankung zu beobachten. Bei geplanten 70 Patienten ist demnächst, eventuell bereits beim ASH-Meeting, mit reiferen Daten zu rechnen. So könnte uns in absehbarer Zeit eine attraktive Behandlungsmöglichkeit bei MDS-Patienten mit bedrohlicher Thrombozytopenie zur Verfügung stehen.