Psychiatrische Störungen bei Epilepsie
Die Einteilung von psychiatrischen Störungen bei Epilepsiepatienten erfolgt gemäß ihrer zeitlichen Beziehung zu den epileptischen Anfällen und deren Behandlung (Abb.). So können psychiatrische Störungen entweder in einer fixen zeitlichen Beziehung zu den Anfällen auftreten (man unterscheidet dabei präiktale, iktale und postiktale psychiatrische Störungen) oder sich unabhängig vom Auftreten der Anfälle manifestieren (interiktale psychiatrische Störung). In seltenen Fällen kommt es ausschließlich in Phasen der Anfallsfreiheit zu psychiatrischen Störungen, während diese bei Wiederauftreten der Anfälle remittieren (alternative psychiatrische Störung). Schließlich können psychiatrische Störungen auch durch Antiepileptika verursacht oder verschlechtert werden1.
Epilepsie und Depressionen
Epidemiologie
Die Depression stellt die häufigste psychiatrische Begleiterkrankung bei Epilepsie dar. Die Häufigkeit von Depressionen korreliert dabei mit der Anfallskontrolle: Sie liegt zwischen 3 und 9% bei gut kontrollierter Epilepsie, jedoch zwischen 20 und 55% bei Patienten mit therapieresistenten Epilepsien. Bei Epilepsiepatienten besteht eine im Vergleich zur Allgemeinbevölkerung 10-fach erhöhte Suizidrate.
Umgekehrt belegen mehrere Studien, dass eine positive Anamnese für eine Depression einen signifikanten Risikofaktor für das Neuauftreten einer Epilepsie darstellt. Eine positive Anamnese für eine Major Depression erhöht das Risiko für das Auftreten von unprovozierten Anfällen um einen Faktor 1,7. Patienten nach einem Suizidversuch haben ein 5,1-fach erhöhtes Risiko unprovozierte Anfälle zu erleiden3, 4.
Gemeinsame Pathomechanismen von Epilepsie und Depression
Die bidirektionale Beziehung zwischen Epilepsie und Depression könnte durch gemeinsame Pathomechanismen beider Erkrankungen erklärt werden. Hier sind einerseits eine veränderte serotoninerge, noradrenerge, dopaminerge und GABAerge Neurotransmission sowie andererseits strukturelle und funktionelle Veränderungen im mesialen Temporallappen, im orbitofrontalen Kortex und im Bereich subkortikaler Strukturen bei beiden Erkrankungen anzuführen3.
Für die Bedeutung einer veränderten serotoninergen, noradrenergen, dopaminergen und GABAergen Neurotransmission bei Epilepsie und Depression sprechen dabei die folgenden Befunde:
- Ein Tiermodell der sogenannten genetic epilepsy-prone rats (GEPR-3 und GEPR-9) ist durch eine angeborene Störung der prä- und postsynaptischen serotoninergen und noradrenergen Transmission gekennzeichnet. Klinisch bestehen bei diesen Tieren akustisch ausgelöste generalisierte tonisch-klonische Anfälle und besonders bei den GEPR-9 ein deutlich beschleunigtes Kindling. Zudem zeigen die Tiere endokrine Störungen ähnlich wie depressive Patienten (u. a. erhöhte Kortisolspiegel, mangelnde Sekretion von Wachstumshormonen sowie eine Hypothyreose). Während Substanzen, die die serotoninerge und noradrenerge Transmission beeinträchtigen, eine Anfallsexazerbation nach sich ziehen, führen Substanzen, die die serotoninerge Transmission verbessern wie SSRI zu einer Reduktion der Anfallsfrequenz.
- Verschiedene Antiepileptika (Carbamazepin, Valproinsäure, Lamotrigin) wirken auch serotoninerg. Zudem kann bei GEPR der antikonvulsive Effekt von Carbamazepin durch eine Serotonin-Depletion blockiert werden.
- Die antikonvulsive Wirksamkeit der Vagus-Nerv-Stimulation wird wahrscheinlich durch eine Aktivierung von noradrenergen Neuronen im Locus coeruleus vermittelt. Dieser Mechanismus dürfte auch für die antidepressiven Effekte der Vagus-Nerv-Stimulation verantwortlich sein.
- In klinischen Studien konnte bei Patienten mit Temporallappenepilepsie mittels des Serotonin-Rezeptor-Liganden [11C]WAY-100 635 in der Positron- Emmissions-Tomographie (PET) eine reduzierte Serotonin-Bindung im Hippocampus und Corpus amygdaloideum ipsilateral zum epileptischen Fokus nachgewiesen werden, und zwar auch bei normalem MRT und FDG-PET. Eine reduzierte Bindung zeigte sich auch im anterioren Gyrus cinguli, im Inselkortex und im lateralen temporalen Kortex ipsilateral zum epileptischen Fokus sowie im kontralateralen Hippocampus und in den Raphekernen, d. h. in den Projektionsgebieten des epileptischen Hippocampus. Zudem fand sich eine signifikante negative Korrelation zwischen der Serotonin-Bindung im ipsilateralen Gyrus cinguli und den Montgomery Asberg Depressionsscores.
Sowohl bei Epilepsien als auch bei Depressionen finden sich strukturelle und funktionelle Veränderungen im mesialen Temporallappen, im orbitofrontalen Kortex und im Bereich subkortikaler Strukturen:
- Die mesiale Temporallappenepilepsie ist die häufigste Epilepsieform überhaupt, das pathologisch-anatomische Substrat ist die mesiale Temporallappensklerose (MTS). Patienten mit mesialer Temporallappenepilepsie zeigen signifikant höhere Depressionsscores als Patienten mit neokortikalen temporalen Läsionen. Bei Patienten mit rechtsseitiger mesialer Temporallappenepilepsie ergab sich eine negative Korrelation zwischen dem Volumen des linken Hippocampus und Depressionsscores, d. h. Patienten mit rechtsseitiger mesialer Temporallappenepilepsie und Depression haben einen kleineren linken Hippocampus. Zudem besteht eine signifikante Korrelation zwischen dem Ausmaß von hippocampalen Veränderungen in der Proton-MR-Spektroskopie und dem Schweregrad einer Depression bei Patienten mit Temporallappenepilepsie. In einer rezenten Studie konnte eine signifikante positive Korrelation zwischen dem Volumen des Corpus amygdaloideum und dem Schweregrad einer begleitenden Depression bei Patienten mit Temporallappenepilepsie nachgewiesen werden.
- Bei Patienten mit positiver Depressionsanamnese konnten in der Phase der Remission verminderte Volumina der Hippocampusformationen nachgewiesen werden, wobei sich eine signifikante Korrelation zwischen dem Hippocampusvolumen und der Depressionsdauer zeigte. Die Entwicklung einer Hippocampusatrophie konnte durch die Gabe von Antidepressiva verhindert werden, was auf einen neuroprotektiven Effekt von Antidepressiva hinweist. Als pathogenetische Mechanismen für die Entwicklung einer Hippocampusatrophie bei Depressionen werden einerseits eine erhöhte Glucokortikoid-Exposition durch exzessive Aktivierung der Hypothalamus-Hypophysen-Nebennierenachse diskutiert, wie sie bei nahezu der Hälfte der Patienten mit Depressionen gefunden werde. Im Tierexperiment konnte eine Schädigung hippocampaler Neurone unter prolongierter Glukokortikoid-Exposition nachgewiesen werden. Zudem könnte die Hippocampusatrophie auch über den Brain Derived Neurotrophic Factor (BDNF) vermittelt werden. BDNF ist ein neuronaler Wachstumsfaktor, der über Protein-Tyrosin-Kinase-Rezeptoren (TrkA, TrkB, TrkC und p75) eine vermehrte Neurogenese bewirkt. Akuter und chronischer Stress führt zu einer Konzentrationsabnahme des BDNF im Gyrus dentatus, der Pyramidenzellschicht des Hippocampus, im Corpus amygaloideum und im Neokortex und in weiterer Folge zu einer Hippocampusatrophie. Die chronische Applikation von Antidepressiva kann die durch Stress verursachte Abnahme von BDNF verhindern. In Postmortem-Untersuchungen konnte bei depressiven Patienten unter antidepressiver Medikation eine erhöhte BDNF-Immunoreaktivität im mesialen Temporallappen nachgewiesen werden.
- Patienten mit einer neu-diagnostizierten Epilepsie und einer positiven Anamnese für eine Depression haben eine 2,27-fach geringere Chance, unter einer antiepileptischen Therapie anfallsfrei zu werden als Patienten ohne eine Depression in der Anamnese. Zudem stellt eine anamnestisch zu erhebende Depression einen negativen Prognosefaktor für Anfallsfreiheit nach einem epilepsiechirurgischen Eingriff dar. Diese Studien legen nahe, dass eine Depression zu einer Augmentation von neuropathologischen Veränderungen bei der Temporallappenepilepsie führt sowie negative Effekte auf den Verlauf und die Behandelbarkeit einer Epilepsie besitzt.
- Bei Temporallappenepilepsie mit einer begleitenden Depression findet man im FDG-PET einen verminderten orbitofrontalen Glucosemetabolismus. Bei Patienten mit Depression konnte in SPECT- und PET-Studien ein verminderter regionaler zerebraler Blutfluss und ein verminderter Glucosemetabolismus im präfrontalen Kortex und im anterioren Gyrus cinguli nachgewiesen werden. Quantitative MRI-Studien zeigten bei Patienten mit Depression signifikante Volumenverminderungen medial orbitofrontal im Bereich des Gyrus rectus. In guter Übereinstimmung dazu fanden sich bei älteren depressiven Patienten Volumensverminderungen im anterioren Gyrus cinguli, im Gyrus rectus und im orbitofrontalen Kortex. Schließlich konnte in Post-mortem-Untersuchungen bei depressiven Patienten eine verminderte Kortexdicke, ein reduziertes Volumen der Neurone sowie verminderte neuronale und gliale Zelldichten in den Schichten II bis IV des rostralen orbitofrontalen Kortex nachgewiesen werden. Im kaudalen orbitofrontalen Kortex waren die gliale Zelldichte und das Volumen der Neurone in den Schichten V bis VI vermindert. Zudem zeigte sich im dorsolateralen präfrontalen Kortex eine verminderte neuronale und gliale Zelldichte in den supra- und infragranulären Schichten.
Diagnostik von Depressionen bei Epilepsiepatienten
Das Vorliegen und der Schwergrad einer Depression sind die wichtigsten Prädiktoren für die Lebensqualität von Epilepsiepatienten und für die Lebensqualität entscheidender als die Anfallsfrequenz4. Dies unterstreicht die Notwendigkeit einer frühzeitigen Diagnose und Behandlung.
Dennoch werden Depressionen bei Epilepsiepatienten unterdiagnostiziert und unterbehandelt: So waren in einer Studie 60% der Epilepsiepatienten mit Depressionen für mehr als ein Jahr symptomatisch bevor eine Behandlung indiziert wurde. Hierfür können folgende Gründe angeführt werden3, 4:
- Die Patienten dissimulieren ihre Depressivität aus Angst vor weiterer Stigmatisierung.
- Psychiatrische Symptome werden bei Epilepsiepatienten nicht systematisch erhoben. Gemäß einer Umfrage der American Academy of Neurology befragen nur 7% der Neurologen ihre Epilepsiepatienten routinemäßig hinsichtlich des Vorliegens von depres – siven Symptomen.
- Patienten und Ärzte interpretieren die Symptome einer Depression als normale Reaktion bzw. Adaptation an eine chronische Erkrankung.
- Depressionen präsentieren sich bei Epilepsiepatienten oft atypisch und erfüllen nicht die Kriterien einer Major Depression. Blumer5 prägte hierfür den Begriff der “Interiktalen dysphorischen Störung” (IDS), die durch ein chronisch verlaufendes intermittierendes Bild wechselnder heterogener affektiver Symptomatik und die folgenden 8 Schlüsselsymptome gekennzeichnet ist: labile depressive Symptome (depressive Stimmung, Anergie, Schmerzen, Insomnie), labile affektive Symptome (Phobie, Angst) sowie spezifische Symptome (paroxysmale Irritabilität, euphorische Stimmungen). Kanner6 betonte den chronischen Verlauf mit symptomfreien Intervallen und prägte den Begriff der “dysthmic-like disorder of epilepsy”.
- Die typischen Nebenwirkungen von Antiepileptika (z. B. Konzentrationsstörungen, Müdigkeit, Schlafstörungen etc.) sowie neuropsychologische Störungen im Rahmen der Epilepsie (z. B. Gedächtnisstörungen) können die Diagnose einer Depression bei Epilepsiepatienten erschweren. Deshalb wurde kürzlich ein speziell konzipierter Fragebogen zur Diagnose von Depressionen bei Epilepsiepatienten (Neurological Disorders Depression Inventory for Epilepsy-NDDI-E) erarbeitet7, der problemlos in wenigen Minuten angewendet werden kann.
- Angst vor Anfallsexazerbation durch Verabreichung von Antidepressiva, wobei hier betont werden soll, dass das epileptogene Potenzial von Antidepressiva ein vernachlässigbares Risiko darstellt.
Antiepileptika und Suizidalität
Im Jänner 2008 publizierte die U.S. Food and Drug Administration (FDA) eine Warnung, in der auf ein 1,8-fach erhöhtes Risiko für Suizidalität bei der Einnahme von Antiepileptika hingewiesen wurde. Allerdings wies diese Metaanalyse gravierende methodische Mängel auf und konnte in vier nachfolgenden prospektiven Studien nicht nachvollzogen werden, sodass eine antiepileptische Therapie auch bei depressiven Patienten keineswegs hintangehalten werden darf, da dadurch wesentlich größere Risken für den Patienten (u. a. Verletzungsgefahr, SUDEP etc.) entstehen als durch ein fraglich minimal erhöhtes Suizidrisiko.
Epilepsie und Psychosen
Epidemiologie
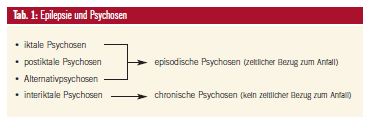
Die Prävalenz psychotischer Störungen bei Epilepsiepatienten liegt zwischen 2 und 8%. Die Einteilung der epileptischen Psychosen erfolgt gemäß ihrem zeitlichen Bezug zum epileptischen Anfall (Tab. 1). Dabei können sogenannte episodische Psychosen (iktale, postiktale und Alternativpsychosen), die in einem fixen zeitlichen Bezug zum Anfallsgeschehen stehen und chronische Psychosen (interiktale Psychosen) ohne zeitlichen Bezug zu den Anfällen unterschieden werden4.
Iktale Psychosen
Iktale Psychosen stellen die klinische Manifestation eines nichtkonvulsiven Status epilepticus (einfach fokaler Status, komplex fokaler Status oder Absencenstatus) dar. Die Symptomatik besteht in Wahnvorstellungen, illusionären Verkennungen, Halluzinationen, zudem können auch affektive Symptome wie panische Angst und depressive Verstimmungen sowie fluktuierende Bewusstseinsstörungen, Automatismen und Lidmyoklonien auftreten. Das EEG liefert den entscheidenden diagnostischen Beitrag.
Postiktale Psychosen
Postiktale Psychosen, die 25% der epileptischen Psychosen repräsentieren, sind durch psychotische und affektive Symptome (paranoide Wahninhalte) charakterisiert, die nach einer, dem Anfallsereignis folgenden, längstens sieben Tage andauernden symptomfreien Periode auftreten (luzides Intervall). Die Symptomatik stellt dabei nicht nur eine Aggravierung des vor dem Anfallsereignis bestehenden psychiatrischen Status oder der Persönlichkeit dar und ist nicht durch andere medizinisch-psychiatrische Ursache erklärbar (z. B. Drogenintoxikation, metabolische Entgleisung etc.). Das Bewusstsein ist nicht wesentlich beeinträchtigt (wie etwa beim Delir), die Symptome sind zeitlich limitiert und dauern üblicherweise Tage, selten Wochen an8.
Alternativpsychosen
Unter Alternativpsychose (Synonym: forcierte Normalisierung, paradoxe Normalisierung) versteht man eine inverse Beziehung zwischen Anfallskontrolle bzw. Normalisierung des EEG einerseits und psychotischen Symptomen andererseits. Landolt9 beschrieb erstmals das Auftreten von psychotischen Episoden bei Normalisierung des EEG und prägte hierfür den Begriff der “forcierten Normalisierung”. Tellenbach10 erweiterte das Konzept auf die Manifestation von Psychosen bei Anfallsfreiheit – womit die Notwendigkeit einer EEG-Untersuchung umgangen wurde – und führte hierfür den Begriff der “Alternativpsychose” ein. Wolf und Trimble11 schlugen den Begriff “paradoxe Normalisierung” vor. Heute wird eine Alternativpsychose definiert durch eine Verhaltensstörung mit akutem/subakutem Beginn begleitet von einer Denk- und Wahrnehmungsstörung, einer signifikante Änderung der Affektivität (Depression oder Manie) sowie einer Angststörung mit Ich-Störung oder dissoziativen Symptomen, die im Zusammenhang mit einer 50%igen Abnahme der Zahl der interiktalen Spikes im EEG im Vergleich zum Vorbefund oder mit einer kompletten Anfallsfreiheit von mindestens einer Woche (berichtet durch einen Außenstehenden) auftritt12. Alternativpsychosen sind selten, sie machen 1% der epileptischen Psychosen aus. Die Pathomechanismen sind unklar, wobei u. a. ein exzessiver Dopamineffekt verantwortlich gemacht wurde. Andere Autoren postulieren eine Rolle des Kindling- Phänomens in der Pathogenese von Alternativpsychosen.
Interiktale Psychosen
Bei den interiktalen Psychosen, die für 20% der epileptischen Psychosen verantwortlich sind, manifestieren sich die psychotischen Symptome zeitlich unabhängig vom Anfallsgeschehen. Nur 50-70% der Patienten erfüllen die diagnostischen Kriterien einer Schizophrenie, insbesondere besteht keine Negativsymptomatik (Apathie, Affektverflachung, Anhedonie, …), die Persönlichkeit und die interpersonellen Beziehungen bleiben erhalten. Illusionäre Verkennungen, religiöse Anmutungserlebnisse und paranoid- halluzinatorische Symptome stehen im Vordergrund. Insgesamt ist die Symptomatik milder und der Verlauf günstiger als bei einer Schizophrenie. Dies konnte auch in einer rezenten prospektiven Studie bestätigt werden, in der Epilepsiepatienten mit interiktalen Psychosen und Schizophreniepatienten hinsichtlich Psychopathologie und Krankheitsverlauf systematisch verglichen wurden. Die Epilepsiepatienten wiesen in der negativen Subskala der Positive and Negative Syndrome Scale (PANSS) signifikant niedrigere Werte auf als die Schizophreniepatienten. Die Ansprech- und Remissionsraten nach einer Beobachtungszeit von einem Jahr waren bei den Epilepsiepatienten höher als bei den Schizophreniepatienten, ebenso waren die erforderlichen Neuroleptika-Dosen signifikant niedriger.
Angststörungen
Die Prävalenz von Angststörungen bei Epilepsiepatienten liegt zwischen 15 und 25%1. Angststörungen bei Epilepsiepatienten können wie folgt klassifiziert werden (Tab. 2): Präiktale Angst (Prodromalphase mit Angst Stunden bis Tage vor einem Anfall), iktale Angst (verursacht durch epileptische Aktivität im Corpus amygdaloideum, im anterioren Gyrus cinguli, im orbitofrontalen und präfrontalen Kortex), postiktale Angst (Angst nach einem Anfall für die Dauer von Stunden bis Tagen) und interiktale Angst (Angst im Rahmen einer Komorbidität von Angsterkrankung und Epilepsie; Angst als iatrogen verursachte Komorbidität (Nebenwirkung der antiepileptischen oder epilepsiechirurgischen Therapie); Angst als psychologische/ psychodynamische Reaktion auf die Tatsache, an Epilepsie erkrankt zu sein)13. Risikofaktoren für Angststörungen bei Epilepsien sind neurobiologische Faktoren (Temporallappenepilepsie, epileptogene Zone im Bereich des rechten Temporallappens, hohe Anfallsfrequenz sowie schwere Anfälle), pharmakologische Faktoren (Beeinträchtigungen im Stoffwechsel von Norepinephrin, Dopamin, Serotonin, GABA, ACTH und Neuropeptid Y) sowie psychosoziale Faktoren (Angst als psychologische Reaktionen auf die Anfälle und deren Unvorhersehbarkeit, Einschränkungen im Alltagsleben, vermindertes Selbstwertgefühl, Stigma, soziale Ausgrenzung).
resümeePsychiatrische Störungen bei Epilepsie besitzen eine signifikant höhere Prävalenz als in der Allgemeinbevölkerung und bei anderen chronischen Erkrankungen. Umgekehrt stellen psychiatrische Erkrankungen, insbesondere Depressionen, einen Risikofaktor für das Auftreten einer Epilepsie dar. Diese bidirektionale Beziehung lässt auf gemeinsame pathogenetische Mechanismen von Epilepsien und psychiatrischen Erkrankungen schließen. Psychiatrische Störungen beeinträchtigen die Lebensqualität von Epilepsiepatienten oft mehr als die Anfallsfrequenz. Da psychiatrische Störungen bei Epilepsiepatienten unterdiagnostiziert und unterbehandelt werden, stellen die frühzeitige Diagnose und Therapie eine Herausforderung für den behandelnden Neurologen und Psychiater dar.
1) Schmitz B, Depression and mania in patients with epilepsy. Epilepsia 2005; 46 Suppl 4:45-49
2) Tellez-Zenteno JF, Patten SB, Jette N, Williams J, Wiebe S, Psychiatric comorbidity in epilepsy: a population-based analysis. Epilepsia 2007; 48:2336-2344
3) Kanner AM, Depression in epilepsy: a neurobiologic perspective. Epilepsy Curr 2005; 5:21-27
4) Lehner-Baumgartner E, Neuropsychologische und psychiatrische Komorbiditäten bei Epilepsien. J Neurol Neurochir Psychiatr 2009; 10:30-38
5) Blumer D, Altshuler LL, Affective disorders. In: Engel J Jr, Pedley TA, eds. Epilepsy: A Comprehensive Textbook. Philadelphia: Lippincott-Raven, 1997: 2083-2099
6) Kanner AM, Balabanov A, Depression and epilepsy: how closely related are they? Neurology 2002; 58:S27-39
7) Gilliam FG, Barry JJ, Hermann BP, Meador KJ, Vahle V, Kanner AM, Rapid detection of major depression in epilepsy: a multicentre study. Lancet Neurol 2006; 5:399-405
8) Logsdail SJ, Toone BK, Post-ictal psychoses: A clinical and phenomenological description. Brit J Psychiatry 1988; 152:246-252
9) Landoldt H, Some clinical electroencephalographical correlations in epileptic psychosis (twilight states). Electroenceph Clin Neurophysiol 1953; 5:121
10) Tellenbach H, Epilepsie als Anfallsleiden und als Psychose. Über alternative Psychosen paranoider Prägung bei ,forcierter Normalisierung (Landolt) des Elektroencephalogramms Epileptischer. Nervenarzt 1965; 36:190-202
11) Wolf P, Trimble MR, Biological antagonism and epileptic psychosis. Br J Psychiatry 1985; 146:272-276
12) Krishnamoorthy ES, Trimble MR, Sander JW, Kanner AM, Forced normalization at the interface between epilepsy and psychiatry. Epilepsy Behav 2002; 3:303-308
13) Beyenburg S, Mitchell AJ, Schmidt D, Elger CE, Reuber M, Anxiety in patients with epilepsy: Systematic review and suggestions for clinical management. Epilepsy Behav 2005; 7:161-171