Neue Therapieoptionen beim Nierenzellkarzinom
Seit Einführung zielgerichteter Therapien hat sich die Prognose von Patienten mit metastasiertem Nierenzellkarzinom (mRCC) erheblich verbessert. Zahlreiche neue Therapien wurden mittlerweile getestet und haben basierend auf den Ergebnissen der jeweiligen Phase-III-Studien ihren Platz im Therapiealgorithmus gefunden. Die Fülle an neuen Substanzen kann mitunter ein Entscheidungsproblem nach sich ziehen, will man doch die individuell beste Therapie für seinen Patienten auswählen. Das stetige Hinzukommen neuer Therapien wird den derzeit gültigen Algorithmus in den nächsten Jahren noch weiter modifizieren. Mehr denn je ist eine individualisierte Therapieplanung erforderlich, um dem Patienten den größtmöglichen Benefit zukommen zu lassen.
Erstlinientherapie des metastasierten Nierenzellkarzinoms
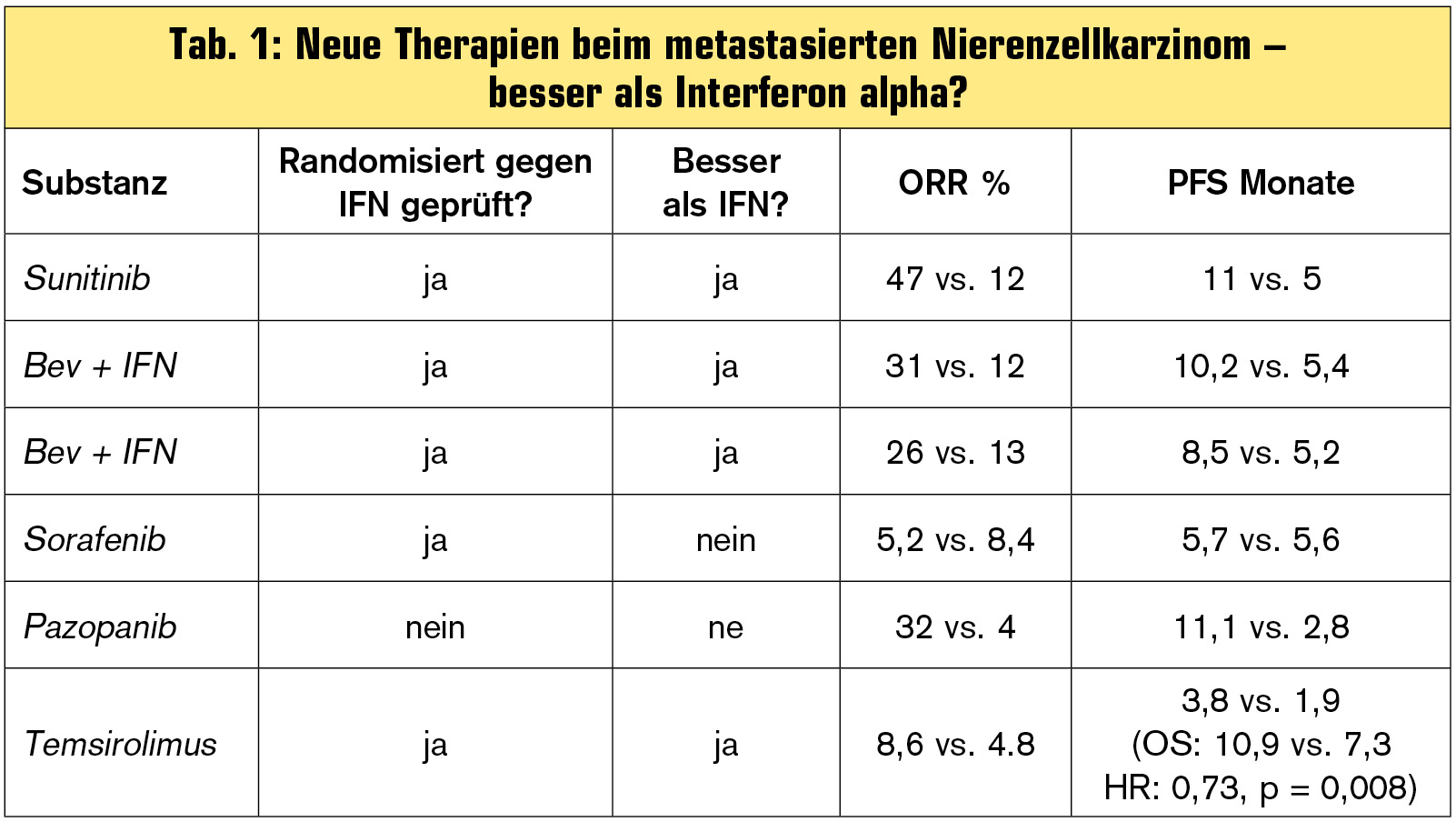
Tab. 1 zeigt die Ergebnisse aus kontrollierten Studien mit Substanzen, die als Erstlinientherapie getestet wurden.
Basierend auf diesen Ergebnissen gibt es für Patienten mit gutem/intermediären Risiko nach MSKCC-Klassifikation drei Optionen in der Erstlinientherapie: Sunitinib oder Bevacizumab + Interferon alpha oder Pazopanib. Für Patienten mit ungünstigem Risikoprofil stellt Temsirolimus die Therapie der Wahl dar. Einen direkten Vergleich dieser drei Optionen für Patienten mit gutem/intermediären Profil gibt es bezüglich Effektivität nicht, bislang wurde im direkten Vergleich lediglich die Patientenpräferenz für Sunitinib oder Pazopanib untersucht.
Therapiewahl für Patienten mit gutem/intermediärem Risikoprofil
Zweitlinientherapie des metastasierten Nierenzellkarzinoms
Nach Versagen einer modernen Erstlinientherapie steht derzeit Everolimus und demnächst der Tyrosinkinaseinhibitor (TKI) Axitinib zur Verfügung. Everolimus war in einer randomisierten, placebokontrollierten Studie ganz eindeutig in Bezug auf das progressionsfreie Überleben (PFS) überlegen. Die meisten Patienten in dieser Studie waren jedoch Drittlinienpatienten (Zytokine gefolgt von einem TKI oder von zwei TKI vor Everolimus). Im Gegensatz dazu wurde Axitinib in einer reinen Zweitlinienpopulation versus Sorafenib getestet. Die Patienten in dieser Studie waren nicht uniform vorbehandelt, die Vortherapien umfassten Sunitinib, Bevacizumab + IFN, Zytokine und Temsirolimus. Das PFS unter Axitinib war signifikant besser als jenes der Patienten im Sorafenib-Arm (6,7 versus 4,7 Monate, HR = 0,665).
Wie schon zuvor in der Erstlinientherapie gestaltet sich nun auch in der Zweitlinientherapie das Integrieren einer neuen Substanz in den Therapiealgorithmus schwierig. Es gibt für beides Argumente.
Auswahl der Zweitlinientherapie
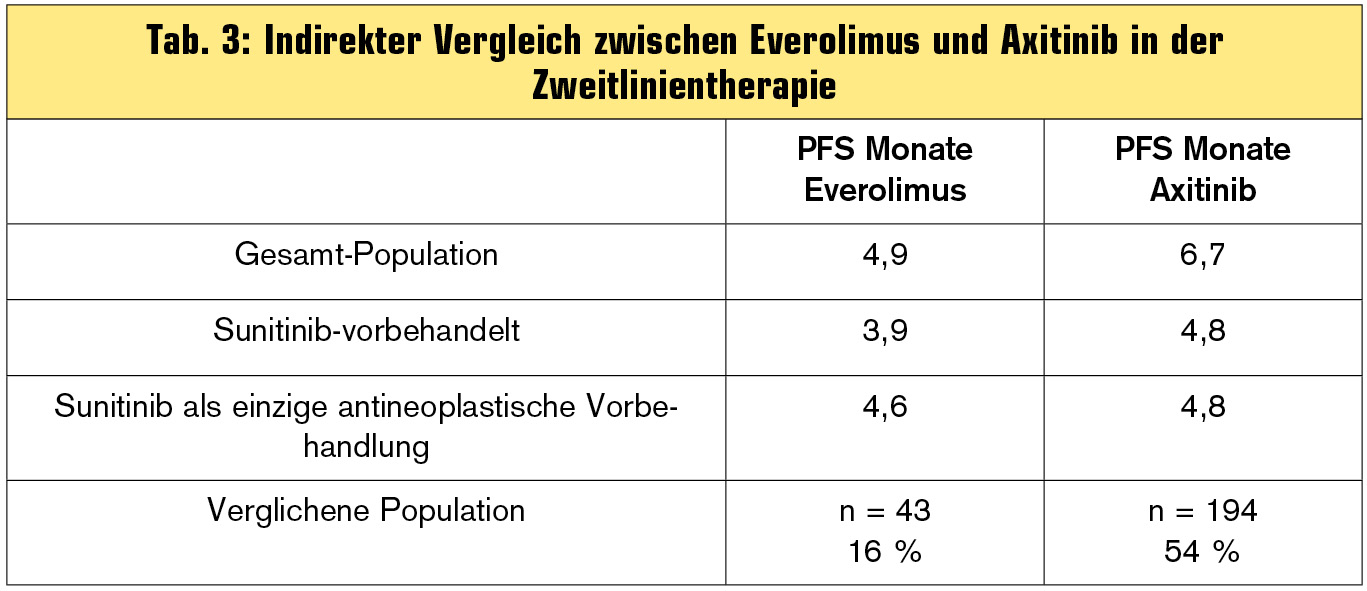
Bei beiden Substanzen gilt es, die Details genau zu betrachten: Für Everolimus gibt es – wie eingangs erwähnt – nur wenig Daten aus einer echten Zweitlinienpopulation, für Axitinib sollte man die Subgruppenergebnisse je nach Vorbehandlung im Detail ansehen. Tab. 3 zeigt hier einen indirekten Vergleich.
Neue Therapien der Zukunft
Viele neue Substanzen werden derzeit untersucht, die zwei bedeutendsten sind vermutlich Tivozanib und Axitinib in früheren Therapielinien.
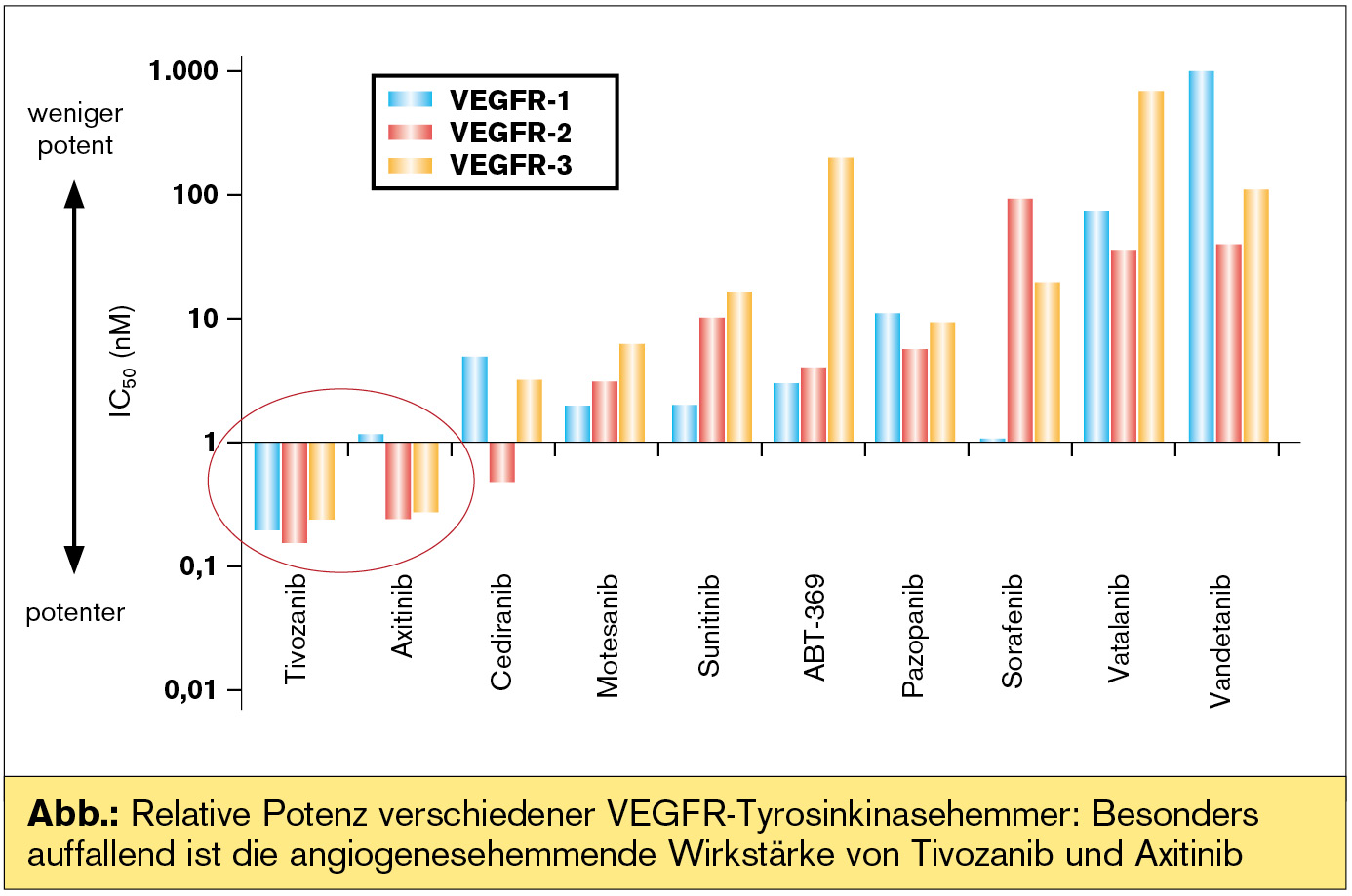
Die Abb. zeigt die Potenz verschiedener VEGFR-TKI an: Hierbei scheinen Tivozanib und Axitinib herausragend zu sein.
Tivozanib ist ein sehr „präziser“ und sehr potenter VEGFR-TKI, der sich durch wenig „Off Target“-Toxizität auszeichnet, das heißt, die beobachteten Toxizitäten umfassen in erster Linie jene, die sich aus einer starken VEGFR-Inhibition ergeben (z. B. Hypertonie). In einer randomisierten Phase-III-Studie hat Tivozanib bei VEGFR- und mTOR-Inhibitor-naiven Patienten einen statistisch signifikanten und klinisch relevanten Vorteil gegenüber Sorafenib gezeigt. Das mediane PFS betrug für Tivozanib 11,9 und für Sorafenib 9,1 Monate (HR = 0,797; 95%-KI 0,639–0,993; p = 0,042). In der Gruppe der therapienaiven Patienten lag dies erwartungsgemäß noch höher: 12,7 versus 9,1 Monate (HR 0,756, 95%-KI 0,580–0,985; p = 0,037). Die Ansprechrate der Gesamtpopulation lag bei 33 % für Tivozanib und 23 % für Sorafenib (p = 0,014).
Axitinib in der Erstlinientherapie: Am ASCO 2012 wurden Daten einer randomisierten Phase-II-Studie zu Axitinib in der Erstlinientherapie präsentiert. Endpunkt der Studie war, ob man mit Dosissteigerung bei Patienten, die keine oder nur wenig Toxizitäten aufwiesen, ein besseres Ergebnis erzielen kann. Diese Daten sind noch nicht vollständig ausgewertet, jedoch zeigen Zwischenanalysen bereits, welch ungeheures Potenzial Axitinib als Erstlinientherapie besitzt: Jene Gruppe ohne Dosissteigerung hatte bereits ein PFS von 16,4 Monaten und Ansprechraten von 59 %. Dies sind bislang unerreichte Ergebnisse beim mRCC: Auch wenn die Zulassung dieser Substanz derzeit auf Zweitlinie ausgerichtet ist, wird diese Therapie sicher sehr bald in die Erstlinientherapie des mRCC integriert werden.
Zusammenfassung und Ausblick
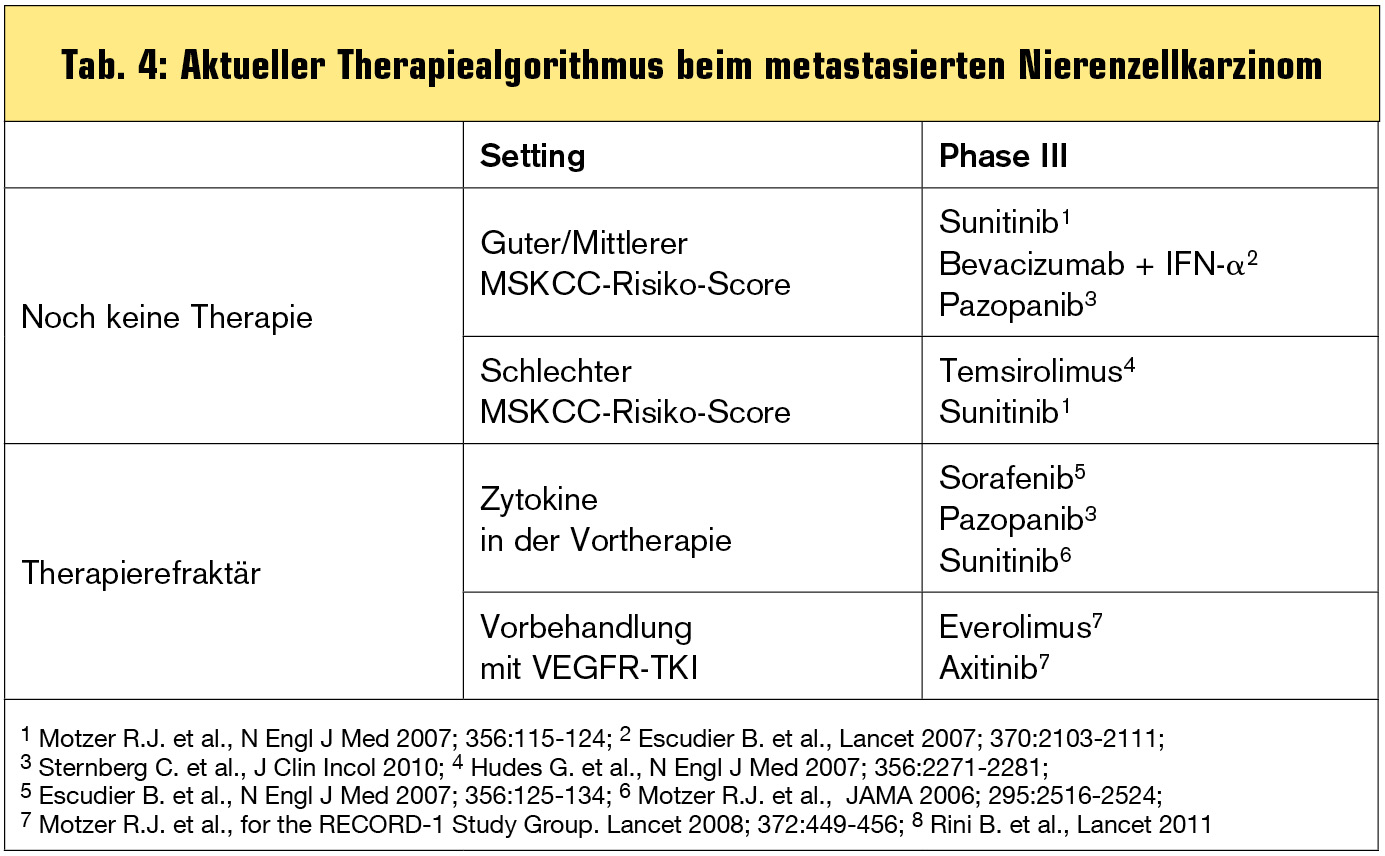
Tab. 4 zeigt den aktuellen Therapiealgorithmus an. Aufgrund der derzeit laufenden Studie mit etablierten, aber auch neuen Substanzen kann sich dieser Algorithmus bald verändern. Schwächere Strategien könnten bei Vorhandensein eines stärkeren Medikaments mit identem Wirkmodus und optimalem Nebenwirkungsprofil nach dem Motto „nur die Klassenbesten“ ganz verschwinden oder zu Nischenstrategien werden. Neue Substanzen – vor allem die beiden zuletzt genannten – werden bald in der Erstlinientherapie mitagieren. Tivozanib kann bald ein starker Konkurrent für das gut verträgliche Pazopanib werden, da es vermutlich bei gleichzeitig sehr moderatem Nebenwirkungsprofil eine stärkere Wirkung entfalten kann (Abb.). Axitinib könnte bald Sunitinib verdrängen, denn die Ergebnisse mit Axitinib sind die bislang besten, die je in der Erstlinientherapie erreicht wurden. Sunitinib könnte dem Algorithmus unter Umständen aufgrund der starken PDGFR-Inhibition in der Zweitlinie erhalten bleiben, da PDGFR-Inhibition bei Resistenzentwicklung eine Rolle spielt. Die Kombination Bevacizumab + IFN-alpha könnte unangefochten die Therapie der Wahl für eine selektierte Patientenpopulation bleiben.