Patientenselektion, Einschätzung der Resektabilität, Operationsstrategie – Chirurgische Therapieoptionen beim cholangiozellulären Karzinom
Klassifikation
Nach der aktuell gültigen 7. Ausgabe der TNM-Klassifikation maligner Tumoren wird zwischen intrahepatischen und extrahepatischen CCC unterschieden. Neu gegenüber der 6. Ausgabe ist die weitere Unterteilung extrahepatischer CCC in proximale/perihiläre Karzinome (Klatskin-Tumoren) und distale CCC. Intrahepatische CCC reichen bis zu den Gallengängen 2. Ordnung. Die Grenze zwischen proximalen und distalen CCC stellt die Einmündung des Ductus cysticus dar. Proximale CCC werden nach der Bismuth-Corlette-Klassifikation in 4 anatomisch definierte Lagetypen unterteilt: Typ I: Ductus hepaticus, Typ II: Gallengangsbifurkation, Typ IIIa: Gallengangsbifurkation und rechter Ductus hepaticus bis zu den Segmentästen, Typ IIIb: Gallengangsbifurkation und linker Ductus hepaticus bis zu den Segmentästen, Typ IV: Gallengangsbifurkation und beide Gallengänge bzw. multifokale Verteilung. Zusätzlich werden 3 makroskopisch definierbare Wachstumsformen beschrieben: sklerosierend, nodulär und papillär. Während die sklerosierende Form typischerweise diffus entlang der Gallenwege wächst, sind papilläre Karzinome oft gut abgrenzbar und daher signifikant häufiger resektabel, was sich auch in einer besseren Prognose niederschlägt.
Kurzfassungen der TNM-Klassifikationen sind in Tabelle 1 und 2, die Stadieneinteilung in Tabelle 3 dargestellt2.
| Tab. 1: TNM-Klassifikation intrahepatischer CCC | |
|---|---|
| T1 | Solitär ohne Gefäßinvasion |
| T2a | Solitär mit Gefäßinvasion |
| T2b | Multipel mit oder ohne Gefäßinvasion |
| T3 | Perforation des viszeralen Peritoneum/Infiltration von Nachbarorganen |
| T4 | Periduktale Infiltration |
| N1 | Regionale Lymphknotenmetastasen |
| Tab. 2: TNM-Klassifikation extrahepatischer CCC | ||
|---|---|---|
| Proximal/Perihilär | Distal | |
| T1 | Auf Gallengang beschränkt | |
| T2 | T2a: jenseits des Gallengangs T2b: Infiltration in benachbartes Leberparenchym |
jenseits des Gallengangs |
| T3 | Unilaterale Infiltration von Pfortader oder Leberarterie | Infiltration benachbarter Organe |
| T4 | Pfortaderhauptstamm oder beide Pfortaderäste | Truncus coeliacus oder A. mesenterica superior |
| N1 | Regionale Lymphknotenmetastasen | |
| Tab. 3: UICC-Stadieneinteilung | ||||
|---|---|---|---|---|
| Stadium | Intrahepatisch | Proximal | Distal | |
| I | T1 N0 | T1 N0 IB: T2 N0 |
IA: T1 N0 | |
| II | T2 N0 | T2a-b N0 IIB: T13 N1 |
IIA: T3 N0 | |
| III | T3 N0 | IIIA: T3 N0 IIIB: T13 N1 |
T4 N0-1 | |
| IV | IVA: | T4 N0 | IVA: T4 N01 | |
| T14 N1 | M1 | |||
| IVB: M1 | IVB: M1 | |||
Patientenselektion und Vorbereitung
Um eine vollständige Tumorresektion zu erreichen, sind oft ausgedehnte Leberresektionen bzw. beim distalen CCC eine Pankreaskopfresektion erforderlich. Wesentlich ist daher eine präoperative internistische Risikoeinschätzung und Optimierung von Risikosituationen. Besonderes Augenmerk liegt hier auf kardialen, pulmonalen und renalen Problemen und auf der Korrektur einer diabetischen Stoffwechsellage.
Weiters muss eine Einschätzung der Leberfunktion und der Leberreserve erfolgen, die sich nicht von der Risikoeinschätzung beim HCC unterscheidet. Klinische Anwendung findet auch die Bestimmung der Indocyaningrün-Clearance (ICG-Clearance). ICG wird hepatozellulär aufgenommen und ohne wesentliche Metabolisierung biliär eliminiert. Die Eliminationsrate (plasma disappearance rate, PDR) und die Retention des Farbstoffs nach 15 Minuten (R15) bieten so einen Hinweis auf die hepatozelluläre Aufnahme und die biliäre Ausscheidung3 und werden als Surrogatparameter für die Leber(zell)funktion herangezogen. Die Bestimmung der ICG-Clearance ist bei Bilirubinwerten > 3 mg/dl sowie Jodallergie nicht aussagekräftig und auch von hämodynamischen Parametern abhängig.
Kontroversiell ist die Bedeutung einer präoperativen Gallenwegsdrainage bei Patienten mit Stauungsikterus durch einen endoskopisch oder perkutan eingebrachten Stent. Eine rezentes systematisches Review konnte beim perihilären CCC keinen Vorteil zeigen4. Argumente für eine präoperative Stentimplantation sind eine mögliche Verbesserung der Leberfunktion durch Beseitigung der Cholestase, die Behandlung einer evtl. bestehenden Cholangitis und die geringe Invasivität der Methode. Dagegen sprechen das Risiko einer aszendierenden Cholangitis und die dadurch erhöhte perioperative Morbidität, die erschwerte intraoperative Identifikation der proximalen Tumorausdehnung und potenzielle schwerwiegende Komplikationen wie Perforationen oder Blutungen. Vor ausgedehnten Leberresektionen erscheint jedoch eine Drainage der verbleibenden Restleber durchaus sinnvoll, wie auch eine Konsensuskonferenz der EHPBA (European Hepato-Pancreato-Biliary Association) in Brüssel 2007 festhielt. Ebenso besteht eine Indikation bei manifester Cholangitis oder bei deutlich verzögerter Operation z.B. aufgrund eines schlechten Ernährungszustands. Metallstents sollten auf Grund verstärkter Gewebsadhäsion lediglich bei definitiv palliativer Therapie Verwendung finden.
Einschätzung der Resektabilität
Anhand moderner bildgebender Verfahren muss eine genaue Operationsplanung erfolgen5,6. Durch Kombination verschiedener Verfahren ist eine korrekte Vorhersage der Operabilität in über 90% aller Patienten mit intrahepatischen bzw. distalen CCC möglich, während die Resektabilitätsbeurteilung von perihilären CCC nach wie vor schwieriger ist und in maximal 6080% korrekt gelingt. Die Definition der Resektabilität ist in Tabelle 4 dargestellt.
Für die Computertomographie ist eine triphasische Kontrastmittelserie (nativ, arteriell und portalvenös) mit einer ausreichend hohen Kontrastmittelinjektionsrate von mindestens 4 ml/s (gesamt mindestens 120 ml) wichtig. Dies gewährleistet die Detektion hypervaskularisierter Läsionen in der arteriellen Phase und gibt exakten Aufschluss über die Gefäßanatomie und eventuelle Varianten sowie über eine fragliche Gefäßinvasion. Bei dis talen CCC gelingt meist auch eine zuverlässige Interpretation sekundärer Tumorzeichen (Stenosen, Gangabbruch, Organdeformation).
Die Magnetresonanztomographie sollte mit einer Feldstärke von zumindest 1,5 Tesla, Schichtdicken von 24 mm und dynamischen 3-D-GRE-Sequenzen nach Kontrastmittelgabe durchgeführt werden. Durch Verwendung leberspezifischer Kontrastmittel kann die Detektion von intrahepatalen Satellitenläsionen wahrscheinlich weiter verbessert werden. Jede MRT sollte auch T2-gewichtete MRCP-Sequenzen (Magnetresonanz Cholangiopankreatikographie-Sequenzen) beinhalten, die als Goldstandard zur Darstellung stenosierender Prozesse der Gallenwege gelten. Durch Kombination von MRT mit Kontrastmittel und MRCP ist die gleichzeitige Bestimmung einer eventuellen Infiltration des umgebenden Gewebes und der Höhe und Morphologie der tumorösen Stenose gegenüber der direkten Kontrastmitteldarstellung der Gallenwege mittels endoskopischer Cholangiopankreatikographie (ERCP) oder perkutaner transhepatischer Cholangiographie (PTC) verbessert. Die MRT/ MRCP muss dabei unbedingt vor Anlage einer interventionellen Drainage durchgeführt werden, da die Darstellung der Gallenwege im dilatierten Zustand genauer möglich ist und Artefakte durch eingebrachte Stents fehlen.
Zunehmende Bedeutung gewinnt die Fluorodeoxyglukose-Positronenemissionstomographie (FDG-PET/CT). Diese eignet sich besonders zur Operabilitätseinschätzung von intrahepatischen CCC, da vor allem eventuell befallene zöliakale, periaortale oder kavale Lymphknotenmetastasen, die als Fernmetastasen gelten, sowie andere extrahepatale Manifestationen verbessert dargestellt werden können. Damit können unnötige Explorativlaparotomien vermieden werden.
Die Endosonographie erlaubt eine präzise Beurteilung einer Infiltration des Duodenums oder Pankreas durch distale CCC. Zusätzlich ist endosonographisch eine sichere bioptische Materialgewinnung ohne Gefahr einer peritonealen Tumordissemination möglich.
| Tab. 4: Definition der Resektabilität |
|---|
| Technische Irresektabilität: |
Intrahepatisches CCC
|
Perihiläres CCC
|
Distales CCC
|
| Onkologische Kontraindikationen: |
|
Operationsstrategie
Intrahepatisches CCC
Eine vollständige Tumorresektion (R0) wird angestrebt, jedoch haben auch R1-Resektionen eine bessere Prognose als rein palliative Maßnahmen bzw. R2-Resektionen. Der Abstand des Tumors zum Resektionsrand spielt im Leberparenchym eine geringere Rolle als früher angenommen, wenn die Parenchymdissektion mit einem vaporisierenden Verfahren wie dem Cavitron Ultrasonic Surgical Aspirator (CUSA®) durchgeführt wird, wobei ein zusätzlicher Resektionsabstand von einigen Millimetern erreicht wird. So konnte anhand der Patienten der Universitätsklinik für Chirurgie in Wien gezeigt werden, dass der parenchymatöse Resektionsabstand zum Tumor auf die Wahrscheinlichkeit eines Rezidives oder auf das Gesamtüberleben keinen Einfluss hat7. Aus diesem Grund ist parenchymsparenden Resektionstechniken gegenüber anatomischen Resektionen der Vorzug zu geben, da mehr vitales Lebergewebe erhalten werden kann.
Trotzdem kann es in manchen Situationen, besonders bei geplanten erweiterten rechtsseitigen Hepatektomien, eventuell zu einem zu geringen verbleibenden Leberrestvolumen kommen. Um diesen Patienten dennoch eine kurative Resektion anbieten zu können, besteht die Möglichkeit einer präoperativen portalvenösen Embolisation. Hierbei wird der portalvenöse Zufluss des tumortragenden Leberabschnitts nach perkutaner Punktion okkludiert, was nach 4 bis 6 Wochen zu einer Volumenzunahme des verbleibenden Leberparenchyms von 816% und damit zu einer ausreichenden funktionellen Leberreserve führt. Die Langzeitergebnisse einer Resektion nach portalvenöser Embolisation sind denen bei primärer Resektabilität äquivalent. Belege für ein klinisch relevantes Tumorwachstum nach portalvenöser Embolisation liegen nicht vor.
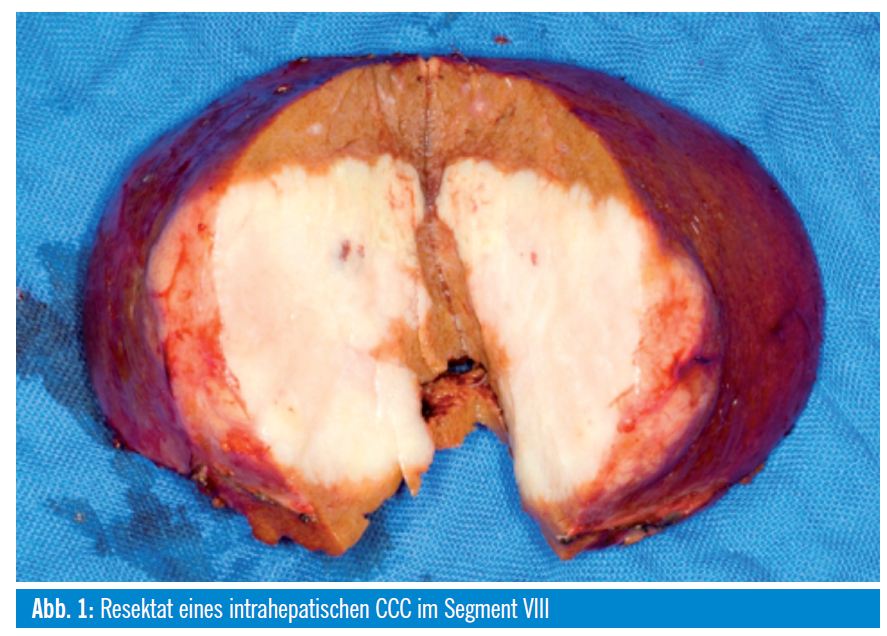
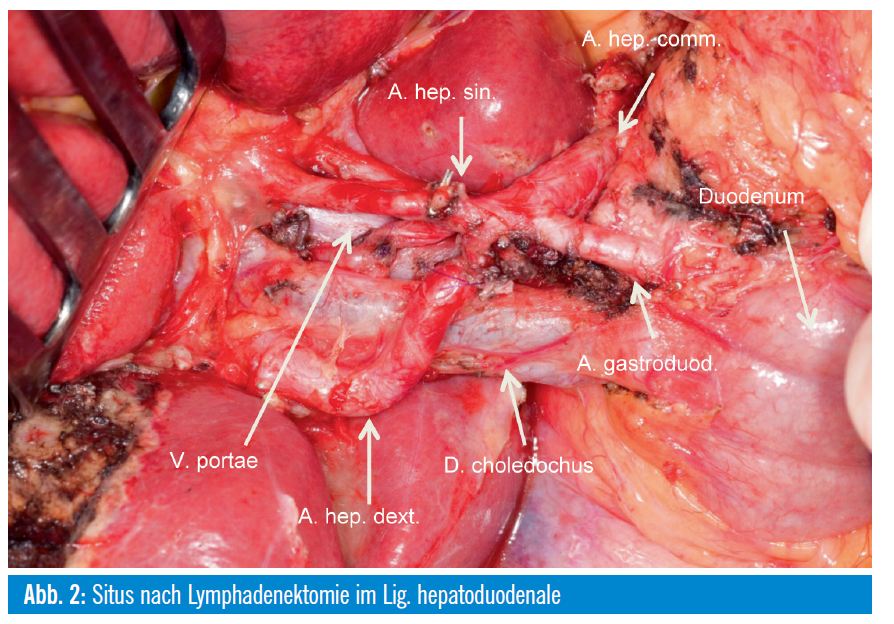
Zur Bedeutung einer Lymphadenektomie gibt es wenig publizierte Daten. Gesichert ist eine schlechtere Prognose bei befallenen Lymphknoten im Ligamentum hepatoduodenale, eine mögliche Verbesserung des Überlebens durch Lymphadenektomie ist nicht geklärt, wird aber von den meisten Autoren eingefordert. In einer Analyse der eigenen Patienten war eine erhöhte Rate an befallenen in Relation zu entnommenen Lymphknoten ein schlechter prognostischer Parameter. Ein Vorteil auf rezidivfreies und Gesamtüberleben durch eine Lymphadenektomie konnte aber nicht gezeigt werden8. Der Operationssitus nach einer Segment-VIII-Resektion mit ligamentärer Lymphadenektomie ist in Abb. 1+2 dargestellt.
Perihiläres CCC
Die Resektion von Klatskin-Tumoren ist chirurgisch sehr anspruchsvoll. Dies ist bedingt durch die diffuse, periduktale Ausbreitung in/neben den Gallengängen, die Nahebeziehung zu Pfortader, Leberarterie, Leber, Duodenum, Pankreas und Magen sowie häufig bestehende Lymphknotenmetastasen und perineurales Tumorwachstum.
Aufgrund der häufigen submukösen Ausbreitung bis zu 2 cm proximal und 1 cm distal des Tumors kann eine ausreichende Radikalität meist nur durch simultane Leberresektion erzielt werden. Dadurch können Gesamtüberleben und die R0-Resektionsrate deutlich gesteigert werden. Nach zusätzlich durchgeführter Leberresektion wurden 10-Jahres-Überlebensraten von bis zu 20% berichtet, wohingegen Patienten mit lokaler Resektion selten nach 5 Jahren noch am Leben sind.
Das empfohlene chirurgische Vorgehen richtet sich nach der anatomischen Lage des Tumors:
-
Bismuth I: lokale Resektion + Lymphadenektomie
-
Bismuth II: lokale Resektion ± Resektion des Lobus caudatus + Lymphadenektomie
-
Bismuth IIIa: (erweiterte) Hemihepatektomie rechts + Resektion des Lobus caudatus + Lymphadenektomie
-
Bismuth IIIb: (erweiterte) Hemihepatektomie links + Resektion des Lobus caudatus + Lymphadenektomie
-
Bismuth IV: keine kurative Resektion möglich, andere Therapiekonzepte
Aufgrund der anatomisch sehr variablen Gallengangsdrainage ist bei Bismuth-III-Tumoren das Segment IV (medialer Anteil des linken Leberlappens) fast immer mitbetroffen und die oft hinter dem Gallengang kreuzende A. hepatica dextra häufig in den Tumor einbezogen. Deshalb befürworten insbesondere asiatische Arbeitsgruppen die prinzipielle Durchführung einer erweiterten Hemihepatektomie rechts. Manche Autoren (Neuhaus, Berlin) empfehlen die zusätzliche Resektion der Pfortaderbifurkation und anschließende Rekonstruktion des Hauptstammes durch End-zu-End-Anastomose mit dem verbleibenden linksseitigen Pfortaderast. Dadurch kann eine exzellente R0-Resektionsrate von 87% erzielt werden, allerdings auf Kosten einer postoperativen Letalität (90 Tage) von 12%6. Zusätzlich ist die Resektion von Segment I aufgrund der Gallengangsdrainage in die Gallengangsbifurkation sinnvoll. Wird eine derart ausgedehnte Leberresektion angestrebt, sollte meist auch eine Pfortaderembolisation (s.o.) zur Erlangung einer ausreichenden funktionellen Leberreserve durchgeführt werden.
Eine Lymphadenektomie im Ligamentum hepatoduodenale erfolgt aus technischen Gründen im Rahmen der Resektion routinemäßig. Über die Wertigkeit einer darüber hinausgehenden Lymphadenektomie liegen keine ausreichenden Daten und kein internationaler Konsens vor.
Distales CCC
Die chirurgische Therapie distaler CCC entspricht derjenigen von Pankreaskopfkarzinomen. Es können mit äquivalenten Ergebnissen eine partielle Duodenopankreatektomie nach Kausch-Whipple oder eine pyloruserhaltende partielle Duodenopankreatektomie nach Traverso-Longmire durchgeführt werden. Eine Lymphadenektomie im Bereich des Ligamentum hepatoduodenale wird empfohlen.
Adjuvante Therapie
Zur Indikation einer adjuvanten Therapie gibt es bisher keine ausreichenden Daten. Ein rezent präsentiertes systematisches Review von 20 Studien mit 6712 Patienten zeigte jedoch einen möglichen positiven Effekt einer adjuvanten Therapie besonders bei lymphknotenpositiven Tumoren oder nach R1-Resektion. Chemotherapie oder Radiochemotherapie scheinen einer alleinigen Radiotherapie überlegen9.
Eine Empfehlung zur Durchführung einer adjuvanten Therapie kann aber derzeit außerhalb von Studien nicht ausgesprochen werden.
1 Aljiffry M, Walsh MJ, Molinari M, Advances in diagnosis, treatment and palliation of cholangiocarcinoma: 19902009. World J Gastroenterol 2009; 15:42404262
2 Sobin LH, Gospodarowicz MK, Wittekind C, TNM Classification of Malignant Tumours, 7th Edition. Wiley-Blackwell, 2009
3 Faybik P, Krenn CG, Baker A et al., Comparison of invasive and noninvasive measurement of plasma disappearance rate of indocyanine green in patients undergoing liver transplantation: a prospective investigatorblinded study. Liver Transpl 2004; 10:10601064
4 Liu F, Li Y, Wei Y, Li B, Preoperative biliary drainage before resection for hilar cholangiocarcinoma: whether or not? A systematic review. Dig Dis Sci 2011; 56:663672
5 Sahora K, Kührer I, Trenkwitz D et al., Pankreaskarzinom und periampulläres Karzinom. Journal für Gastroenterologische und Hepatologische Erkrankungen 2009; 7:3644
6 Tamandl D, Grünberger T, Kaczirek K et al., Management des Cholangiokarzinoms. Journal für Gastroenterologische und Hepatologische Erkrankungen 2009; 7:3450
7 Tamandl D, Herberger B, Gruenberger B, et al.: Influence of hepatic resection margin on recurrence and survival in intrahepatic cholangio – carcinoma. Ann Surg Oncol 2008; 15:27872794
8 Tamandl D, Kaczirek K, Gruenberger B et al., Lymph node ratio after curative surgery for intrahepatic cholangiocarcinoma. Br J Surg 2009; 96:919925
9 Horgan AM, Amir E, Walter T, Knox JJ, Adjuvant therapy in the treatment of biliary tract cancer (BTC): A systematic review and meta-analysis. J Clin Oncol 2011; 29:suppl; abstr 4050