Interventionell-endoskopische Therapie des Gallengangskarzinoms
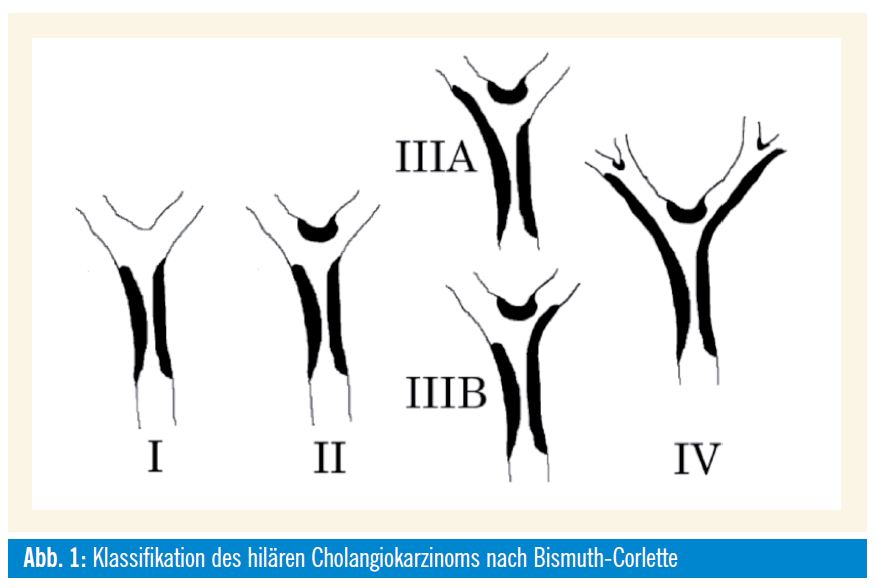
Klassifikation des Gallengangskarzinoms
Auf das Gallengangskarzinom entfallen ca. 33% aller biliären Karzinome (22% hiläre Klatskin-Tumoren, 8% distal; 3% intrahepatisch). Karzinome des Ductus cysticus werden als Gallenblasenkarzinome klassifiziert. Die Gallengangskarzinome werden nach ihrer Lokalisation in intra- und extrahepatische Gallengangskarzinome unterteilt; das Tumorstadium wird nach der aktuellen UICC/TNM-Klassifikation bzw. für hiläre Klatskin-Tumoren nach der Bismuth-Corlette-Klassifikation festgelegt. Beide Klassifikationen beschreiben die lokale Ausdehnung und lassen Rückschlüsse auf die Prognose des Patienten zu, sind jedoch nicht hilfreich in der Beurteilung der Resektabilität. Obwohl die Tumoren erst spät fernmetastasieren, ist die lokale Progression mit ausgedehnter diffuser periduktal-longitudinaler oder lateraler Infiltration Ursache der häufigen primären Inoperabilität (ca. 70-80%).
Therapeutische Aspekte
Alle Fälle sollten in einem interdisziplinären Tumorboard an einem hepatobiliären Zentrum bezüglich der potenziellen kurativen Operabilität beurteilt werden. Im Falle einer Inoperabilität sollte ein individualisiertes, idealerweise multimodales Therapiekonzept gefunden werden. Nur die kurative R0-Resektion, die bis vor kurzem in weniger als 30% der Patienten erreicht wurde, bietet die Chance auf Langzeitüberleben und Heilung. In den letzten 5 bis 10 Jahren konnte durch die Ausdehnung der chirurgischen Radikalität in Form von erweiterten Hemihepatektomien eine Verbesserung der Resektionsraten auf 5060% und der 5-Jahres- Überlebensraten auf 3545% erzielt werden. Besteht die Möglichkeit einer zeitnahen kurativen Resektion, ist bei fehlender Cholangitis und einem Gesamtbilirubin im Serum von < 34 mg/dl eine präoperative Gallengangsdrainage nicht zwingend indiziert.
Die endoskopische Drainage der Gallenwege hat sich in den letzten 20 Jahren zur wichtigsten palliativen Maßnahme bei Karzinomen mit Gallengangsobstruktion entwickelt. Da, wie bereits erwähnt, deutlich weniger als die Hälfte der Gallengangskarzinome bei Diagnosestellung operabel sind, nimmt die endoskopische Therapie bei dieser Erkrankung eine zentrale Stellung ein. Seit der Erstbeschreibung wurde eine Vielzahl technischer Verbesserungen eingeführt, und die Methode ist in erfahrenen Händen zur Routine geworden. Der Zugang ist sowohl transpapillär (ERCP) als auch perkutan transhepatisch (PTCD) möglich.
Präoperative endoskopische Therapie
Durch eine präoperative endoskopische Therapie bei Patienten mit obstruktivem Ikterus können die gestauten Gallenwege suffizient entlastet werden. Eine wichtige Rolle bei diesen Überlegungen spielt die hohe postoperative Komplikationsrate von bis zu 40% bei mechanischer Cholestase mit Cholangitis. Ein kurativer Therapieansatz bei malignen Stenosen des Leberhilus erfordert ausgedehnte Hemihepatektomien. Diese Operationen sind bei Cholestase mit Cholangitis mit einer erhöhten Rate an postoperativer Leberinsuffizienz und Mortalität assoziiert. Da sich die Leberfunktion durch biliäre Dekompression bessern lässt, sollte jener Leberteil, der erhalten werden soll, präoperativ drainiert werden. Mangels qualifizierter Studien zu dieser Fragestellung ist jedoch bislang nicht belegt, ob die präoperative Drainage bei Hilustumoren tatsächlich Morbidität und Mortalität senkt. Unklar ist auch, welches Zeitintervall zwischen Gallengangsdrainage und Operation verstreichen sollte, um ein optimales Ergebnis zu erreichen. Idealerweise sollte ein erfahrener Leberchirurg frühzeitig in die Therapieplanung einbezogen werden. Kann die Operation zeitnah erfolgen, ist eine präoperative Drainage bei Cholestase ohne Cholangitis nicht zwingend nötig. Wenn diese günstige Konstellation nicht vorliegt, ist jedoch eine präoperative endoskopische Drainage vorzuziehen.
Palliative Therapie
Ziel der Palliation ist die Verlängerung des Überlebens und die Verbesserung der Lebensqualität (Pruritus, Schmerzen, Fieber, Hospitalisierungsdauer). Das mediane Überleben der Patienten mit nichtresektablen Gallengangstumoren liegt nach palliativer Drainage zwischen 6 und 9 Monaten. Die Patienten sterben in der Regel an rezidivierender Cholangitis und/oder konsekutivem Leberversagen.
Stentanlage
Die palliative Standardtherapie ist die Einlage von biliären Endoprothesen. Zur Implantation eines biliären Stents ist der endoskopische transpapilläre Weg dem perkutanen meist vorzuziehen. Eine perkutane transhepatische Cholangiodrainage (PTCD) sollte nach primärem Versagen der Endoskopie und in anatomisch schwierigen Situationen angewandt werden, z.B. nach Magenteilresektionen oder Gastrektomien, insbesondere mit YRoux- Anastomose. In diesen Fällen ist die Papille endoskopisch oft nicht erreichbar. Wenn die endoskopische Drainage primär versagt hat, gelingt mit der PTCD in bis zu 90% noch eine effektive Drainage. Die höhere Morbidität und eine 30-Tage-Mortalität von bis zu 10% müssen jedoch beachtet werden. In ausgewählten Fällen können die beiden Methoden im sog. Rendezvous-Verfahren effektiv kombiniert werden.
Selbstexpandierende Metallstents haben gegenüber den kostengünstigeren Plastikstents den Vorteil einer höheren Offenheitsrate mit konsekutiv niedrigeren Raten an Reinterventionen und Rehospitalisierungen. Bei Patienten mit einer Lebenserwartung von mehr als 6 Monaten werden deshalb Metallstents empfohlen.
Klatskin-Tumoren, ein- vs. beidseitige Drainage: Eine besondere Situation ergibt sich am Leberhilus. Gallengangskarzinome am Hilus (Klatskin-Tumoren) okkludieren oft beide Hepaticus-Gänge. Eine beidseitige Drainage soll eine Cholangitis effektiver verhindern als eine einseitige Drainage und dadurch zur Prognoseverbesserung beitragen. Ein eindeutiger Konsens konnte diesbezüglich bislang nicht erreicht werden. In einer Studie war die bilaterale Drainage mit einem signifikant längeren Überleben und mit weniger Cholangitiden assoziiert1. Wenn sequenziell zunächst unilateral drainiert und nur bei ungenügendem Rückgang der Cholestase oder bei Sepsis ein weiterer Stent platziert wird, können jedoch mindestens ebenso gute Ergebnisse erreicht werden2. In einem randomisierten Vergleich zwischen uni- und bilateraler Stentimplantation konnte zwar kein Überlebensvorteil dargelegt werden, aber Cholangitiden traten nach unilateraler Drainage seltener auf3. Eine Drainage von mindestens 25% des Lebervolumens ist bei unilateraler Drainage allerdings notwendig, um eine ausreichende Palliation zu erreichen4. Bei unilateraler Drainage muss eine Kontrastmittelfüllung der nicht drainierten Gallengänge vermieden werden. Neuere Studien zeigen, dass eine vorgeschaltete Magnetresonanz- Cholangiopankreatikographie (MRCP) zur gezielten Drainage der am weitesten dilatierten Gallengänge die Ergebnisse der Stenttherapie verbessern kann. In der Literatur schwanken die unterschiedlich definierten Erfolgsraten der endoskopischen Drainage mit Plastikstents zwischen 41 und 80%. Entscheidend bei einer Plastikstenttherapie ist eine Überwachung der Patienten, um nicht eine latente biliäre Sepsis durch Stentverschlüsse zu übersehen. Kunststoffstents sollten routinemäßig spätestens nach drei Monaten gewechselt werden. Es gibt keine aktuellen randomisierten Studien bezüglich Stentmaterial sowie Anzahl oder Platzierung von Plastikstents.
Beschichtete vs. unbeschichtete Stents: Kosten-Nutzen- und Risiko-Nutzen-Analysen zeigen bei biliärer extrahepatischer Obstruktion einen Benefit für Metallstents gegenüber Plastikstents bei Patienten mit einer geschätzten Lebenserwartung von über 6 Monaten, da die Offenheitsdauer der Metallstents deutlich besser ist. Nach im Mittel 510 Monaten kommt es dennoch zum Einwachsen von Tumorzellen durch die Maschen des Metallstents sowie zu Sludge-Konkrementbildung. Durch die Verwendung eines polyurethan- oder polytetrafluorethylenbeschichteten Metallstents lässt sich die Okklusionsrate nochmals senken (von 2238% auf ca. 15%). Zumindest in den ersten Wochen sind derart beschichtete Metallstents in der Regel auch problemlos wieder entfernbar und gegebenenfalls repositionierbar. Ein Überlebensvorteil durch beschichtete Metallstents gegenüber unbeschichteten Metallstents konnte jedoch bislang in mehreren Studien nicht belegt werden. Dem Vorteil der geringeren Okklusionsrate steht der Nachteil der höheren Migrationsgefahr, besonders bei distalen Gallengangstumoren, gegenüber. Bei geplanten transpapillären bilateralen Metallstentdrainagen von Hilustumoren haben unbeschichtete Metallstents deutliche Vorteile in der technischen Erfolgsrate, da gerade neue spezielle unbeschichtete Metallstentmodelle eine sequenzielle bilaterale transpapilläre Drainage technisch deutlich erleichtern. Stentokklusionen können bei allen Metallstenttypen mittels Ballondilatation mit erneuter Stent-in-Stent-Einlage bzw. Einsatz von Laser oder APC therapiert werden.
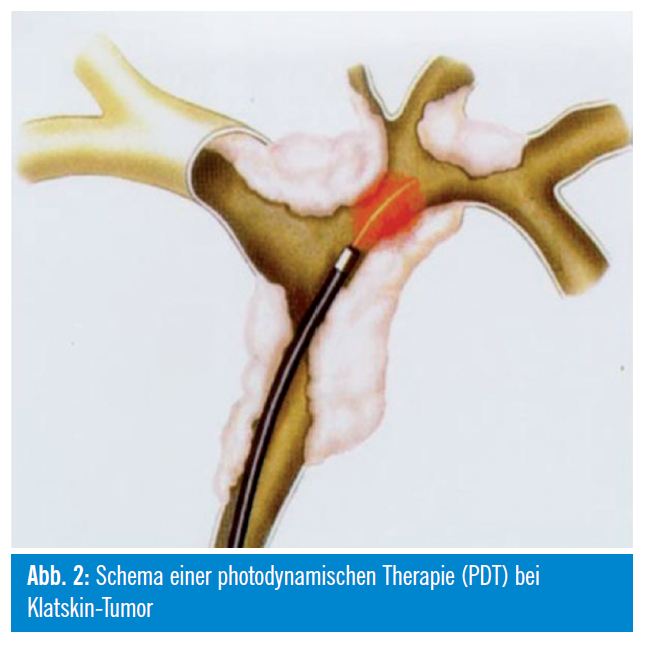
Photodynamische Therapie
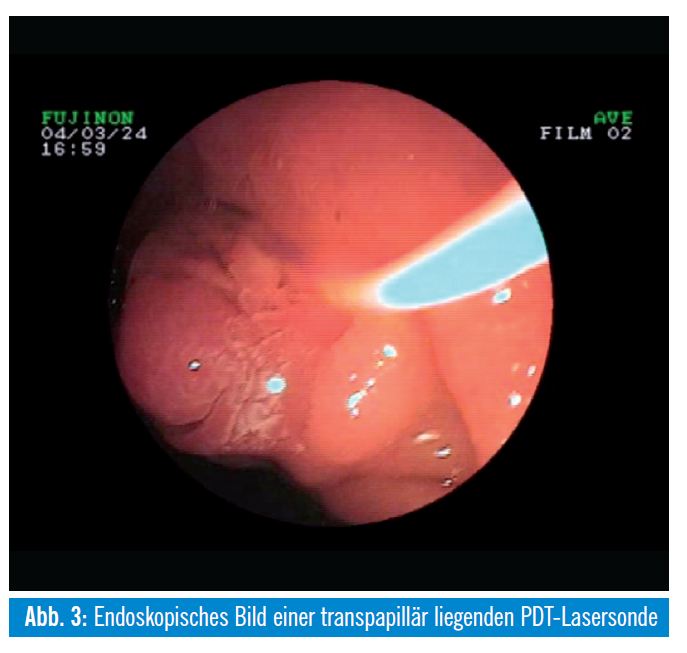
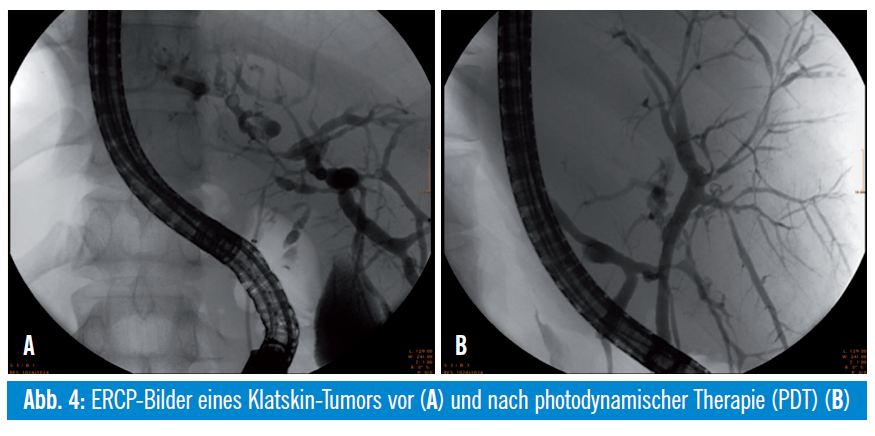
Patienten mit einem inoperablen extrahepatischen Cholangiokarzinom können nebenwirkungsarm mittels photodynamischer Therapie (PDT) lokal therapiert werden. Dabei wird 4896 Stunden nach intravenöser Applikation einer photosensibilisierenden Substanz (Hämatoporphyrin- Derivate [Photofrin®, Photosan®], Temoporfin [Foscan®]) eine intraluminale UV-Bestrahlung der Tumoren mittels transpapillär eingebrachten Laserlichtsonden in definierter Wellenlänge (630 nm) durchgeführt und somit eine phototoxische Apoptose und Nekrose des umgebenden Tumorareals erzeugt. Die Nekrosen reichen meist nur 5 mm, teils auch maximal 10 mm tief. Dieses Verfahren lässt sich sehr gut mit einer Applikation von Plastik-/Metallstents in den stenosierten Arealen kombinieren und führte in mehreren Studien zu einer signifikanten Verlängerung des Über – lebens. Eine prospektive randomisierte Studie zeigte nach kombinierter PDT und Stentimplantation im Vergleich zur alleinigen Stentbehandlung ein signifikant längeres medianes Überleben (493 Tage versus 98 Tage), eine effektivere biliäre Drainage und eine bessere Lebensqualität5. Ein relevanter Kritikpunkt an dieser Studie ist die fehlende Besserung der Cholestase nach alleiniger Stentbehandlung und das damit verbundene kurze Überleben in der Stentgruppe. Eine signifikante Verlängerung des Überlebens durch PDT bei nichtresektablen Gallengangskarzinomen (21 vs. 7 Monate in der Kontrollgruppe, p = 0,011) wurde in einer weiteren prospektiven randomisierten Arbeit nachgewiesen6. Eine Phototoxizität der Haut tritt bei circa 10% der Patienten auf. Die PDT ist mittlerweile in der Behandlung des nichtresektablen Gallengangskarzinoms gut etabliert. Für die Zukunft ist eine Verbesserung der PDT-Wirkung durch den Einsatz von Photosensibilisatoren mit einer höherer Eindringtiefe, wie zum Beispiel Temoporfin, zu erhoffen.
Photodynamische Therapie im neoadjuvanten Setting: In einer prospektiven Phase-2-Studie wurde die PDT als neoadjuvante Therapiemaßnahme evaluiert7. Das rezidivfreie 1-Jahres-Überleben lag bei 83%. Die Hypothese dieses Therapiekonzeptes beruht darauf, durch selektive Zerstörung von Tumorausläufern und dysplastischen Zellen am proximalen Absetzungsrand die lokale Rezidivrate zu senken. Langzeitergebnisse zur Rezidivrate und zum Überleben der mit neoadjuvanter PDT und Resektion behandelten Patienten liegen noch nicht vor. Zur adjuvanten PDT nach R1-/R2-Resektion gibt es nur Fallberichte8. Hingegen verbesserte eine präoperative intraluminale Brachytherapie nicht das Überleben; zu hohe Strahlendosen waren sogar prognostisch ungünstig9.
Intraluminale endoskopische Radiofrequenzablation
In Anlehnung an die erfolgreichen perkutanen radiologischen Anwendungen der Radiofrequenzablation beim hepatozellulären Karzinom und der Radiofrequenzablation des Barrett-Ösophagus publizierte eine englische Arbeitsgruppe erste Erfahrungen einer endoskopischen sondenbasierten Radiofrequenzablation von inoperablen Gallengangskarzinomen. Diese kohorten-basierte Open-Label-Pilotstudie zeigte bezüglich technischer Machbarkeit und Sicherheit viel versprechende Ergebnisse, wenngleich randomisierte Daten und Langzeitergebnisse fehlen. Dennoch könnte sich aus diesem Therapieansatz eine ernsthafte Alternative zur PDT entwickeln10.
Weitere interventionell-endoskopische Möglichkeiten: Bei Patienten mit schlecht beherrschbaren Tumorschmerzen kann eine endosonographisch gesteuerte Blockade des Plexus coeliacus durchgeführt werden. Bei 1525% der Patienten treten im fortgeschrittenen Stadium Magenausgangsstenosen oder Duodenalstenosen auf, die mittels Einlage eines enteralen Metallstents zumindest zeitweise beseitigt werden können. Die Duodenalstents sind im Vergleich zur Gastrojejunostomie mit einem initial besseren klinischen Erfolg und weniger Komplikationen sowie kürzerer Hospitalisierungsdauer verbunden. Bei technisch nicht möglicher Stenteinlage oder längerer Lebenserwartung (> 6 Monate) ist die Gastrojejunostomie aufgrund der besseren Langzeiterfolgsrate vorzuziehen.
Fact-Box
Akkurates Staging und interdisziplinäre Therapieplanung der Gallengangskarzinome zur R0-Resektabilitätsdefinierung sind essenziell.
Präoperative endoskopische Stenttherapie erfolgt in enger Absprache mit dem hepatobiliären Chirurgen.
Palliativtherapie erfolgt primär interventionellendoskopisch in einem endoskopischen Zentrum. Die PDT ist mittlerweile in der Behandlung des nichtresektablen Gallengangskarzinoms etabliert.
Die PDT im adjuvanten und neoadjuvanten Setting verdient randomisierte Studien. Die Zukunft der Palliativtherapie ist multimodal (Stent-PDT-Chemotherapie).
Die intraluminale endoskopische Radiofrequenzablation stellt einen neuen, noch experimentellen Therapieansatz dar.
1 Deviere J ewt al., Long-term follow-up of patients with hilar malignant stricture treated by endoscopic internal biliary drainage. Gastrointest Endosc 1988; 34:95101
2 Polydorou AA et al., Palliation of proximal malignant biliary obstruction by endoscopic endoprosthesis insertion. Gut 1991; 32:685689
3 De Palma GD et al., Unilateral versus bilateral endoscopic hepatic duct drainage in patients with malignant hilar biliary obstruction: results of a prospective, randomized, and controlled study. Gastrointest Endosc 2001; 53:542553
4 Dowsett JF et al., Endoscopic biliary therapy using the combined percu – taneous and endoscopic technique. Gastroenterology 1989; 96:11806
5 Ortner MEJ et al., Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study. Gastroenterology 2003; 125:135563
6 Zoepf T et al., Palliation of nonresectable bile duct cancer: improved survival after photodynamic therapy. Am J Gastroenterol 2005; 100:242630
7 Wiedmann M et al., Neoadjuvant photodynamic therapy as a new approach to treating hilar cholangiocarcinoma: a phase II pilot study. Cancer 2003; 97:278390
8 Nanashima A et al., Adjuvant photodynamic therapy for bile duct carcinoma after surgery: a preliminary study. J Gastroenterol 2004; 39:1095101
9 Gonzalez Gonzalez D et al., Role of radiotherapy, inparticular intraluminal brachytherapy, in the treatment of proximal bile duct carcinoma. Ann Oncol 1999; 10 (Suppl):215220
10 Steel A et al., Endoscopically applied radiofrequency ablation appears to be safe in the treatment of malignant biliary obstruction. Gastrointest Endosc 2011; 73:149153