Hepatobiliäre Karzinome: Medikamentöse Therapie des cholangiozellulären Karzinoms
Die einzige kurative Therapieoption stellt die operative Sanierung dar. Diese ist nur sinnvoll, wenn eine R0-Resektion durchgeführt werden kann. Allerdings sind leider ca. 75% der Tumoren bei Diagnosestellung bereits lokal fortgeschritten oder metastasiert, weswegen keine Operation (primär) durchgeführt werden kann. Somit ist eine exakte präoperative Diagnostik unbedingt notwendig, um eventuell unnötige Eingriffe zu vermeiden.
Adjuvante Chemotherapie
Obwohl das 5-Jahres-Überleben nach kurativer Resektion nur zwischen 20 und 40% liegt, konnte bis dato kein Nachweis erbracht werden, dass eine adjuvante Therapie zu einer Lebensverlängerung führt. In der bislang einzigen publizierten randomisierten Studie von Takada et al.1, in der sowohl Patienten mit Pankreaskarzinom, Gallenblasenkarzinom, Gallengangskarzinom als auch dem Karzinom der Ampulla vateri eingeschlossen waren, konnte in der Intent-to-treat-Analyse kein signifikanter Unterschied bezüglich des medianen Überlebens gezeigt werden. Lediglich in der Gruppe der Gallenblasenkarzinome, die keiner kurativen Resektion unterzogen werden konnten, zeigte sich ein signifikanter Unterschied hinsichtlich des 5-Jahres-Überleben: 8,9% in der Chemotherapie-Gruppe vs. 0% in der Kontrollgruppe (Chirurgie alleine) mit p = 0,0226.
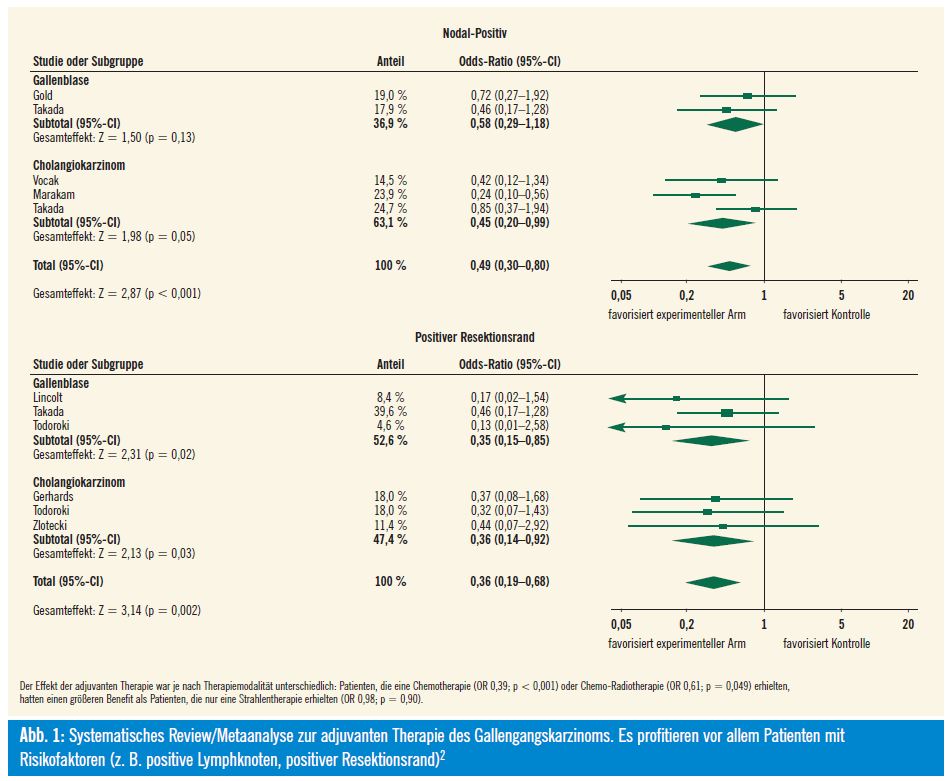
Systematisches Review: Ein systematisches Review/Metaanalyse zur adjuvanten Therapie in der Behandlung des Gallengangskarzinoms wurde ganz rezent beim diesjährigen ASCO von Horgan et al. vorgestellt2. Es wurden 20 Studien, in die 6712 Patienten eingebracht wurden, analysiert, die eine adjuvante Chemotherapie, Strahlentherapie oder beides nach erfolgter intendierter kurativer Operation mit Operation alleine verglichen. Diese Analyse unterstützt die Gabe einer adjuvanten Chemotherapie, vor allem bei Patienten mit Risikofaktoren wie positive Lymphknoten oder auch positiver Resektionsrand (Abb. 1). Nichtsdestotrotz sind unbedingt prospektiv-randomisierte Studien vonnöten, um sowohl bei Hochrisikopatienten als auch bei Patienten ohne Risikofaktoren die Frage zu klären, ob eine adjuvante Chemotherapie bzw. Radiochemotherapie einen Überlebensvorteil bringt.
Palliative Chemotherapie
Das Problem beinahe aller Studien, welche die Wirksamkeit einer palliativen Chemotherapie zu evaluieren versuchten, ist die Heterogenität der Studienpopulation sowie die geringe Fallzahl. In vielen Studien sind sowohl Gallengangstumoren (intra- und extrahepatisches CCC) als auch Gallenblasentumoren, Tumoren der Papilla vateri und manchmal sogar Pankreaskarzinome inkludiert. Erstmals wurde im Jahre 1996 von Glimelius et al.3 in einer Studie gezeigt, dass es durch die Verabreichung einer palliativen Chemotherapie mit 5-FU/LV zu einer signifikanten Verlängerung des medianen Überlebens kommt. Ebenfalls konnte in dieser Studie die Lebensqualität gegenüber der unbehandelten Gruppe signifikant verbessert werden.
Gepoolte Analyse: Eine im Jahr 2007 erschienene gepoolte Analyse von klinischen Studien beim fortgeschrittenen Gallengangstumor von Eckel et al.4 zeigt einen ausgezeichneten Überblick auf die bis dahin erschienen Daten: Es wurden alle Chemotherapiestudien (auch solche mit kleiner Fallzahl und nichtrandomisierte Studien) analysiert, die von 1985 bis Juli 2006 publiziert wurden (auch ASCO-Abstracts waren inkludiert). Ansprechrate (= CR+PR), Tumorkontrollrate (CR+PR+SD), Gesamtüberleben sowie Nebenwirkungen wurden analysiert. Es wurden 104 Studien mit insgesamt 2810 Patienten ausgewertet: pro Studie waren im Durchschnitt lediglich 25 (5 bis 65) Patienten inkludiert, die eine gepoolte Ansprechrate und Tumorkontrollrate von 22,6% und 57,3% sowie ein Gesamtüberleben von 8,2 Monaten hatten. Es konnte eine höhere Ansprechrate bei Gallenblasenkarzinomen im Gegensatz zu Gallengangskarzinomen gezeigt werden; interessanterweise war aber das Gesamtüberleben für Gallenblasenkarzinome kürzer. Im Vergleich Monotherapie vs. Kombinationstherapie mit 2 bzw. 3 Substanzen zeigt sich in Hinblick auf die Ansprechrate, dass eine 2er-Kombination eine deutlich höhere Ansprechrate erzielt als die Therapie mit einer oder mehr als 2 Substanzen (Mono vs. 2 vs. ≥ 3: 15,3% vs. 28% vs. 19,1%).
Zudem wurde die Wirksamkeit unterschiedlicher Substanzen (Fluoropyrimidine, Gemcitabin, Platine, Anthrazykline, Mitomycin C, Taxane sowie Irino tecan) in einer Subgruppenanalyse ausgewertet: Therapien, die Gemcitabin oder auch ein Platin beinhalten, zeigen eine hochsignifikante Verbesserung der Ansprechrate und Tumorkontrollrate gegenüber Gemcitabin-freien bzw. platinfreien Kombinationen. In dieser Analyse konnte weiters gezeigt werden, dass Kombinationen mit Gemcitabin und platinhältigen Regimen ein erhöhtes Ansprechen und eine bessere Tumorkontrollrate erreichen, allerdings zeigte sich keine signifikante Verbesserung des Überlebens. Somit wurde von den Autoren konkludiert, dass diese Kombination bis zum Vorliegen eines evidenzbasierten Standards den vorübergehenden Standard darstellt.
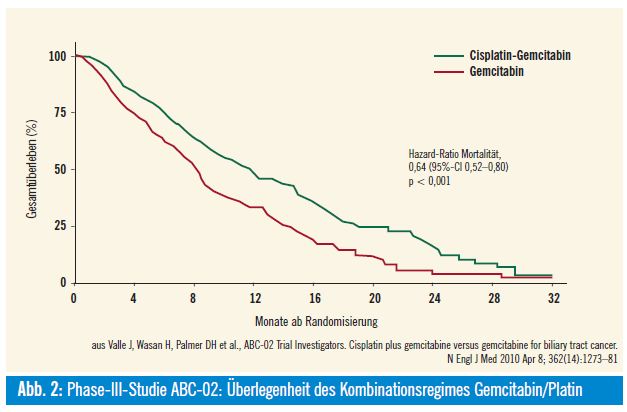
Gemcitabin-Cisplatin-Kombinationstherapie: Die Bestätigung der Überlegenheit des Kombinationsregimes von Gemcitabin mit einem Platin wurde 2009 durch die prospektiv-randomisierte Phase-III-Studie (ABC-02-Studie) erbracht, in der Gemcitabin mit der Kombination Gemcitabin+Cisplatin verglichen wurde5. Inkludiert wurden 410 Patienten mit lokal fortgeschrittenem oder metastasierten Cholangiokarzinom, Gallenblasenkarzinom oder Ampullenkarzinom, die entweder Cisplatin in der Dosierung von 25 mg/m2 gefolgt von Gemcitabin 1000 mg/m2 an den Tagen 1 und 8 alle 3 Wochen für 8 Zyklen oder Gemcitabin 1000 mg/m2 an den Tagen 1, 8, 15 alle 4 Wochen für 6 Zyklen erhielten. Primärer Endpunkt war das Gesamtüberleben. Nach einer medianen Nachbeobachtungszeit von 8,2 Monaten zeigte sich folgendes Ergebnis: Das mediane Gesamtüberleben in der Kombinationsgruppe war signifikant verlängert (11,7 Monate vs. 8,1 Monate in der Monotherapie-Gruppe, p < 0,001) (Abb. 2), weiters kam es zu einer signifikanten Verbesserung des progressionsfreien Überlebens im Gemcitabin- Cisplatin-Arm (8,0 vs. 5,0 Monate in der Monotherapie-Gruppe, p < 0,001). Die Nebenwirkungen waren bis auf eine erhöhte Neutropenie-Rate im Kombinationsarm (bei allerdings gleicher neutropenieassoziierter Infektionsrate) vergleichbar.
Gemcitabin-Oxaliplatin-Kombinationstherapie: Sollte Cisplatin nicht verfügbar sein bzw. wenn aufgrund des Nebenwirkungsprofils darauf verzichtet werden muss, kann Gemcitabin in Kombination mit Oxaliplatin verabreicht werden. Mehrere Phase-II-Studien zeigen eine gute Wirksamkeit und auch ein akzeptables Toxizitätsprofil dieser Kombination (GEMOX). Kann aufgrund des Allgemeinzustandes oder des Nebenwirkungsprofils keine Kombinationstherapie verabreicht werden, so sollte eine Monotherapie mit Gemcitabin durchgeführt werden.
| Tab.: Erste Studienergebnisse mit verschiedenen zielgerichteten Substanzen als Monotherapie oder in Kombination mit Chemotherapie | ||||
|---|---|---|---|---|
|
Studiensubstanz |
Target |
RR |
PFS |
medianes OS |
|
Erlotinib, 1st- und 2nd-Line (n = 42) |
EGFR |
7% |
3 Monate |
8 Monate |
|
Erlotinib + Gemcitabin 1st-Line (n = 26; cave: auch Pankreas- |
EGFR |
8% |
10 Monate |
13 Monate |
|
karzinome inkludiert) |
||||
|
Cetuximab + GEMOX, 2nd-Line (n = 9) |
EGFR |
22% |
4 Mo. (TTP) |
7 Monate |
|
Cetuximab + GEMOX, 1st-Line (n = 30) |
EGFR |
63% |
8 Monate |
13 Monate |
|
GEMOX ± Cetuximab (randomisiert), 1st-Line (n = 101) |
EGFR |
|
44 % vs. 61 % |
|
|
nach 4 Monaten |
||||
|
Lapatinib + Gemcitabin/GEMOX, |
EGFR u. ErbB-2-R |
23% |
|
11 Monate |
|
1st-Line (n = 25; cave: auch Pankreaskarzinome inkludiert) |
||||
|
Lapatinib, 1st- und 2nd-Line (n = 17) |
EGFR u. ErbB-2-R |
0% |
2 Monate |
5 Monate |
|
Bortezomib, 1st-, 2nd- und 3rd-Line (n = 20) |
Proteasom |
5% |
2 Monate |
9 Monate |
|
Imatinib + 5-FU/LV, 1st-Line (n = 41) |
c-Kit-R u. PDGF-R |
5% |
|
|
|
Imatinib, 2nd-Line (n = 9) |
c-Kit-R u. PDGF-R |
0% |
3 Monate (TTP) |
5 Monate |
|
Bevacizumab + GEMOX, 1st-Line (n = 35) |
VEGF |
45% |
7 Monate |
13 Monate |
|
Bevacizumab + Erlotinib, 1st-Line (n = 34) |
VEGF u. EGFR |
20% |
5 Monate |
|
|
Bevacizumab + Erlotinib, 2nd-Line (n = 15) |
VEGF u. EGFR |
13% |
3 Monate |
4 Monate |
|
Sorafenib, 1st-Line (n = 36) |
Raf, PDGF-R |
6% |
2 Monate |
6 Monate |
|
VEGFR-2/3, c-Kit-R |
||||
|
Sorafenib, 1st- und 2nd-Line (n = 46) |
Raf, PDGF-R |
4% |
2 Monate |
4 Monate |
|
VEGFR-2/3, c-Kit-R |
||||
|
Vandetanib ± Gemcitabin (randomisiert), 1st-Line |
VEGFR u. EGFR |
|
|
|
|
GEMOX = Gemcitabin/Oxaliplatin; RR = Ansprechraten; PFS = progressionsfreies Überleben; OS = Gesamtüberleben; TTP = Zeit zur Progression |
||||
|
aus: Wiedmann M, Moessner J. Molecular Targeted Therapy of Biliary Tract Cancer Results of the First Clinical Studies. Current Drug Targets 2010; 11:00001 |
||||
ESMO- und NCCN-Guidelines: Die ESMO-Guidelines aus dem Jahre 20106 empfehlen beim metastasierten CCC nach Möglichkeit eine Kombinationstherapie von Gemcitabin mit einem Platin (Cisplatin bzw. Oxaliplatin), als Monotherapie Gemcitabin oder 5-FU. Die NCCN-Guidelines7 für das extrahepatische und intrahepatische CCC sind unter www.nccn.org abrufbar.
Kombinationstherapien mit zielgerichteten neuen Substanzen
Die Zugabe von zielgerichteten neuen Therapien zur Standardchemotherapie hat in den letzten Jahren bei vielen Tumorentitäten zu einer höheren Ansprechrate und teilweise auch zu einer signifikanten Verlängerung des rezidivfreien und Gesamtüberlebens geführt. Auch beim cholangiozellulären Karzinom wurden diese neuen Substanzen in einer Reihe von Phase-II-Studien untersucht; allerdings fehlen prospektiv randomisierte Phase-III-Studien, um einen sicheren Vorteil beweisen zu können. Eine Übersichtsarbeit aus dem Jahre 2010 zeigt die ersten Studienergebnisse mit unterschiedlich zielgerichteten Substanzen (Tab)8. Wir konnten in einer monozentrischen, prospektiv durchgeführten Studie mit der Kombination von GEMOX mit Cetuximab (einem Antikörper gegen den epidermalen Wachstumsfaktor) bei 30 Patienten mit fortgeschrittenem oder metastasiertem CCC zeigen, dass diese Kombination im Vergleich zu historischen Daten zu einer deutlich erhöhten Ansprechrate von 63% sowie einer Tumorkontrollrate von 80% führt9. Weiters wurden die Patienten nach jeweils 2 Monaten Therapie in einem interdisziplinären Tumorboard besprochen, und es wurde von Leberchirurgen die Möglichkeit einer Resektion bewertet: Es konnten insgesamt 9 primär nicht resektable Patienten (30%) sekundär einer kurativen Operation unterzogen werden. Das progressionsfreie Überleben konnte bei diesen Patienten im Gegensatz zu den nicht resezierten Patienten von 6,8 auf 21,2 Monate verlängert werden. Das mediane Gesamtüberleben von allen eingebrachten Patienten lag bei 15,2 Monaten und bei nichtresezierten Patienten bei 11,6 Monaten; bei den kurativ operierten Patienten war dies nach einem Nachbeobachtungszeitraum von 22 Monaten noch nicht erreicht. Dieselbe Therapiekombination wird in einer randomisierten Phase-II-Studie (BINGO Trial; GEMOX +/ Cetuximab) untersucht; die endgültigen Ergebnisse liegen aber zurzeit noch nicht vor.
Neues vom ASCO 2011
Beim diesjährigen Meeting der American Society of Clinical Oncology in Chicago wurden auf dem Gebiet der palliativen Therapie beim CCC weitere Studien präsentiert:
Gemcitabin, Oxaliplatin, Capecitabin und Panitumumab: Jesen et al. präsentierte eine Studie (Abstr. #4101), in der 46 KRAS-Wildtyp-Patienten mit der Kombination vom Gemcitabin, Oxaliplatin, Capecitabin und Panitumumab behandelt wurden. Das 6 Monate progressionsfreie Überleben lag bei 74,2%, das mediane PFS lag bei 8,3 und das mediane Gesamtüberleben bei 10 Monaten. Bei den evaluierbaren Patienten zeigte sich eine Ansprechrate von 33% und eine Tumorkontrollrate von 86%.
FOLFOX-6: Eine koreanische Studie wurde von Lee et al. vorgestellt (Abstr. #4106): Hier erhielten 49 Patienten mit fortgeschrittenem/metastasiertem intraoder extrahepatischem CCC sowie Gallenblasenkarzinom von Mai 2008 bis August 2010 eine Kombination aus Oxaliplatin und 5-FU/LV (FOLFOX-6). Die Ansprechrate lag bei 16,3% und die Tumorkontrollrate bei 61,7%. Das mediane Gesamtüberleben lag bei 10,7 Monaten.
GEMOX +/ Erlotinib: Weiters wurde eine Phase-III-Studie von Lim et al. vorgestellt (LBA4032): Hier wurde die Kombination von GEMOX mit oder ohne Erlotinib (ein Tyrosinkinaseinhibitor) verglichen. Es wurden Patienten mit histologisch nachgewiesenem lokal fortgeschrittenem oder metastasiertem CCC, Gallenblasenkarzinom oder Ampullenkarzinom eingebracht. Der primäre Endpunkt war das progressionsfreie Überleben. Insgesamt wurden von Februar 2009 bis August 2010 268 Patienten (133 im GEMOX-Arm und 135 im GEMOX-Erlotinib-Arm) randomisiert. Die Ansprechrate war im experimentellen Arm signifikant erhöht, allerdings zeigte sich keine signifikante Verlängerung des medianen progressionsfreien Überlebens (5,8 Monate vs. 4,2 Monate im GEMOX-Arm; p = 0,080). In einer Subgruppenanalyse konnte gezeigt werden, dass bei Patienten mit CCC eine signifikante Verlängerung des PFS mit der Kombination GEMOX-Erlotinib) erreicht werden konnte (5,9 vs. 3,0 Monate; p = 0,049).
Fact-Box
Nach wie vor ist die einzige kurative Therapieoption beim Gallenwegskarzinom die chirurgische Entfernung des Tumors. Eine adjuvante Chemotherapie nach erfolgter Resektion ist derzeit nicht Standard, wird aber in prospektiven Studien untersucht. Bei Patienten mit Risikofaktoren sollte allerdings eine adjuvante Therapie überlegt werden. Im fortgeschrittenen bzw. metastasiertem Setting ist bei gutem Allgemeinzustand derzeit eine Kombinationstherapie von Gemcitabin mit einem Platin (Cisplatin oder Oxaliplatin) Standard, bei Verabreichung einer Monotherapie sollte Gemcitabin bzw. 5-FU verabreicht werden. Neue Kombinationstherapien mit zielgerichteten Substanzen werden derzeit in vielen Studien untersucht, vor dem routinemäßigen Einsatz müssen die Ergebnisse allerdings abgewartet werden.
1 Takada T et al., Is Postoperative Adjuvant Chemotherapy Useful for Gallbladder Carcinoma? A Phase III Multicenter Prospective Randomized Controlled Trial in Patients with Resected Pancreaticobiliary Carcinoma. Cancer 2002; 95:168595
2 Horgan AM et al., Adjuvant therapy in the treatment of biliary tract cancer (BTC): A systematic review and meta-analysis. J Clin Oncol 2011 ; 29:(suppl; abstr 4050)
3 Glimelius B et al., Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer. Ann Oncol 1996; 7:593600
4 Eckel F et al., Chemotherapy in advanced biliary tract carcinoma: a pooled analysis of clinical trials. Br J Cancer 2007; 96(6):896902. Epub 2007 Feb 27
5 Valle J et al., ABC-02 Trial Investigators. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010 Apr 8; 362(14):127381
6 F. Eckel et al., Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up; Annals of Oncology 2010; 21 (suppl. 5): v65v69
7 NCCN Practice Guidelines, Hepatobiliary Cancers, v.2.2010
8 Wiedmann M et al., Molecular Targeted Therapy of Biliary Tract Cancer Results of the First Clinical Studies. Current Drug Targets 2010; 11:00-001
9 Gruenberger B, Schueller J, Heubrandtner U et al., Cetuximab, gemcitabine, and oxaliplatin in patients with unresectable advanced or metastatic biliary tract cancer: a phase 2 study. Lancet Oncol 2010; 11(12):11428. Epub 2010 Nov 9