Was ist relevant für die klinische Praxis? – Histopathologische Klassifikation des hepatozellulären und cholangiozellulären Karzinoms
Histopathologische Klassifikation – hepatozelluläres Karzinom
Definition: maligner Tumor mit hepatozellulärer Differenzierung (WHO 2010)1.
Makroskopische Formen
Hepatozelluläre Karzinome (HCC) sind zumeist gut begrenzte Tumoren, die als große Tumormasse (massiver Typ), als einzelner gut begrenzter Knoten (nodulärer Typ) oder in Form von multiplen Tumoren (multinodulärer Typ) auftreten. Sie sind für gewöhnlich von weicherer Konsis – tenz als das umgebende Lebergewebe. Die Farbe wird von Galleproduktion, Verfettung und/oder Glykogenspeicherung in den Tumorzellen beeinflusst und kann von grünlich-braun bis grau-braun variieren. Noduläre Tumoren in der zirrhotischen Leber sind häufig von einer bindegewebigen Pseudokapsel umgeben, während sie in nichtzirrhotischer Leber gewöhnlich keine Bekapselung aufweisen. Durch nichtneoplastisches Lebergewebe voneinander getrennte multiple Tumoren sind entweder multizentrische HCC, die zeitgleich in einer Leber auftreten, oder von einem primären HCC abstammende intrahepatische Metastasen. Makroskopisch spricht der Nachweis mehrerer kleinerer Tumorknoten in der Umgebung eines größeren Knotens in einem Lebersegment für intrahepatische Metastasierung, während mehrere Tumorknoten in verschiedenen Lebersegmenten auf Multizentrizität hinweisen. Eine seltenere makroskopische Form ist das zirrhoseimitierende, diffus infiltrierende HCC1.
Histologische Formen
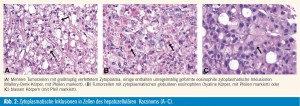
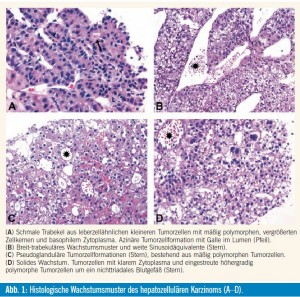 HCC bestehen aus Tumorzellen mit leberzellähnlicher Morphologie. Die Tumorzellen sind zumeist kleiner als nichtneoplastische Leberzellen, mit basophilerem Zytoplasma, vergrößerten Zellkernen mit unregelmäßiger Kernkontur und vergrößerten Nukleolen. Bei über 90 % der Tumorzellen ist immunhistochemisch eine zytoplasmatische Expression der Keratine (K) 8 und 18 sowie von Carbamoylphosphatase- Synthetase-1 (Hep- Par1) nachweisbar. Mit polyklonalen Antikörpern gegen karzinoembryonales Antigen (CEA), CD10 oder Multidrug-Resistance- Protein 1 (MDR1) zeigt sich ein kanalikuläres Reaktivitätsmuster. HCCZellen sind mit Antikörpern gegen K19 und K20 sowie epitheliales Membran- Antigen (EMA) häufig nicht markiert. Zwischen den trabekulären Tumorzellformationen befinden sich sinusoidähnliche, kapillarisierte Bluträume (Sinuso – idäquivalente), bestehend aus CD34-positiven nichtfenestrierten Endothelzellen und einer Kollagen IV und Laminin enthaltenden basalmembranähnlichen Struktur. HCC sind im Vergleich zum umgebenden Lebergewebe hypervaskularisiert. Die Blutversorgung erfolgt durch so genannte ungepaarte oder nichttriadale Arterien, die nicht von Pfortaderästen und interlobulären Gallengängen begleitet sind. Histologische Wachstumsmuster (Tab. 1, Abb. 1) und Grad der Differenzierung (Tab. 2) werden anhand der Architektur der Tumorzellformationen und der zytologischen Eigenschaften der Tumorzellen unterschieden. Die Tumorzellen können eine Reihe von zytologischen Veränderungen (Polymorphie, Mehrkernigkeit, klares oder spindeliges Zytoplasma), Gallebildung und zyto plasmatische Inklusionen (Verfettung, Mallory-Denk-Körper, hyaline und blasse Körper oder – bei HCC-HBsAg-positiven Patienten – Milchglasinklusionen) aufweisen (Abb. 2)1.
HCC bestehen aus Tumorzellen mit leberzellähnlicher Morphologie. Die Tumorzellen sind zumeist kleiner als nichtneoplastische Leberzellen, mit basophilerem Zytoplasma, vergrößerten Zellkernen mit unregelmäßiger Kernkontur und vergrößerten Nukleolen. Bei über 90 % der Tumorzellen ist immunhistochemisch eine zytoplasmatische Expression der Keratine (K) 8 und 18 sowie von Carbamoylphosphatase- Synthetase-1 (Hep- Par1) nachweisbar. Mit polyklonalen Antikörpern gegen karzinoembryonales Antigen (CEA), CD10 oder Multidrug-Resistance- Protein 1 (MDR1) zeigt sich ein kanalikuläres Reaktivitätsmuster. HCCZellen sind mit Antikörpern gegen K19 und K20 sowie epitheliales Membran- Antigen (EMA) häufig nicht markiert. Zwischen den trabekulären Tumorzellformationen befinden sich sinusoidähnliche, kapillarisierte Bluträume (Sinuso – idäquivalente), bestehend aus CD34-positiven nichtfenestrierten Endothelzellen und einer Kollagen IV und Laminin enthaltenden basalmembranähnlichen Struktur. HCC sind im Vergleich zum umgebenden Lebergewebe hypervaskularisiert. Die Blutversorgung erfolgt durch so genannte ungepaarte oder nichttriadale Arterien, die nicht von Pfortaderästen und interlobulären Gallengängen begleitet sind. Histologische Wachstumsmuster (Tab. 1, Abb. 1) und Grad der Differenzierung (Tab. 2) werden anhand der Architektur der Tumorzellformationen und der zytologischen Eigenschaften der Tumorzellen unterschieden. Die Tumorzellen können eine Reihe von zytologischen Veränderungen (Polymorphie, Mehrkernigkeit, klares oder spindeliges Zytoplasma), Gallebildung und zyto plasmatische Inklusionen (Verfettung, Mallory-Denk-Körper, hyaline und blasse Körper oder – bei HCC-HBsAg-positiven Patienten – Milchglasinklusionen) aufweisen (Abb. 2)1.
HCC-Sonderformen
Zwischen 0,5 und 9 % der primären Leber – karzinome entfallen auf das fibrolamelläre Karzinom (fibrolamellar carcinoma, FLC), das sich vom klassischen HCC klinisch, morphologisch und molekular unterscheidet. Es tritt bevorzugt bei Kindern und jungen Erwachsenen in der nichtzirrhotischen Leber und bei zwei Drittel der Fälle im linken Leberlappen auf. Die makroskopisch gut begrenzten Tumoren zeigen eine gelbliche bis beige Schnittfläche und häufig eine zentrale sternförmige Stromanarbe. Histologisch besteht das FLC aus großen polygonalen Tumorzellen mit reichlichem eosinophilem granuliertem mitochondrienreichem Zytoplasma und vergrößerten, vesikulären Zellkernen mit großen Nukleolen. Die Tumorzellformationen sind in lamellär geschichtetes Stroma eingebettet. Im Tumorgewebe können kleine Verkalkungen und im Zytoplasma der Tumorzellen blasse oder hyaline Körper auftreten. Im Gegensatz zu den meisten klassischen HCC zeigen die Tumorzellen des FLC eine positive zytoplasmatische Reaktivität mit Antikörpern gegen K7, EMA und CD68. Das FLC hat im Vergleich zum klassischen HCC in einer zirrhotischen Leber eine bessere Prognose. Die Prognose des FLC und des klassischen HCC in einer nichtzirrhotischen Leber sind aber nicht unterschiedlich1.
Szirrhöses, undifferenziertes, „lymphoepithelioma- like“ und sarkomatoides HCC sind seltenere HCC-Sonderformen, die im Vergleich zum klassischen HCC eine bessere (szirrhöses HCC) oder eine schlechtere (undifferenziertes HCC) Prognose aufweisen. Das „lymphoepithelioma- like“ HCC ist selten, und Daten betreffend Klinik und Prognose sind spärlich. Das sarkomatoide HCC besteht aus Tumorzellen mit spindelzelliger Morphologie und scheint mit wiederholter Chemotherapie assoziiert zu sein. Immunhis – tochemische Untersuchungen können notwendig sein, um eine hepatozelluläre Differenzierung der Tumorzellen nachzuweisen1.
Vorstufen und Frühformen
Die Leberzirrhose ist der wichtigste Risikofaktor für die Entstehung des HCC2. Zu den mikroskopisch identifizierbaren präneoplastischen Läsionen des HCC zählen die klein- und großzellige Veränderung (früher: klein- und großzellige Dysplasie), die auch als expansive, < 1 mm große dysplastische Foci innerhalb eines Leberläppchens oder in einem Regeneratknoten einer zirrhotisch umgebauten Leber auftreten können. Die großzellige Veränderung ist durch atypische Zellen mit vergrößertem Zytoplasma und vergrößerten polymorphen, hyperchromatischen, manchmal mehreren Zellkernen gekennzeichnet. Bei Patienten mit chronischer Hepatitis-C- oder -B-Virusinfektion gilt der Nachweis der großzelligen Veränderung als unabhängiger Risikofaktor für die Entwicklung eines HCC. Bei der kleinzelligen Veränderung sind im Vergleich zum umgebenden Lebergewebe kleinere atypische Zellen mit basophilem Zytoplasma und vergrößerten hyperchromatischen, mäßig polymorphen Zellkernen nachweisbar.
 Dysplastische Knoten treten meist einzeln oder multipel in einer Leberzirrhose auf. Sie unterscheiden sich makroskopisch vom umgebenden Lebergewebe aufgrund von Größe, Textur oder Farbe, die Diagnose einer solchen Läsion erfolgt aber histologisch1, 3.
Dysplastische Knoten treten meist einzeln oder multipel in einer Leberzirrhose auf. Sie unterscheiden sich makroskopisch vom umgebenden Lebergewebe aufgrund von Größe, Textur oder Farbe, die Diagnose einer solchen Läsion erfolgt aber histologisch1, 3.
Geringgradig dysplastische Knoten (low grade dysplastic nodule, LGDN) sind histologisch durch eine im Vergleich zum umgebenden Lebergewebe erhöhte Zelldichte charakterisiert. Architekturveränderungen oder zytologische Atypien fehlen oder treten selten als großzellige Veränderung auf. Innerhalb des LGDN befinden sich Portalfelder und wenige nichttriadale Arterien. In der Bildgebung imponieren sie als iso- oder hypovaskuläre Läsionen1, 3.
Hochgradig dysplastische Knoten (high grade dysplastic nodule, HGDN) sind Läsionen mit architektonischen und/oder zytologischen Atypien, die jedoch die Diagnose eines HCC noch nicht rechtfertigen. Sie zeigen eine deutlich erhöhte Zelldichte, irreguläre trabekuläre Architektur und häufig einige nichttriadale Arterien. Innerhalb der Läsion sind nur wenige Portalfelder nachweisbar. Wie LGDN sind sie in der Bildgebung isooder hypovaskulär. Fokal kann es zum Auftreten von höhergradig dysplastischen Veränderungen bis hin zum HCC im Sinne eines „Knoten-im-Knoten-Phänomens“ kommen. Die Unterscheidung eines HGDN von einem frühen HCC auf Basis der H&E-Histologie alleine ist schwierig (siehe unten)1, 3.
Obwohl das frühe HCC schon seit Längerem von japanischen Experten beschrieben wurde, konnte diese Entität erst vor Kurzem durch ein internationales Expertengremium im Konsensus definiert werden. Es handelt sich dabei um eine hochdifferenzierte Frühform des klassischen HCC mit einem geringeren ma – lignen Potenzial und deutlich besserer 5-Jahres-Überlebensrate von 89 versus 48 %5. Frühe HCC sind unscharf begrenzte, angedeutet knotenförmige Läsionen von zumeist < 2 cm Durchmesser mit den für HGDN beschriebenen Atypien. Häufige Veränderungen sind pseudoglanduläre Architektur und Verfettung. Als wichtigstes Unterscheidungsmerkmal des frühen HCC von einem HGDN gilt die Stromainvasion. Gefäßinvasion ist im Gegensatz zum klassischen HCC nicht typisch. Frühe HCC sind isooder hypovaskulär, oder selten, bei erhöhter Anzahl nichttriadaler Arterien hypervaskulär1, 3.
Das klassische HCC zeigt im Gegensatz zum frühen HCC auch bei kleinem Durchmesser eine deutliche Begrenzung/ Bekapselung, geringere Differenzierung, Blutversorgung ausschließlich über nichttriadale Arterien und Gefäßinvasion. Für die Klassifikation hepatozellulärer Neoplasien ist der immunhistochemische Nachweis der im HCC exprimierten Markerproteine Glypican-3, heat shock protein 70 und Glutaminsynthetase hilfreich. Ein positives immunhistochemisches Resultat für zumindest zwei der drei Marker hat eine Sensitivität von 72 % und eine Spezifität von 100 % für die Diagnose eines HCC4. Expression von Alpha-Fetoprotein ist selten nachweisbar und spricht ebenfalls für ein klassisches HCC1, 3.
Die wichtigsten makroskopischen, histologischen, immunhistochemischen und radiologischen Kennzeichen des Regeneratknotens, LGDN, HGDN, des frühen und klassischen HCC sind in Tabelle 3 zusammengefasst.
Bedeutung der histopathologischen Klassifikation des HCC für die klinische Praxis
Das fortgeschrittene HCC ist ein hypervaskulärer Tumor, der im Kontrastmittel- CT im Vergleich zur nichtneoplastischen Leber durch die Anreicherung des Kontrastmittels in der arteriellen Phase und durch anschließendes Auswaschen während der venösen Phase charakterisiert ist. Diese Veränderungen des Kontrastmittelgehalts im Tumor sind HCC-spezifisch und ermöglichen die routinemäßige nichtinvasive Diagnose. Eine Abklärung eines primären Lebertumors durch Biopsie und histologische Untersuchung ist deshalb häufig nicht notwendig. Eine bioptische Abklärung wird aber bei Tumoren von über 1 cm Durchmesser empfohlen, die sich entweder in der CT oder MR mit Kontrastmittel nicht „HCCtypisch“ verhalten (AASLD-Guidelines 20106). Wird ein HCC histologisch bestätigt, erfolgt die weitere Therapie meist in Anlehnung an die BCLC-Klassifikation (siehe unten). Kann die Histologie ein HCC nicht bestätigen, sollten diese PatientInnen in ein intensiviertes Vorsorgeprogramm aufgenommen werden6.
Obwohl in Studien für eine Reihe von histologischen Parametern im HCC-Gewebe (kleines frühes oder klassisches HCC, histologischer Typ, Differenzierungsgrad, mikroskopische Gefäßinvasion, immunhistochemisch nachweisbare Expression sogenannter Stammzellmarker) eine prognostische Bedeutung gefunden wurde (siehe unten)1, 5, sind derzeit, gemäß der rezenten AASLD-Richtlinie, histologische Parameter für das Patientenmanagement nach erfolgter chirurgischer oder interventionell- radiologischer Therapie nicht von Bedeutung6.
Die Berücksichtigung prognostischer und/oder prädiktiver morphologischer, phänotypischer und molekularer Marker in klinischen Studien könnte zu einer Verfeinerung der Stratifizierung und Individualisierung der HCC-Therapie beitragen. Beispielsweise scheint das frühe HCC im Vergleich zum kleinen, klassischen HCC trotz ähnlicher Tumorgröße eine wesentlich bessere Prognose aufzuweisen5. In der BCLC-Klassifikation wird aber derzeit nur die Tumorgröße bei der Therapieentscheidung berücksichtigt. Vor Kurzem wurde ein HCCSubtyp beschrieben, der bei klassischer H&E- Histologie durch die Expression der Stammzell- bzw. Progenitorzellmarker, K19, epitheliales Zelladhäsionsmolekül (EpCAM) und CD133 charakterisiert ist. Dieser immunhistochemisch definierte HCC-Phänotyp ist im Vergleich zum HCC ohne Expression von Stammzellmarkern mit erhöhter Rezidiv- und Metastasierungsrate und Resistenz gegenüber Chemo- und/oder Radiotherapie assoziiert5. Dieser Subtyp könnte beispielsweise von einer adjuvanten Therapie profitieren. Derzeit laufende genomische und proteomische Studien könnten in Zukunft eine genauere Charakterisierung von HCC und individuelle Therapieentscheidungen anhand eines molekularen Profils ermöglichen1, 6, 8.
Histopathologische Klassifikation – cholangiozelluläres Karzinom
Definition: intrahepatischer maligner Tumor mit biliärer (cholangiozellulärer) Differenzierung (WHO 20109). Geschätzte 5–15 % aller primären Lebertumoren sind cholangiozelluläre Karzinome.
Makroskopische Formen
Cholangiozelluläre Karzinome (cholangiocellular carcinoma, CCC) sind intrahepatische Tumoren, die entweder als gut begrenzte, nicht bekapselte, derbe, grau-weiße Knoten (mass-forming/MF-Typ), als periduktal-infiltrierende, mit Gallengangstenosen/- dilatationen und/oder mit eitriger Cholangitis assoziierte (periductal infiltrating/PI-Typ) oder als intraduktale, polypoide oder papilläre (intraductal growth/IG-Typ) Tumoren auftreten können. Der MF-Typ ist mit 65 % der häufigste makroskopische Typ, der sich im fortgeschrittenen Stadium auch mit multiplen, zum Teil konfluenten Tumorknoten manifestiert9.
Histologische Formen
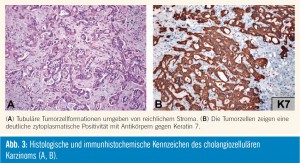
CCC sind Adenokarzinome mit einem meist gut ausgeprägten bindegewebsreichen Stroma mit histologischer Ähnlichkeit zu Adenokarzinomen des Leberhilus (Klatskin-Tumor), der extrahepatischen Gallenwege, der Gallenblase oder des Pankreas. CCC, die in einer nichtbiliären Zirrhose auftreten, zeigen häufig einen duktularen Phänotyp (mit Ähnlichkeit zur duktularen Reaktion). Die Adenokarzinome haben meist eine tubuläre Architektur, seltener sind mikropapilläre, azinäre oder in Zellstränge dissoziierte Tumorzellformationen. Die Tumorzellen sind kubisch, prismatisch oder polymorph, manchmal mit intrazellulärer Muzinbildung und Ähnlichkeit zu Becherzellen. Die Tumorzellen sind positiv mit Antikörpern gegen die cholangiozellulären Keratine 7 und 19 und CEA. Antikörper gegen EMA markieren die luminale Seite der Tumorzellen des duktulären Typs. Die Muzinbildung ist mit Schleimfärbungen histochemisch nachweisbar. Hochdifferenzierte CCC haben gut ausgebildete tubuläre Tumorzellformationen, mittelgradig differenzierte Tumoren zeigen weniger gut definierte tubuläre oder kribriforme und/oder in Zellstränge dissoziierte Zellverbände, während niedrig differenzierte CCC durch schlecht definierte Tubuli und Zellstränge aus hochgradig polymorphen Tumorzellen charakterisiert sind.
Seltenere Sonderformen des CCC sind adenosquamöse, squamöse, muzinöse, siegelringzellige, klarzellige, mukoepidermoide, lymphoepitheliomähnliche und sarkomatoide Karzinome9.
Bedeutung der histopathologischen Klassifikation des CCC für die klinische Praxis
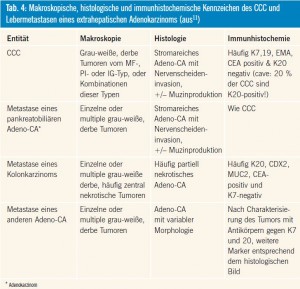 Wichtige Aufgaben der histopathologischen Untersuchung sind Ausschluss einer Metastase eines extrahepatischen Primums und die Diagnosesicherung vor palliativer Chemotherapie. Vor allem Karzinome des Pankreas, der Gallenblase und der Brustdrüse metastasieren nach den Hodentumoren und uvealen Melanomen in die Leber, gefolgt von anderen Karzinomen und Tumoren des Gastrointestinal- und Urogenitaltraktes10. Metastatische Neoplasien zeigen im Vergleich zu den entsprechenden Primärtumoren meist eine vergleichbare Morphologie und immunhistochemisch nachweisbare Marker, die bei der Differenzialdiagnose hilfreich sind (Tab. 4). Problematisch ist allerdings die Unterscheidung zwischen einem CCC und einer Metastase eines pankreatobiliären Adenokarzinoms, da diese Tumortypen weder histologisch noch immunhistochemisch Unterschiede aufweisen11.
Wichtige Aufgaben der histopathologischen Untersuchung sind Ausschluss einer Metastase eines extrahepatischen Primums und die Diagnosesicherung vor palliativer Chemotherapie. Vor allem Karzinome des Pankreas, der Gallenblase und der Brustdrüse metastasieren nach den Hodentumoren und uvealen Melanomen in die Leber, gefolgt von anderen Karzinomen und Tumoren des Gastrointestinal- und Urogenitaltraktes10. Metastatische Neoplasien zeigen im Vergleich zu den entsprechenden Primärtumoren meist eine vergleichbare Morphologie und immunhistochemisch nachweisbare Marker, die bei der Differenzialdiagnose hilfreich sind (Tab. 4). Problematisch ist allerdings die Unterscheidung zwischen einem CCC und einer Metastase eines pankreatobiliären Adenokarzinoms, da diese Tumortypen weder histologisch noch immunhistochemisch Unterschiede aufweisen11.
Für einige makroskopische und histologische Parameter konnte in Studien eine prognostische Bedeutung gefunden werden. So sind die makroskopischen MFund PI-Typen mit schlechterer Prognose als der IG-Typ assoziiert. Bei resezierten CCC ist vor allem eine R0-Resektion entscheidend für die Prognose. Marker, die mit schlechter Prognose einhergehen, sind regionäre Lymphknotenmetastasen, makroskopische Gefäßinvasion, Tumormanifestationen in beiden Leberlappen, intrahepatische Metastasierung und fortgeschrittenes TNM-Stadium sowie immunhistochemischer Nachweis von MUC5AC9. Diese Faktoren können auf individueller Basis bei Therapieentscheidungen berücksichtigt werden.
FACT-BOX
Hepatozelluläres Karzinom
• Die Diagnose eines HCC wird derzeit in der Mehrzahl der Fälle anhand bildgebender Verfahren gestellt. Eine Abklärung eines primären Lebertumors durch Biopsie und histologische Untersuchung ist deshalb zur Diagnosestellung häufig nicht notwendig.
• Therapieentscheidungen bei HCC-PatientInnen basieren häufig auf der Barcelona Clinic Liver Classification (BCLC), die neben den radiologischen Befunden auch Parameter der Leberfunktion und den Allgemeinzustand berücksichtigt.
• Eine bioptische Abklärung wird bei Tumoren von über 1 cm Durchmesser empfohlen, die sich zumindest in einer von zwei unterschiedlichen radiologischen Untersuchungen mit Kontrastmittel nicht „HCC-typisch“ verhalten. Wird ein HCC histologisch bestätigt, erfolgt die weitere Therapie meist in Anlehnung an die BCLC-Klassifikation. Kann die Histologie ein HCC nicht bestätigen, sollten diese PatientInnen in ein intensiviertes Vorsorgeprogramm aufgenommen werden.
• Obwohl in Studien für eine Reihe von histopathologischen Parametern im HCC-Gewebe eine prognostische Bedeutung gefunden wurde, sind derzeit gemäß der rezenten AASLD-Richtlinie histologische Parameter für das PatientInnenmanagement nach chirurgischer oder interventionellradiologischer Therapie nicht von Bedeutung. Für personalisierte Therapiestrategien in der Zukunft wird die histologische und molekulare Charakterisierung des HCC jedoch entscheidend werden, weshalb von mehreren Autoritäten im HCC-Feld bereits jetzt wieder die routinemäßige Biopsie gefordert wird.
1 Theise ND et al., Hepatocellular carcinoma. In: WHO Classification of Tumors of the digestive System (2010), pp205–216. WHO PRESS World Health Organization, Geneva Switzerland.
2 Theise ND, Cirrhosis and hepatocellular neoplasia: more like cousins than like parent and child. Gastroenterolog 1996; 111:526–528
3 Anon (The International Consensus Group for Hepatocellular Neoplasia), Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology 2009; 49:658–664
4 Di Tommaso L, Franchi G, Park YN, Fiamengo B, Destro A, Morenghi E et al., Diagnostic value of Hsp 70, glypican3 and glutamine synthetase in hepatocellular nodules in cirrhosis. Hepatology 2007; 45:725–734
5 Roncalli M et al., Histopathological classification of hepatocellular carcinoma. Dig Liver Dis 2010; 42(Suppl3):228–234
6 AASLD practice guideline: Bruix J, Sherman M. Management of Hepatocellular carcinoma. An Update. Hepatology July 2010
7 Forner A et al., Current strategy for staging and treatment: the BCLC update and future prospects. Semin Liver Dis 2010; 30:61–74
8 Hoshida Y et al., Molecular classification and novel targets in hepatocellular carcinoma: recent advancements. Semin Liver Dis 2010; 30:35–51
9 Nakanuma Y et al., Intrahepatic cholangiocarcinoma (2010),pp217–224. In: WHO Classification of Tumors of the digestive System. WHO PRESS World Health Organization, Geneva, Switzerland.
10 Iacobuzio-Donahue et al., Secondary tumors of the liver (2010), pp251– 253. In: WHO Classification of Tumors of the digestive System. WHO PRESS World Health Organization, Geneva Switzerland.
11 Saxena R et al., Dagnostic algorithms for tumors of the liver pp 254–261. In: WHO Classification of Tumors of the digestive System. WHO PRESS World Health Organization, Geneva Switzerland