Neuroimaging bei Demenzerkrankungen
MRT in der Demenzdiagnostik
Findet sich keine relevante strukturelle Läsion, und steht eine amnestische Störung im Vordergrund, so liegt die Vermutung einer neurodegenerativen, im häufigsten Fall einer Alzheimer- Demenz (AD) nahe. Bei dieser Form gibt es eine Reihe von Positivkriterien, die mittels Magnetresonanztomographie (MRT) dargestellt werden können, z. B. gelten bilaterale Hippocampusatrophie und erweiterte innere und äußere Liquorräume als frühe Anzeichen1, 2. Darüber hinaus kann der morphologische Krankheitsverlauf dokumentiert werden2.
Im weiteren Verlauf der AD zeigen sich oft Abnormalitäten der neokortikalen grauen Substanz und des Corpus callosum. Über die Messung des Volumens des Hippocampus hinaus gibt es heute auch weitere Methoden zur Vermessung der Entorhinalkortexatrophie und zur Bestimmung der kortikalen Dichte. Im Verlauf der Erkrankung nimmt auch die kortikale Atrophie zu, die gut mit der demenziellen Symptomatik korreliert2. Ein Nachteil der hierfür notwendigen, sehr genauen strukturellen Untersuchungen ist, dass die PatientInnen absolut ruhig liegen müssen, und das über eine relativ lange Zeit.
Dies ist oft nicht möglich, und es kommt zu Artefakten. Diesem Problem kann heute durch parallele Bildgebung (Partially Parallel Acquisition) begegnet werden. Damit können Artefakte durch eine Rekonstruktion ausgeglichen werden, allerdings auf Kosten des Signal-zu-Rausch-Verhältnisses.
Mit der Perfusions-MRT hat man die Möglichkeit, den zerebralen Blutfluss zu messen. Die Charakteristika, die mittels Perfusion erfasst werden, weisen bei AD ganz bestimmte Abnormalitäten auf3. Ebenso ist eine Differenzialdiagnose der AD z. B. von der vaskulären Demenz möglich4.
MRS: Eine weitere Möglichkeit in der MRT-Bildgebung ist die Messung der Konzentration bestimmter Metaboliten im Gehirn mittels Protonen-Magnetresonanz-Spektroskopie (MRS). Auch hier wurden PatientInnen mit unterschiedlichen kognitiven Störungen untersucht. Bei der Entwicklung von Alzheimer-Demenz zeigt sich eine stärkere Abnahme des N-Acetylaspartat-Spiegels. Des Weiteren kann der Verlauf von leichter kognitiver Störung zu AD durch reduzierte absolute Konzentration von Kreatin vorhergesagt werden5.
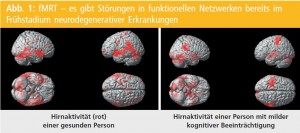
fMRT: Neben diesen künftigen Standardverfahren zum Nachweis der Alzheimer-Demenz – wobei diese zu einem Teil bereits den Status eines Biomarkers haben – gibt es noch weitere Ansätze. Mittels funktioneller MRT kann bei Alzheimer-Demenz schon in frühen Stadien eine reduzierte Hirnaktivität bilateral parietotemporal nachgewiesen werden1. Weiters zeigen z. B. AD-PatientInnen beim Abspeichern von Gedächtnisinhalten eine geringere Aktivierung des medialen Temporallappens6. Erstaunlicherweise zeigt sich in einem sehr frühen Stadium des kognitiven Abbaus eine höhere Aktivierung im Hippocampus während einer visuellen Merkaufgabe. Dies wird als Kompensationsmechanismus interpretiert und lässt gewisse Rückschlüsse auf den pathophysiologischen Verlauf der Erkrankung zu. Da sich zeigte, dass diese funktionellen Veränderungen mit einem stärkeren kognitiven Abbau in den 6 Folgejahren zusammenhängen7 könnte das einen gewissen prognostischen Wert haben. Könnte man die Entwicklung einer Demenz also mit Sicherheit schon in diesem Frühstadium vorhersagen, so könnten in Zukunft geeignete Medikamente bereits sehr früh eingesetzt werden, um den Verlauf zu lindern.
Automatisierte Diagnose: Neuere Entwicklungen von intelligenter Computersoftware integrieren diverse Merkmale, die mittels MRT erfasst werden, in eine automatisierte Diagnose. Hierzu dient ein Algorithmus, der die krankheitsspezifischen Atrophiemerkmale erfasst und anhand einer Reihe von sicher diagnostizierten DemenzpatientInnen lernt, wie diese Merkmale typischerweise ausgeprägt sind. Aufgrund dieses Wissens kann der Algorithmus dann bei neuen, noch nicht diagnostizierten PatientInnen einen Vorschlag für eine Diagnose machen8.
PET in der Demenzabklärung
Schon seit Jahrzehnten wird auch die (ursprüngliche) funktionelle Bildgebung mit PET (Positronenemissionstomographie) bzw. SPECT (Single-Photon-Emissions-Tomographie) zur Abklärung von Demenzen herangezogen. Die Fragestellungen beziehen sich meist auf die Diagnose bzw. Differenzialdiagnose verschiedener demenzieller Zustandsbilder, auf Früherkennung, Auswirkungen unterschiedlicher Medikamente sowie auf den Krankheitsverlauf und die Prognoseabschätzung. Zur Anrwendung gelangt dabei vor allem die Untersuchung des zerebralen Glukosemetabolismus unter Verwendung von 18F-FDG (Fluoro-2-deoxy-D-Glukose) und PET als Maß für neuronale bzw. synaptische Aktivität.
Vor allem in der visuellen Beurteilung sind für Perfusionsuntersuchungen mit 99mTc-HMPAO- oder ECD-SPECT ähnliche Ergebnisse wie bei der FDG-PET zu erwarten, auch wenn bei der SPECT-Technik eine geringere Auflösung vorliegt und Perfusionsuntersuchungen durch die Abhängigkeit vom pCO2 eine höhere Variabilität aufweisen als Darstellungen des Glukosestoffwechsels.
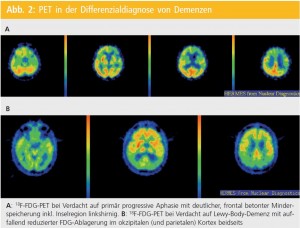
Hohe Sensitivität und Spezifität: In vielen Publikationen konnten für einzelne Demenztypen charakteristische Speichermuster festgestellt werden (siehe auch Teune et al.9). So tritt bei der AD Mindermetabolismus/Minderperfusion im temporoparietalen Assoziationskortex mit Betonung der Gyrus angularis ein. Auch der posteriore Gyrus cinguli und der Precuneus zeigen früh im Erkrankungsverlauf eine Mitbeteiligung. Der frontale Kortex ist meist erst im Krankheitsverlauf mitbetroffen. Ausmaß und Ausdehnung der (Glukose-)Minderaktivitäten korrelieren mit der Klinik. Verhältnismäßig selten wird über mesiotemporale Auffälligkeiten berichtet: Grund dafür dürften die visuell erschwerte Beurteilung bei kleiner Struktur und der prinzipiell niedrigere Stoffwechsel ebendort sowie der Partial-Volume-Effekt sein.
In einer rezenten Review-Arbeit von Bohnen et al.10 wird für die FDG-PET eine Sensitivität von 96 % bzw. eine Spezifität von 90 % bei der Abgrenzung von (klinisch diagnostizierten) AD-PatientInnen von Normalpersonen beschrieben. Selbst bei histopathologisch verifizierter AD betrug die Sensitivität der FDGPET 94 % bzw. die Spezifität 73 %. Aber auch für die differenzialdiagnostische Abgrenzung einer AD von anderen Demenzformen wie der frontotemporalen (FTD) oder Lewy-Body-Demenz (LBD) eignet sich die FDG-PET hervorragend (gepoolte Sensitivität 87 %, Spezifität 81 %).
Besonderes Interesse gilt – auch in Hinblick auf mögliche therapeutische Interventionen – dem Nachweis AD-typischer Veränderungen im Früh- und auch Vorstadium dieser Erkrankung. So wurde bereits Anfang der 2000er Jahre ein reduzierter Glukosestoffwechsel in temporoparietalen Assoziationsarealen bei kognitiv Gesunden mit familiärer Belastung und positivem ApoE-epsilon4-Allel gefunden. Auch gelang es in mehreren Untersuchungen aufzuzeigen, dass die FDG-PET beim Mild Cognitive Impairment (MCI) mit einer hohen Sensitivität eine Konversion in eine AD vorhersagen kann (z. B. Drzezga et al.11: Sensitivität 92 % und Spezifität von 89 % der FDG-PET in einem Beobachtungszeitraum von 16 Monaten). Am aussagekräftigsten sind dabei Veränderungen temporoparietal sowie im Bereich des posterioren Gyrus cinguli (siehe auch Übersichtsarbeiten von Mosconi12 und Herholz13).
Automatisierte Verfahren: Um den Limitationen der (stark untersucherabhängigen) visuellen Beurteilung von MRT- oder PET- und SPECT-Studien beizukommen, werden heute auch schon in der Routine automatisierte Verfahren eingesetzt: Studien werden anfangs auf ein Normhirn reorientiert, und schließlich werden die erhobenen Daten voxelweise mit den Werten einer Normpopulation statistisch verglichen und Abweichungen in Form von z. B. Z-Scores abgebildet. Diese Darstellungen können 2- (wie in SPM) aber auch 3-dimensional (3D-SSP) erfolgen.
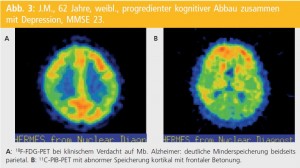
Amyloidmarker: In Anbetracht der in Entwicklung befindlichen Anti-Amyloid-Therapien wäre eine möglichst frühzeitige Diagnose wünschenswert, z. B. vor Entwicklung einer deutlichen Neurodegeneration. Im letzten Jahrzehnt gelang es, eine Reihe von Amyloidmarkern zu entwickeln, die eine hoch sensitive Darstellung der (fibrillären) Amyloid-β-Plaques und auch des vaskulären Amyloids erlaubt. Am häufigsten wurde bisher mit 11C markiertes PIB (Pittsburgh Compound B), ein Thioflavin-T-Derivat, und PET eingesetzt; derzeit stehen eine Reihe von mit 18F markierten, verwandten Liganden knapp vor ihrer Zulassung bzw. laufen die Zulassungsstudien. Obwohl noch nicht für all diese Liganden – sondern in erster Linie für PIB – umfassende Studien und Publikationen vorliegen, so scheinen doch für alle erwähnten Substanzen folgende Eigenschaften zu gelten: hohe Affinität zu Aβ-Plaques, hohe Bindung im frontalen sowie parietalen und temporalen Assoziationskortex, schwache Korrelation zur Klinik, relativ stabiles Ausmaß der Speicherung im Beobachtungszeitraum, positiver PET-Scan bei einem hohen Prozentsatz kognitiv Gesunder (z. B. > 30 % bei 80-Jährigen).
Beim MCI kann das Ausmaß der PIB-Speicherung sowohl jenem bei Gesunden, aber auch jenem bei AD entsprechen bzw. dazwischen liegen. An die 70 % der PIB-positiven MCI-PatientInnen entwickeln in den folgenden 3 Jahren eine AD; in mehreren Studien konnte aufgezeigt werden, dass vor allem PatientInnen mit amnestischen MCI und positiver Amyloid-PET eine Progression zur AD erfahren. Im Stadium des MCI ist (im Gegensatz zur AD) anscheinend ein Zusammenhang zwischen dem Ausmaß der PIB-Speicherung und der Reduktion des episodischen Gedächtnisses fassbar.
Auch in der Differenzialdiagnose verschiedener Demenzformen wurde die Amyloid-PET erfolgreich eingesetzt: während bei der Frontotemporalen Demenz und der Parkinson-Demenz keine pathologische Amyloid-PET gefunden wurde, waren die Ergebnisse bei Lewy-Body-Demenz sehr häufig positiv, d. h. pathologisch.
In einer ersten Therapiestudie mit dem Anti-Amyloid-β-monoklonalen Antikörper Bapineuzumab konnte in der PIB-PET tatsächlich eine Amyloidreduktion nachgewiesen werden, allerdings ohne Auswirkung auf die kognitive Situation14.
Künftige Amyloidmarker: Wie bereits angeführt, werden in absehbarer Zeit ein oder mehrere 18F-markierte Amyloidmarker eingesetzt werden: so ist Flutemetamol ein PIB-Derivat, während Florbetaben und Florbetapir bei unterschiedlichen Ausgangssubstanzen auch ein leicht unterschiedliches Speicherverhalten und eine höhere unspezifische Traceraufnahme (im Marklager) und damit Hintergrundaktivität aufweisen. Flutemetamol zeigte im Vergleich von AD-PatientInnen mit altersentsprechend gesunden Kontrollpersonen jeweils eine 93%ige Sensitivität und Spezifität in der Abgrenzung.
Abschließend sei noch auf 18F-FDDNP hingewiesen, das zwar mit geringerer Affinität am Amyloid bindet, aber auch eine spezifische Bindung an den neurofibrillären Tangles aufweist und im Gegensatz zu den bereits erwähnten Amyloidmarkern daher auch eine erhöhte Speicherung im Hippocampusbereich zeigt. Weitere Liganden sind in Entwicklung.
Genauere Details sind in Übersichtsarbeiten von Quigley et al.15, Herholz & Ebmeier16 und Rowe & Villemagne17 ersichtlich.
Diagnosekriterien: 2007 wurde von Dubois et al.18 angeregt, die klinischen (NINCDSADRDA und DSM-IV) Diagnosekriterien einer AD für wissenschaftliche Fragestellungen insofern zu ändern bzw. zu erweitern, als neben der Einschränkung des episodischen Gedächtnisses ein oder mehrere positive Biomarker gefordert wurden, darunter auch pathologische FDG- und Amyloid-PET-Ergebnisse. Ob sich dieser Vorschlag zunächst in wissenschaftlichen Kreisen durchsetzt, ist derzeit hinsichtlich des Einsatzes der PET-Technik noch offen.
Resümee
Zusammenfassend können mit den heute zur Verfügung stehenden bildgebenden Methoden wie MRT und PET verschiedene unterschiedliche Aspekte eines demenziellen Prozesses dargestellt und untersucht werden. So ist es möglich, Amyloid-Plaques nachzuweisen; welchen Stellenwert diese neuen, mit 18F markierten und daher gut verfügbaren Amyloidmarker in der täglichen Routine erlangen werden, wird allerdings erst die Zukunft weisen.
1 Almkvist O & Winblad B. Early diagnosis of Alzheimer dementia based on clinical and biological factors. Eur Arch Pschiatry Clin Neurosci 1999; 249 Suppl 3:3–9.
2 Ewers M, Frisoni GB et al., Staging Alzheimer’s disease progression with multimodality neuroimaging. Progress in Neurobiology 2011; 95:535–546.
3 Anderson VC, Litvack ZN, Kaye JA.Magnetic resonance approaches to brain aging and Alzheimer disease-associated neuropathology. Top Magn Reson Imaging 2005; 16(6):439–452.
4 Chen W, Song X, Beyea S et al., Advances in perfusion magnetic resonance imaging in Alzheimer’s disease. Alzheimers Dement 2011; 7(2):185–196.
5 Pilatus U, Lais C, Rochmont Adu M et al., Conversion to dementia in mild cognitive impairment is associated with decline of N-actylaspartate and creatine as revealed by magnetic resonance spectroscopy. Psychiatry Res 2009; 173(1):1–7.
6 Machulda MM, Ward HA, Borowski B et al., Comparison of memory fMRI response among Normal, MCI, and Alzheimer’s patients. Neurology 2003; 61(4):500–506.
7 Miller SL, Fenstermacher E, Bates J et al., Hippocampal activation in adults with mild cognitive impairment predicts subsequent cognitive decline. J Neurol Neurosurg Psychiatry 2008; 79(6):630–635.
8 Klöppel S. New possibilities for automated diagnosis of dementia. Nervenarzt 2010; 81(12):1456–1459.
9 Teune LK, Bartels AL, de Jong BM et al., Typical cerebral metabolic patterns in neurodegenerative brain diseases. Mov Disord 2010; 25(14):2395–404.
10 Bohnen NI, Djang DS, Herholz K et al., Effectiveness and safety of 18F-FDG PET in the evaluation of dementia: a review of the recent literature. J Nucl Med 2012, 53(1):59–71.
11 Drzezga A, Grimmer T, Riemenschneider M et al., Prediction of individual clinical outcome in MCI by means of genetic assessment and (18)F-FDG PET. J Nucl Med 2005; 46(10):1625–32.
12 Mosconi L. Brain glucose metabolism in the early and specific diagnosis of Alzheimer’s disease. FDG-PET studies in MCI and AD. Eur J Nucl Med Mol Imaging 2005; 2032(4):486–510.
13 Herholz K. Cerebral glucose metabolism in preclinical and prodromal Alzheimer’s disease. Expert Rev Neurother 2010; 10(11):1667–73.
14 Rinne JO, Brooks DJ, Rossor MN et al., 11C-PiB PET assessment of change in fibrillar amyloid-beta load in patients with Alzheimer’s disease treated with bapineuzumab: a phase 2, double-blind, placebocontrolled, ascending-dose study. Lancet Neurol 2010; 9(4):363–72.
15 Quigley H, Colloby SJ, O’Brien JT. PET imaging of brain amyloid in dementia: a review. Int J Geriatr Psychiatry 2010; 26(10):991–9.
16 Herholz K, Ebmeier K. Clinical amyloid imaging in Alzheimer’s disease. Lancet Neurol 2011; 10(7):667–70.
17 Rowe CC, Villemagne VL. Brain amyloid imaging. J Nucl Med 2011; 52(11):1733–40.
18 Dubois B, Feldman HH, Jacova C et al. Research criteria for the diagnosis of Alzheimer s disease: revising the NINCDS-ADRDA criteria. Lancet Neurol 2007; 6(8):734–46.