Neuroimaging bei amyotropher Lateralsklerose
Zahlreiche bildgebende Studien der letzten Jahre stellten die Ergebnisse von computerbasierten MRT-Analysen auf Gruppenniveau dar und halfen so mit, die pathomorphologischen Veränderungen in der grauen und weißen Substanz sowie Veränderungen der funktionellen Netzwerke zu erfassen und verstehen2. Wie in einer aktuellen Publikation dargestellt3, sind die meistversprechenden Techniken Volumetrie/Morphometrie von T1-gewichtetem (T1w) 3-D-MRT, Diffusionstensor-Bildgebung (DTI), funktionelle MRT ohne spezifische Aufgabenstellung (Resting-State- [RS]-fMRT) sowie 1H-MR-Spektroskopie (MRS).
Potenzial der MRT in der Individualdiagnostik
Für Routine-T2-gewichtete (T2w) und FLAIRMRT (fluid-attenuated inversion recovery) wurden Hyperintensitäten des Tractus corticospinalis (CST) bei PatientInnen mit MND wiederholt beschrieben, insbesondere im Gehirn, teilweise auch spinal. Auch fokale Atrophien oder Hypointensitäten (motor dark line in T2w MRT) im Bereich des präzentralen Gyrus wurden berichtet (Übersicht Grosskreutz et al.4).
Als weitere Auffälligkeiten in der klinischen MRT können bei ALS-PatientInnen, die neuropsychologische Symptome als Hinweise auf das Vorliegen eines ALS-FTD-Komplexes (FTD/frontotemporale-Demenz) aufweisen, häufig regionale Atrophien der frontalen und/oder temporalen Areale in symmetrischer oder (häufiger) asymmetrischer Ausprägung im Sinne einer frontotemporalen Lobärdegeneration gesehen werden. Diese können in fortgeschrittenen Einzelfällen deutlich ausgeprägt sein, aber es ist festzuhalten, dass frontale Volumenminderungen auch bei ALS-PatientInnen ohne sichere klinische Zeichen einer frontotemporalen Demenz (FTD) beobachtet werden können5. Für alle diese morphologischen MRT-Befunde lässt sich zusammenfassen, dass ihre Sensitivität und Spezifität als niedrig anzusehen ist4,6-8.
Die Guidelines der EFNS (European Federation of Neurological Societies) für Neuroimaging bei MND1 enthalten dementsprechend folgende Empfehlungen für klinische Routine-MRT: Zum Ersten sollen PatientInnen mit Verdacht auf MND, abhängig vom klinischen Bild, im Rahmen der Differenzialdiagnostik ein MRT des Gehirns und/oder des Rückenmarks/der Wirbelsäule erhalten. Zum Zweiten können die häufig berichteten Hyperintensitäten im Bereich der CST und des Motorkortex in T2w-Aufnahmen, protonengewichteten Aufnahmen oder FLAIR-Aufnahmen einen Verdacht auf ALS unterstützen, aufgrund der niedrigen Sensitivität und Spezifität dieses Zeichens kann eine Diagnose dadurch jedoch nicht gesichert werden.
PET und SPECT: Früher bei MND angewendete Bildgebungstechniken wie Positronenemissionstomographie (PET) und Single-Photonen- Emissionstomographie (SPECT) konnten zwar regionale Auffälligkeiten bei ALS im Sinne von Hypometabolismus bzw. Hypoperfusion im Motorkortex und auch in frontalen Arealen darstellen, jedoch wurde das Potenzial der Verwendung von PET und SPECT im Hinblick auf die zunehmende Verfügbarkeit von MRT-Scannern nicht weiterentwickelt9, so dass MRT-basierte Techniken als die aktuellen und zukünftigen Neuroimaging-Instrumente bei ALS/MND anzusehen sind.
MRT-Studien bei ALS auf Gruppenniveau
Weiterführende MRT-Analysetechniken auf Gruppenniveau benutzten ROI-basierte (region of interest) volumetrische Analysen des Motorsystems (Übersicht: Wang et al.10) oder ganzhirnbasierte Auswertungen auf Voxelebene (voxelbasierte Morphometrie, VBM) und zeigten Volumenänderungen in motorischen Arealen wie dem primären Motorkortex und den CST11. Für Gruppen von ALS-PatientInnen wurden hierbei Atrophien der frontalen und temporalen Areale in stark unterschiedlicher Ausprägung beschrieben und in Bezug zum neuropsychologischen Profil analysiert (Übersicht: Grosskreutz et al.4).
DTI: Eine bei neurologischen Erkrankungen zunehmend verwendete MRT-Untersuchungsmethode zur Darstellung von mikrostrukturellen Veränderungen in der weißen Substanz ist das diffusionsgewichtete MRT (DWI) und insbesondere dessen Weiterführung der Diffusionstensorbildgebung (DTI), bei der die Diffusivität entlang der axonalen Bahnen abgebildet und als fraktionale Anisotropie (FA) quantifiziert werden kann, wodurch Rückschlüsse auf die Integrität der neuronalen Fasern ermöglicht werden12.
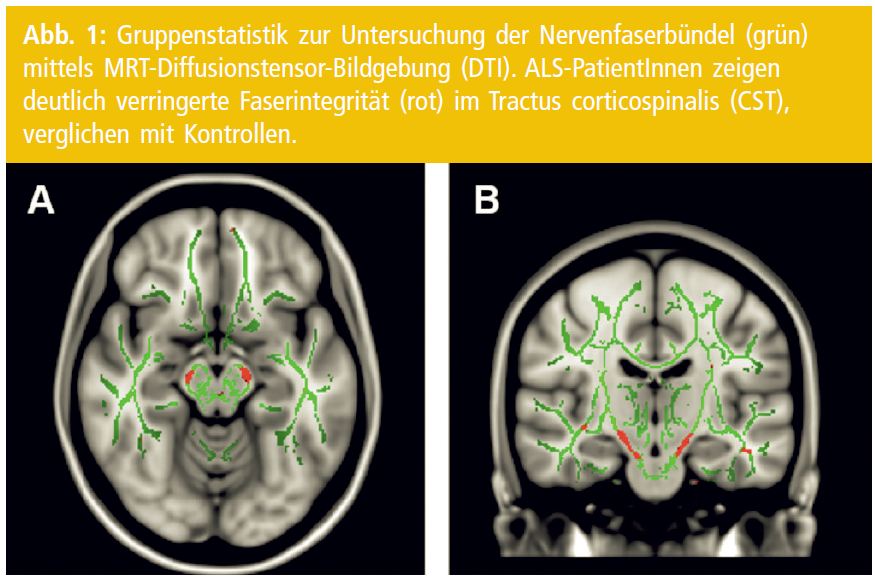
Auf Gruppenniveau wurden Veränderungen in den Diffusionseigenschaften der weißen Substanz sowohl bei ALS als auch bei der klinischen Variante der primären Lateralsklerose (PLS) entlang der CST dargestellt (Abb. 1)13 und in Bezug gesetzt zu anderen bildgebungsimmanenten Techniken wie morphometrischen MRT-Analysen14, mit neurodegenerativen Prozessen einhergehenden und mittels MRT detektierbaren Eisenablagerungen15 oder anderen Methoden wie der transkraniellen Magnetstimulation16.
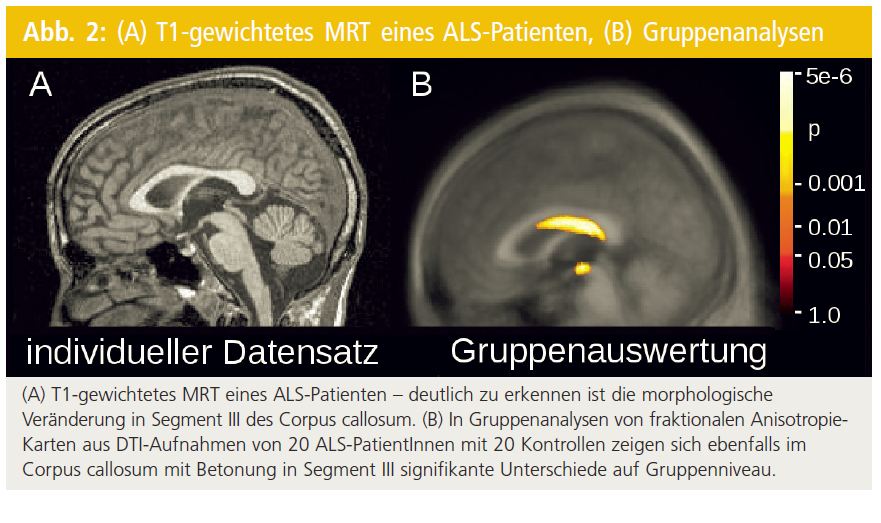
Die in T1-gewichteten Aufnahmen teilweise auch auf Einzelfallniveau zu erkennenden morphologischen Veränderungen im Corpus callosum, häufig mit Akzentuierung im Motorsegment III nach der Hofer-und-Frahm-Klassifikation, konnten bei Analysen von fraktionalen Anisotropie-Maps bei Patientenkollektiven mit ALS und anderen MND mit Beteiligung des ersten Motoneurons gezeigt werden (Abb. 2) (vgl. Müller et al.17).
Die Kombination von DTI-basierter Traktdarstellung mit VBM zeigte auch bei ALS im frühen Stadium eine Beteiligung der weißen Substanz18,19. Korrelationen von DTI-basierten und klinischen Parametern hinsichtlich des Phänotyps und des Verlaufs bei ALS und anderen MND konnten in einzelnen Studien nachgewiesen werden (Übersicht: Kassubek et al.20). Erste Studien zu Änderungen der Diffusionseigenschaften im Rückenmark bei ALS wurden durch Anwendung von spinalen DTI-Techniken durchgeführt21.
MRS: Ein weiterer technischer Ansatz ist die MR-Spektroskopie (MRS), welche sich in einzelnen Studien als sensitiv bezüglich regionaler metabolischer Veränderungen in Gehirnen von ALS-PatientInnen erwiesen hat9 und auch in longitudinalen Studien untersucht wurde22.
Bei spezifisch hohem Standardisierungsbedarf bezüglich der Datenakquisition wie auch -analyse ist aktuell das Potenzial der MRS als Surrogatmarker bei MND als limitiert einzuordnen, jedoch existieren auch für diese MRT-Applikation entsprechende Initiativen3.
fMRT: Mithilfe der “klassischen” fMRT konnten Veränderungen in multiplen funktionellen Netzwerken des Gehirns bei ALS-PatientInnen sowohl im Vergleich zu Kontrollen als auch in Längsschnittstudien nachgewiesen werden, so zeigten sich neben Veränderungen der motorischen auch solche der kognitiven Funktionsareale (Übersicht Lulé et al.23).
Die multiparametrische Kombination mit Techniken wie DTI demonstrierte darüber hinaus Auffälligkeiten nicht nur in somatosensorischen, sondern auch in auditorischen und visuellen zerebralen Funktionsarealen24.
Als eine zukunftsweisende MRT-Technik ist das RS-fMRT anzusehen, d.h. die Analyse der blutoxygenierungsabhängigen Effekte (BOLD) in Gradientenecho-MRT-Sequenzen ohne gleichzeitige Durchführung einer definierten Tätigkeit, somit “in Ruhe”. Hierdurch konnten Veränderungen der funktionellen Konnektivität in unterschiedlichen Netzwerken bei ALSPatientInnen dargestellt werden, zusätzlich zu erhöhter Patienten-Compliance im Vergleich zu klassischen fMRT-Paradigmen25,26.
Zusammenfassung und Ausblick
Die Bildgebung bei ALS hat auf dem Boden der umfangreichen Datenlage in vivo auf Gruppenniveau sowohl durch Strukturanalysetechniken (Volumetrie, VBM, DTI) als auch durch Funktionsanalysetechniken (z.B. fMRT-Anwendungen) zu einer deutlichen Vertiefung des pathoanatomischen Verständnisses dieser Erkrankungen geführt. Auch wenn diese Techniken auf der Ebene der Individualdiagnostik noch in der Entwicklung befindlich sind und der Wert für die Frühdiagnostik oder für klinisch nicht sicher zuzuordnende Fälle noch unklar ist, besteht hier ein erhebliches Potenzial dieser multiparametrischen MRT-Analysen für eine Etablierung als Surrogatmarker für das Monitoring in zukünftigen Studien von erkrankungsverlaufsmodifizierenden Maßnahmen.
Schritte zur Verbesserung des Einsatzes der MRT-Techniken auf Individualniveau sind daher eine größere Zahl an longitudinalen Studien in Frühstadien oder bei klinischer Unsicherheit und auch die weitere Standardisierung der Akquisition und computerbasierten Auswertung der MRT-Daten.
Diese notwendige Entwicklung kann durch die Einrichtung multizentrischer (multinationaler) Neuroimaging-Datenbanken von MND-PatientInnen wesentlich gefördert werden, denn zur Optimierung und Standardisierung sowohl der Datenakquisition als auch des Postprocessing sind qualitätskontrollierte multizentrische MRT-Register mit paralleler Erfassung detaillierter klinischer Daten einschließlich longitudinaler Daten als wesentliches Instrument zu sehen.
1 Filippi M et al., European Federation of Neurological Societies. EFNS guidelines on the use of neuroimaging in the management of motor neuron diseases. Eur J Neurol 2010; 17(4):526e20.
2 Agosta F et al., The present and the future of neuroimaging in amyotrophic lateral sclerosis. AJNR Am J Neuroradiol 2010; 31(10):1769-77.
3 Turner MR et al., members of “The 1st NISALS”. Towards a neuroimaging biomarker in amyotrophic lateral sclerosis. Lancet Neurol 2011; 10(5):400-3.
4 Grosskreutz J et al., Whole brain-based computerized neuroimaging in ALS and other motor neuron disorders. Amyotroph Lateral Scler. 2008 Aug; 9(4):238-48.
5 Kassubek J et al., Neuroimaging of motor neuron diseases. Ther Adv Neurol Disord, in press.
6 Comi G et al., Review neuroimaging in amyotrophic lateral sclerosis. Eur J Neurol 1999; 6(6):629-37
7 Chan S et al., Amyotrophic lateral sclerosis and primary lateral sclerosis: evidence-based diagnostic evaluation of the upper motor neuron. Neuroimaging Clin N Am 2003; 13(2):307-26.
8 Turner MR et al., Biomarkers in amyotrophic lateral sclerosis. Lancet Neurol 2009; 8(1):94-109.
9 Turner MR, Leigh PN, Positron emission tomography (PET) – its potential to provide surrogate markers in ALS. Amyotroph Lateral Scler Other Motor Neuron Disord 2000 Jun; 1 Suppl 2:S17-22.
10 Wang S, Melhem ER, Amyotrophic lateral sclerosis and primary lateral sclerosis: the role of diffusion tensor imaging and other advanced MR-based techniques as objective upper motor neuron markers. Ann NY Acad Sci 2005; 1064:61-77.
11 Kassubek J et al., Global brain atrophy and corticospinal tract alterations in ALS, as investigated by voxelbased morphometry of 3-D MRI. Amyotroph Lateral Scler Other Motor Neuron Disord 2005; 6(4):213-20.
12 Basser, PJ, Jones DK, Diffusion-tensor MRI: theory, experimental design and data analysis – a technical review. NMR Biomed 2002; 15:456-67.
13 Ciccarelli O et al., Investigation of white matter pathology in ALS and PLS using tract-based spatial statistics. Hum Brain Mapp 2009; 30(2):615-24.
14 Müller H-P et al., Complementary image analysis of diffusion tensor imaging and 3-dimensional T1- weighted imaging: white matter analysis in amyotrophic lateral sclerosis. J Neuroimaging 2011; 21(1):24-33.
15 Langkammer C, Enzinger C et al., Mapping of iron deposition in conjunction with assessment of nerve fiber tract integrity in amyotrophic lateral sclerosis. J Magn Reson Imaging 2010; 31(6):1339-45.
16 Sach M et al., Diffusion tensor MRI of early upper motor neuron involvement in amyotrophic lateral sclerosis. Brain 2004 (Pt 2); 127:340-50
17 Müller H-P et al., Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler, in press.
18 van der Graaff MM et al., Upper and extra-moto – neuron involvement in early motoneuron disease: a diffusion tensor imaging study. Brain 2011; 134(Pt 4):1211-28.
19 Agosta F et al., Voxel-based morphometry study of brain volumetry and diffusivity in amyotrophic lateral sclerosis patients with mild disability. Hum Brain Mapp 2007; 28(12):1430-8.
20 Kassubek J, Ludolph AC, Multimodality approach to neuroimaging in ALS / FTD. In: M. Strong (Ed.): Amyotrophic lateral sclerosis and the frontotemporal dementias. Oxford University Press, in press.
21 Nair G et al., Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. Neuroimage 2010; 53(2):576-83.
22 Unrath A, Ludolph AC, Kassubek J, Brain metabolites in definite amyotrophic lateral sclerosis. A longitudinal proton magnetic resonance spectroscopy study. J Neurol 2007 Aug; 254(8):1099-106.
23 Lulé D, Ludolph AC, Kassubek J, MRI-based functional neuroimaging in ALS: an update. Amyotroph Lateral Scler 2009; 10(5-6):258-68.
24 Lulé D et al., Neuroimaging of multimodal sensory stimulation in amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry 2010; 81(8):899-906.
25 Mohammadi B et al., Changes of resting state brain networks in amyotrophic lateral sclerosis. Exp Neurol 2009; 217(1):147-53
26 Verstraete E et al., Motor network degeneration in amyotrophic lateral sclerosis: a structural and functional connectivity study. PLoS One 2010; 5(10):e13664.