Neuroimaging bei multipler Sklerose
Die Diagnose der MS mittels MRT fußt einerseits auf den so genannten „Barkhof-Kriterien“ 2, andererseits auf der Definition des Nachweises für zeitliche und örtliche Dissemination nach den revidierten McDonald-Kriterien3, 4. Hierfür werden die Techniken der konventionellen Bildgebung verwendet – T1- Gewichtung mit und ohne Kontrastmittel, T2, oder Flair (Tirm). Über Durchführung und Technik wurde in diesem Medium schon öfter berichtet, und es wird auf diese Übersichten verwiesen (www.oegn.at/mitglieder/index.php?page=neuroimaging).
Darüber hinaus bietet jedoch die MRT Methoden, welche Informationen über Faserverlauf (Traktographie), Makromolekül-Beschaffenheit (Magnetisierungstransfer – MTR) oder Metaboliten-Veränderungen (Magnetresonanzspektroskopie – MRS) bereitstellt. Dabei scheinen die Möglichkeiten der Technik nahezu unerschöpflich. In immer kürzer werdenden Abständen liefern die Entwickler Neuerungen, mit denen zusätzliche Einblicke nichtinvasiv erhoben werden können. Gegenwärtig ist die Bestimmung zerebraler Eiseneinlagerung solch ein Beispiel und wird ein zentraler Bestandteil dieser Bestandsaufnahme sein.
Magnetresonanz-Spektroskopie
Eine der wohl faszinierendsten Techniken in diesem Zusammenhang ist die Magnetresonanzspektroskopie (MRS). Diese Methode kann prinzipiell mit jedem Atom, welches ein magnetisches Moment besitzt, durchgeführt werden. Auf Grund der hohen Dichte an Wasserstoffatomen im Gehirn und technisch leichterer Machbarkeit wird derzeit hauptsächlich dieses für die MRS-Experimente herangezogen – deshalb 1H-MRS.
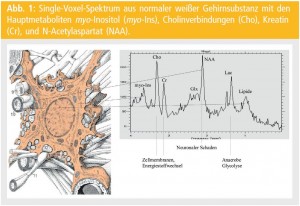
Die Technik fußt auf dem Prinzip, dass wegen unterschiedlicher Bindungskräfte die H-Atome in unterschiedlichen Molekülen unterschiedlich verankert sind. Daher schwingen in einem magnetischen Feld unterschiedliche Atome (Moleküle) mit unterschiedlichen Frequenzen. Diese Unterschiede werden gemessen, mittels Fourier-Transformation vom Frequenzbereich in einen Mengenbereich (parts per million – ppm) umgerechnet und auf einer Skala aufgetragen. Das Ergebnis der MRS ist also kein Bild, sondern eine Kurve, in der sich die gemessenen Metaboliten als Spitzenausschläge – „Peaks“ – abgebildet finden (Abb. 1).
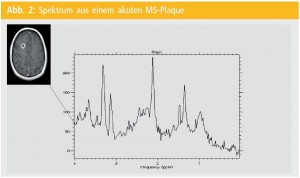
Mittels dieser Methode ist es sowohl möglich, Einzelvolumina zu untersuchen (Single-Voxel-Spektroskopie) als auch ein Großvolumen, welches dann rechnerisch in Einzelvolumina unterteilt werden kann (Multi-Voxel-Methode = Chemical Shift Imaging – CSI). Eine Mindestvolumengröße von 1 cm3 sollte nicht unterschritten werden, da sonst zu wenig Gewebeinhalt für die Messung zur Verfügung steht.Abbildung 1 zeigt ein Single-Voxel-Spektrum aus normaler weißer Gehirnsubstanz mit den Hauptmetaboliten myo-Inositol (myo-Ins), Cholinverbindungen (Cho), Creatin (Cr), und N-Acetylaspartat (NAA). In Messungen aus pathologischem Gewebe können zusätzliche Metaboliten gefunden werden wie Laktat- (Lac) oder Lipid-Formationen (Lip) (Abb. 2). Herkunft und Funktion der einzelnen Metaboliten sind nur teilweise bekannt. Dies ist eine der stärksten Limitationen dieser Methode für ihren klinischen Wert.
myo-Inositol: Dieser Metabolit setzt sich aus 3 Hauptbestandteilen zusammen: 70 % myo-Inositol, 15 % myo-Inositol-Monophosphat, 15 % Glycin. Glycin ist ein inhibitorischer Neurotransmitter, der besonders im Hirnstamm und im Rückenmark vorkommt. Sein Beitrag zum Ins-Peak wird also bei Untersuchung supratentorieller Hirnanteile gering sein. Ins findet sich vor allem innerhalb der Zellen und ist damit in zellreichen Geweben in seiner Konzentration schon physiologisch erhöht. Pathologisch erhöht findet es sich z. B. bei gliotischem Umbau. Auch ist beschrieben, dass Ins in die zelluläre Osmoregulation involviert ist. Damit können sich auch Verschiebungen bei deren Störungen ergeben.
Cholin: Es umfasst alle Cholinverbindungen, die im Gehirn vorkommen (z. B. Acetylcholin, CDP-Cholin, Glycerophosphocholin …). Am bedeutendsten ist jedoch das Phosphatidylcholin. Dies ist als Zellmembranbestandteil bei allen Prozessen mit einem hohen Membran-Turnover involviert und erhöht sich z. B. eklatant bei Neoplasien.
Creatin: Der Hauptbestandteil dieses Metaboliten stammt von Kreatinphosphat. Es ist dies ein Buffer im Energiehaushalt zur Bereitstellung von ATP aus ADP.
N-Acetylaspartat: Der für die MS-Diagnostik wohl interessanteste Metabolit im Spektrum ist das N-Acetylaspartat (NAA). Dieses kommt nahezu exklusiv in Neuronen vor und gilt daher als Maß für neuronale Integrität. Als pathologische Peak-Formationen können in einem MS-Plaque noch Laktat und Lipide gefunden werden. Während Ersteres eigentlich nur in akuten Plaques gefunden werden können, kommen Lipide gelegentlich auch in chronischen MS-Läsionen vor. Die Charakteristika des akuten MS-Plaque sind also erniedrigtes NAA als Zeichen neuronaler Dysfunktion oder neuronalen Schadens; Laktat als Zeichen der anaeroben Glykolyse, möglicherweise Ausdruck von lokalen Vaskulitiden im Rahmen der Entzündung; sowie Lipide als Zeichen der Zellmembranzerstörung.
Chronische Plaques: Während die Befunde aus akuten Plaques nicht überraschen und gut erklärbar sind, sind jene aus chronischen Plaques oder so genannter normal erscheinender weißer Substanz (NAWM) wesentlich interessanter. Sie liefern nämlich erstaunlich ähnliche Ergebnisse. Dies ist vor allem in Hinblick auf die NAWM spannend, da diese ja makroskopisch im konventionellen MRT keine Auffälligkeiten zeigt. Als Hauptbefunde zeigen beide Gewebe erniedrigtes NAA und erhöhtes myo-Ins.
Dieser Befund war so überraschend, dass er sogar eine Diskussion in Gang brachte, ob MS auch mit nur geringer Oligodendrozyten-Pathologie möglich ist, quasi als primär neuronale Erkrankung, da diese Befunde auch schon früh im Krankheitsprozess zu finden sind5. Auch lieferte sie Hinweise darauf, dass die Reduktion des NAA mit einer Erhöhung des myo-Ins einhergeht5, 6. Ein Erklärungsversuch wäre, dass der Verlust an axonalen Strukturen durch Bildung von Gliose kompensiert würde, was auch histopathologisch beschrieben ist7.
Wechselnde Ergebnisse lieferte bislang der Versuch, NAA über den zeitlichen Verlauf zu erfassen. Diesbezügliche Studien wurden sowohl als Verlaufskontrolle als auch bezüglich des Therapieerfolgs durchgeführt. Exemplarisch sei hier für beides je eine Referenz angeführt8, 9.
Korrelationsversuche zur Klinik der Betroffenen stehen teils noch aus bzw. konnten nicht geführt werden. Als Zusammenschau kann jedoch die MRS viele interessante Zusatzbefunde liefern, welche ein Gefühl für den Krankheitsprozess bieten könnten.
Quantifizierung von Eisen Ablagerung in grauer Hirnsubstanz bei MS
MS ist eine chronisch inflammatorische Erkrankung, die durch fokal demyelinisierende Läsionen des ZNS gekennzeichnet ist. Kürzlich durchgeführte neuropathologische Studien konnten jedoch zeigen, dass das Spektrum der Gewebsschädigung viel breiter ist. Neben den oben genannten fokal demyelinisierenden Herden finden sich auch pathologische Veränderungen des Kortex sowie eine diffuse Schädigung der außerhalb der MS-Läsionen gelegenen so genannten „normal erscheinenden Hirnsubstanz“ (NABT)10.
Während frühe Krankheitsphasen durch inflammatorische Vorgänge und klinische Schübe gekennzeichnet sind, dominieren bei fortschreitender MS diffuse neuroaxonale Destruktion und die Zunahme des Behinderungsgrades11. Inflammatorische Aktivität lässt sich MR-tomographisch mittels kontrastmittelaufnehmender Läsionen auf T1-gewichteten Bildern und dem Auftreten von neuen Läsionen auf T2-gewichteten Bildern darstellen. Da durch Bestimmung dieser MR-Parameter auf die Effektivität von therapeutischen Interventionen rückgeschlossen werden kann, werden diese Parameter vor allem in Phase-II-Studien eingesetzt12. Nachteilig ist jedoch die relativ geringe Korrelation von T1-KM-aufnehmenden und neu auftretenden T2-Läsionen mit neurodegenerativen Vorgängen, die sich klinisch durch Krankheitsprogression und Zunahme der körperlichen Behinderung äußern, wodurch deren Anwendung bei Phase-III-Studien limitiert ist13.
In den letzten 20 Jahren wurde ein Forschungsfokus auf die Entwicklung und Optimierung von MR-Parametern zur besseren bildgebenden Erfassung von neurodegenerativen Vorgängen gelegt14. MR-tomographisch wird derzeit das Ausmaß von Neurodegeneration bei MS hauptsächlich mittels Analyse globaler und/oder regionaler Hirnvolumina und über die Reduktion von N-Acetylaspartat mittels MRS bestimmt11. Bisher konnten diese MR-Parameter jedoch nicht als Surrogatendpunkte für neuroaxonale Destruktion und klinische Progression validiert werden14.
Eisenablagerungen im Gehirn
Forschungsinitiativen der letzten Jahre wiesen darauf hin, dass eine MR-basierte Bestimmung von Eisenablagerungen im Gehirn von MS-PatientInnen als Korrelat für Neurodegeneration dienen könnte14. Eisen ist essenzieller Bestandteil vieler neurophysiologischer Stoffwechselvorgänge, wie Produktion von Neurotransmitter, Myelinisierung und Energiebereitstellung15. Ein Überangebot an freiem Eisen kann jedoch die Bildung von toxischen Hydroxylradikalen begünstigen und so zur Gewebeschädigung beitragen16. Vermehrte Eisenablagerung wurde bei verschiedenen chronisch neurologischen Erkrankungen, inklusive MS, beobachtet17. Allerdings konnte bislang nicht genau geklärt werden, ob vermehrte Eisenablagerung im Gehirn kausal mit der Entstehung von MS-typischer Pathologie in Zusammenhang steht oder als Epiphänomen pathophysiologischer Vorgänge zu verstehen ist, wobei Ergebnisse aus rezenten Studien letztere Variante wahrscheinlicher erscheinen lassen18.
Vor Kurzem wurde eine Hypothese postuliert, nach der Gehirneisenablagerung, bedingt durch venösen Rückstau (chronic cerebrospinal venous insufficincy – CCSVI) und konsekutive Extravasation ins Hirnparenchym bei MS ätiologisch bedeutsam ist19. Diese Hypothese wird allerdings in Fachkreisen derzeit heftig diskutiert, wobei bereits einige rezente Studien dieser Vermutung widersprechen20.
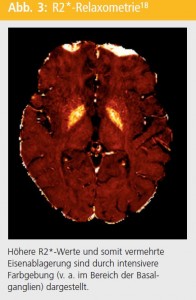 In-vivo-Eisenquantifizierung: Mittlerweile gibt es eine Vielzahl von MR-Techniken, die darauf abzielen, Eisen in vivo zu bestimmen. Die durch Eisen verursachte Verkürzung von T2- und T2*-Relaxationszeiten führen zu einer Signalabschwächung von eisenhaltigen Gehirnarealen auf T2-gewichteten Bildern21. Erste Studien hierzu basierten auf visueller Beurteilung von Signalabschwächungen auf T2-gewichteten Bildern, die entscheidende Nachteile, wie geringe Sensitivität und nur qualitative Beurteilung und Subjektivität, mit sich bringt21. Um diese Nachteile zu umgehen, wurde R2*-Relaxometrie als Methode zur In-vivo-Eisenquantifizierung vorgeschlagen21 (Abb. 3). Diese Methode wurde kürzlich in einer Postmortem-Studie validiert22 und kann an kommerziell erhältlichen MR-Tomographen in einer klinisch akzeptablen Zeit durchgeführt werden, wodurch ein zukünftiger Einsatz in klinischen Studien potenziell möglich wäre. Andere MR-Techniken zu In-vivo-Eisenquantifizierung, wie z. B. magnetic field correlation (MFC) oder Bestimmung von local field shifts (LFS), eignen sich auch sehr gut, allerdings wurden diese Methoden zum Teil noch nicht validiert und erfordern ausgedehnte Bildnachbearbeitung, wodurch deren klinische Anwendbarkeit eingeschränkt ist21.
In-vivo-Eisenquantifizierung: Mittlerweile gibt es eine Vielzahl von MR-Techniken, die darauf abzielen, Eisen in vivo zu bestimmen. Die durch Eisen verursachte Verkürzung von T2- und T2*-Relaxationszeiten führen zu einer Signalabschwächung von eisenhaltigen Gehirnarealen auf T2-gewichteten Bildern21. Erste Studien hierzu basierten auf visueller Beurteilung von Signalabschwächungen auf T2-gewichteten Bildern, die entscheidende Nachteile, wie geringe Sensitivität und nur qualitative Beurteilung und Subjektivität, mit sich bringt21. Um diese Nachteile zu umgehen, wurde R2*-Relaxometrie als Methode zur In-vivo-Eisenquantifizierung vorgeschlagen21 (Abb. 3). Diese Methode wurde kürzlich in einer Postmortem-Studie validiert22 und kann an kommerziell erhältlichen MR-Tomographen in einer klinisch akzeptablen Zeit durchgeführt werden, wodurch ein zukünftiger Einsatz in klinischen Studien potenziell möglich wäre. Andere MR-Techniken zu In-vivo-Eisenquantifizierung, wie z. B. magnetic field correlation (MFC) oder Bestimmung von local field shifts (LFS), eignen sich auch sehr gut, allerdings wurden diese Methoden zum Teil noch nicht validiert und erfordern ausgedehnte Bildnachbearbeitung, wodurch deren klinische Anwendbarkeit eingeschränkt ist21.
R2*-Relaxometrie-Studie: In einer an der Medizinischen Universität Graz durchgeführten Studie wurde das Ausmaß von Gehirneisenablagerung bei MS mittels R2*-Relaxometrie untersucht23.
Ziel der Studie war es, quantitativ regionale Eisendeposition bei PatientInnen mit einem klinisch isolierten Syndrom (CIS) im Vergleich zu schubhaft-remittierender MS (RRMS) zu bestimmen und deren Assoziation mit demographischen, klinischen und konventionellen MRT-Parametern (T2-Läsionslast und normalisierte globale und regionale Gehirnvolumina) zu analysieren. Insgesamt wurden 69 PatientInnen (CIS, n = 32; RRMS, n = 37) in die Studie eingeschlossen.
Höhere R2*-Relaxationsraten und somit vermehrtes Eisen im Bereich der Basalganglien (BG) waren mit zunehmendem Alter korreliert (r = 0,3–0,6; p < 0,01). Weiters zeigten sich signifikant höhere Eisenablagerung im Bereich der BG bei RRMS im Vergleich zu CIS (p < 0,05), wobei der Unterschied im Bereich des Putamens am größten war (p < 0,001). Mittels multivariater linearer Regressionsanalyse wurden Haupteinflussgrößen auf Eisenablagerung im Putamen eruiert, wobei stärkste unabhängige Einflussfaktoren neben dem PatientInnenalter die Krankheitsdauer und Atrophie der grauen Substanz waren. Mit dieser Studie konnte gezeigt werden, dass die R2*-Methode sehr gut geeignet ist, Eisenablagerungen im Gehirn zu quantifizieren, womit die Basis für weitere Studien gelegt wurde, um die Rolle der gesteigerten Eisenablagerung im Gehirn von MS-PatientInnen zu erforschen.
In einer Folgestudie wurde der Frage nachgegangen, welche klinischen und bildgebenden Determinanten gesteigerte Eisenablagerungen, vor allem im Bereich der Basalganglien, beeinflussen16a. Hierzu wurden insgesamt 113 PatientInnen (35 CIS, 78 MS) und 35 gesunde Kontrollen in die Studie eingeschlossen. Neben ausführlicher klinischer Untersuchung, inklusive umfassender neuropsychologischer Testung, wurde subkortikale Eisenablagerung mittels R2*-Relaxometrie mit einem 3 Tesla-MR-Tomographen bestimmt. Weiters wurden globale und regionale Gehirnvolumina und T2-Läsionslast analysiert. Signifikant gesteigerte Eisenablagerung im Bereich der Basalganglien zeigte sich bei MS im Vergleich zu CIS (p < 0,001) und gesunde Kontrollen (HC) (p < 0,005). Annährend gleiche R2*-Werte konnten bei CIS und HC gefunden werden. R2*-Werte korrelierten mit den klinischen Variablen Alter (r = 0,5, p < 0,001), Krankheitsdauer (r = 0,5, p < 0,001), Behinderungsgrad (EDSS) (r = 0,3, p < 0,005), und den z-Werten der Informationsverarbeitungsgeschwindigkeit (r = –0,3, p < 0,01). In einer schrittweise durchgeführten linearen Regressionsanalyse konnte die Atrophie der grauen Gehirnsubstanz (p < 0,001) als Haupteinflussgröße, gefolgt von Alter (p < 0,001) und T2-Läsionslast (p < 0,005), für gesteigerte Eisenablagerung im Bereich der Basalganglien identifiziert werden. Das statistische Modell exkludierte die Variablen Krankheitsdauer, EDSS und z-Werte der Informationsverarbeitungsgeschwindigkeit.
Aus den Ergebnissen dieser Studie konnte geschlossen werden, dass Eisen im Bereich der Basalganglien bei MS erst mit fortschreitender Erkrankung akkumuliert und mehr mit dem Ausmaß morphologischer Gehirnschädigung als mit klinischen Variablen assoziiert ist.
Dass bei CIS-PatientInnen im Vergleich zu gesunden Kontrollpersonen keine erhöhte Eisenablagerung gefunden werden konnte, lässt darauf schließen, dass eine gesteigerte Eisenablagerung im Gehirn der Krankheitsentwicklung offensichtlich nicht vorausgeht. Dies ist insofern bedeutsam, als diese Ergebnisse gegen eine kürzlich generierte Hypothese sprechen, die besagt, dass Eisenablagerung bedingt durch vermehrten venösen Rückstau (CCSVI) bei MS ätiologisch bedeutsam wäre.
Vielmehr weisen die aktuellen Ergebnisse darauf hin, dass gesteigerte Gehirneisenablagerung eher als Epiphänomen pathophysiologischer Prozesse bei MS zu verstehen ist. Die Assoziation von gesteigerter Eisenakkumulation in den Basalganglien vor allem mit Atrophie der grauen Gehirnsubstanz eröffnet die Möglichkeit, R2*-Relaxometrie als Surrogatmarker für Neurodegeneration und Krankheitsprogression zu etablieren. Ausgehend von den aktuellen Ergebnissen sind allerdings weitere Schritte für eine erfolgreiche Validierung dieses potenziellen Markers erforderlich14.
Zum einen sollten die vorliegenden Ergebnisse in einer anderen MS-Kohorte reproduziert werden können. Da mittels der R2*-Methode derzeit Eisenablagerung vor allem in der subkortikalen grauen Gehirnsubstanz quantifiziert werden kann, wäre die Etablierung dieser Methode zur sensitiven Bestimmung von Eisen in der weißen Gehirnsubstanz sowie innerhalb der MS-Läsionen erforderlich. Schließlich sollte die R2*-Methode im Rahmen von Multicenterstudien validiert und ihre klinische Anwendbarkeit als Prädiktor für Neurodegeneration und Krankheitsprogression in longitudinalen Studien überprüft werden.
Kognitive Beeinträchtigung in Relation zu MRI-Parametern bei MS
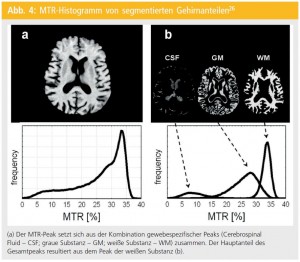
Kognitive Beeinträchtigung kommt bei MS relativ häufig mit einer Prävalenz von 40 bis 70 % vor24. Unabhängig vom physischen Behinderungsgrad beeinflussen kognitive Beeinträchtigungen maßgeblich die Lebensqualität von MS-PatientInnen sowie Arbeitsfähigkeit und soziales Leben25. Bisher gibt es allerdings nur wenig Information darüber, wie häufig und in welchem Ausmaß kognitive Defizite ganz zu Beginn der Erkrankung, nämlich bei CIS, auftreten24. Weiters konnte bis jetzt nicht eindeutig geklärt werden, ob strukturelle Hirnparenchymveränderungen, die mittels Magnetisierungstransfer-Imaging (MTI) detektiert werden, als morphologisches Korrelat für kognitive Beeinträchtigung bei CIS in Betracht gezogen werden können. MTI beruht auf der Quantifizierung eines Energietransfers (Magnetisierungstransfer) von gebundenen zu ungebundenen Protonen und ermöglicht somit, nichtwasserhaltige Gewebsanteile zu explorieren, die auf konventionellen MR-Bildern nicht dargestellt werden können26 (Abb. 4). Mit dieser Methode ist nun eine Quantifizierung von mikrostrukturellen Hirngewebeveränderungen möglich26.
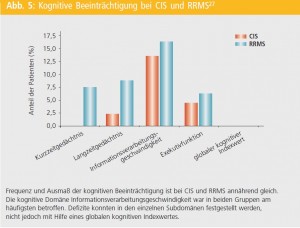
Kognitive Beeinträchtigung bei CIS vs. RRMS: In einer kürzlich durchgeführten Studie wurde der Frage nachgegangen, mit welcher Frequenz und in welchem Ausmaß kognitive Beeinträchtigung bei CIS im Vergleich zu RRMS vorkommt und inwieweit morphologische Veränderung des Gehirns, inklusive MTI, mit kognitiven Defiziten korrelieren27. Es wurden 44 CIS- und 80 RRMS-PatientInnen mit Hilfe der Brief Repeatable Battery of Neuropsychological Tests (BRB-N) kognitiv getestet und im 3-Tesla-MRT bildgebend untersucht. In den BRB-N-Subtests zeigten sich in Bezug auf kognitive Beeinträchtigung keine signifikanten Unterschiede zwischen CIS und RRMS (Abb. 5). Defizite konnten in den einzelnen Subdomänen festgestellt werden, nicht jedoch mit Hilfe eines globalen kognitiven Indexwertes. Die kognitive Domäne Informationsverarbeitungsgeschwindigkeit war in beiden Gruppen am häufigsten betroffen (CIS 13,6 %; RRMS 16,3 %) (Abb. 5) und wurde daher für weitere Korrelationsanalysen mit MRI-Parametern herangezogen. In einer schrittweise durchgeführten linearen Regressionsanalyse konnte gezeigt werden, dass bei RRMS normalisiertes Kortexvolumen (p < 0,001) gefolgt von T2-Läsionslast (p < 0,05) stärkste Prädiktoren für verminderte Informationsverarbeitungsgeschwindigkeit waren, während bei CIS die kortikale MT-Ratio die einzige mit verminderte Informationsverarbeitungsgeschwindigkeit assoziierte Variable war (p < 0,005). Aus den Ergebnissen dieser Studie konnte geschlossen werden, dass kognitive Defizite bereits bei CIS auftreten, wobei deren Frequenz und Ausprägung sich nicht signifikant von RRMS unterschieden. Veränderungen der kortikalen MT-Ratio könnten frühe Anzeichen für mikrostrukturelle Veränderungen sein, die mit kognitiven Defiziten bei CIS assoziiert sind, während sich bei RRMS diese Assoziation zugunsten von kortikaler Atrophie und T2-Läsionslast verschiebt.
1 Fazekas F, Offenbacher H et al., Criteria for an increased specificity of MRI interpretation in elderly subjects with suspected multiple sclerosis. Neurology 1988; 38:1822–1825
2 Barkhof et al., Comparison of MRI Criteria at first presentation to predict conversion to clinically definite MS. Brain 1997; 120:2059–2069
3 Polman CH, Reingold SC, Edan G et al., Diagnostic Criteria for MS: 2005 Revisions to the “McDonald Criteria”. AnnNeurol 2005;58:840–846
4 Montalban X, Tintore M, Swanton J et al., MRI Criteria for MS in Patients with Clinically Isolated Syndromes. Neurology 2010; 74:427–434
5 Kapeller P, McLean M, Miller DH et al., Preliminary Evidence for Neuronal Damage in Cortical Grey Matter and Normal Appearing White Matter in Short Duration RRMS: a Quantitative MRSI Study. J Neurol 2001; 248:131–138
6 Kapeller P, Brex PA, Chard D, Miller DH et al. Multiple Sclerosis 2002; 8:207–210
7 Allen I, McKeown S, A Histological, Histochemical and Biochemical Study of the Macroscpically NAWM in MS. J Neurol Sci 1979; 41:81–91
8 Tiberio M, Chard D, Miller DH, et al., J Neurol 2006; 253(2):224–230
9 Parry A, Corkill R, Matthews PM et al., Beta-Interferon does not always slow the progression of axonal injury in MS. J Neurol 2003; 250(2):171–8
10 Lassmann H, Bruck W, Lucchinetti CF, The immunopathology of multiple sclerosis: An overview. Brain Pathol 2007; 17:210–8.
11 Miller DH, Biomarkers and surrogate outcomes in neurodegenerative disease: Lessons from multiple sclerosis. NeuroRx 2004; 1:284–94.
12 Sormani MP, Bonzano L, Roccatagliata L, Cutter GR, Mancardi GL, Bruzzi P, Magnetic resonance imaging as a potential surrogate for relapses in multiple sclerosis: A meta-analytic approach. Ann Neurol 2009; 65:268–75.
13 Goodin DS, Magnetic resonance imaging as a surrogate outcome measure of disability in multiple sclerosis: Have we been overly harsh in our assessment? Ann Neurol 2006; 59:597–605.
14 Rovira A, Montalban X, MR brain iron mapping in MS: A potential neurodegenerative marker or just another technique? Neurology 2011.
15 Andrews NC, Disorders of iron metabolism. N Engl J Med 1999; 341:1986–95.
16 Khalil M, Teunissen C, Langkammer C, Iron and neurodegeneration
in multiple sclerosis. Multiple Sclerosis
International 2011; 2011:1.
16aKhalil M, Langkammer C, Ropele S, Petrovic K, Wallner-Blazek M, Loitfelder M, et al., Determinants of brain iron in multiple sclerosis: A quantitative 3T MRI study. Neurology 2011a; 77:1691–7.
17 Zecca L, Youdim MB, Riederer P, Connor JR, Crichton RR, Iron, brain ageing and neurodegenerative disorders. Nat Rev Neurosci 2004; 5:863–73.
18 Ropele S, Langkammer C, Enzinger C, Fuchs S, Fazekas F, Relaxation time mapping in multiple sclerosis. Expert Rev Neurother 2011; 11:441–50.
19 Singh AV, Zamboni P, Anomalous venous blood flow and iron deposition in multiple sclerosis. J Cereb Blood Flow Metab 2009; 29:1867–78.
20 Khan O, Filippi M, Freedman MS, Barkhof F, Dore-Duffy P, Lassmann H et al., Chronic cerebrospinal venous insufficiency and multiple sclerosis. Ann Neurol 2010; 67:286–90.
21 Ropele S, de Graaf W, Khalil M, Wattjes MP, Langkammer C, Rocca MA et al., MRI assessment of iron deposition in multiple sclerosis. Journal of magnetic resonance imaging: JMRI 2011; in press.
22 Langkammer C, Krebs N, Goessler W, Scheurer E, Ebner F, Yen K et al., Quantitative MR imaging of brain iron: A postmortem validation study. Radiology 2010; 257:455–62.
23 Khalil M, Enzinger C, Langkammer C, Tscherner M, Wallner-Blazek M, Jehna M et al., Quantitative assessment of brain iron by R(2)* relaxometry in patients with clinically isolated syndrome and relapsing-remitting multiple sclerosis. Mult Scler 2009; 15:1048–54.
24 Amato MP, Zipoli V, Portaccio E, Multiple sclerosis-related cognitive changes: A review of cross-sectional and longitudinal studies. J Neurol Sci 2006; 245:41–6.
25 Bobholz JA, Rao SM, Cognitive dysfunction in multiple sclerosis: A review of recent developments. Curr Opin Neurol 2003; 16:283–8.
26 Ropele S, Fazekas F, Magnetization transfer MR imaging in multiple sclerosis. Neuroimaging Clin N Am 2009; 19:27–36.
27 Khalil M, Enzinger C, Langkammer C, Petrovic K, Loitfelder M, Tscherner M, et al., Cognitive impairment in relation to MRI metrics in patients with clinically isolated syndrome. Mult Scler 2011b; 17:173–80.