Neuroimaging bei Schlaganfall
In der akuten Phase des Schlaganfalls mit Blickpunkt Thrombolyse, d. h. innerhalb der ersten 4,5 Stunden, tritt die Bedeutung der detaillierten morphologischen oder funktionellen Information heute noch eindeutig hinter den möglichst raschen Behandlungsbeginn zurück. Der für die Thrombolyse geforderte Ausschluss einer subarachnoidalen oder intrazerebralen Blutung als Ursache des Schlaganfalls oder einer anderen augenfälligen morphologischen Veränderung, welche als Kontraindikation für eine derartige Behandlung anzusehen wäre, kann auch mit der kranialen Computertomographie (CT) rasch und sicher erfolgen.
Auch der Nachweis von Hauptstammverschlüssen der größeren hirnversorgenden bzw. intrakraniellen Gefäße, die immer mehr als Indikation für eine zusätzliche interventionelle Behandlung gesehen werden, ist über eine CT-Angiographie (CTA) heute mit den meisten Geräten problemlos möglich. Aus diesen Gründen, aufgrund der nach wie vor größeren Verbreitung und Zugänglichkeit sowie nicht zuletzt infolge der insgesamt einfacheren Untersuchungsführung stellt die CT derzeit noch immer die zumindest in den ersten Stunden nach einem Schlaganfall am häufigsten eingesetzte bildgebende Methode dar.
Eine größere Informationsvielfalt vermitteln aber zweifellos die verschiedenen MRT-Untersuchungstechniken. Diese sind daher schon jetzt für eine differenzierte Diagnostik der verschiedenen Schlaganfallursachen und nicht zuletzt für den direkten Nachweis des Schlaganfalls selbst von großer Bedeutung. Daneben kommt ihnen auch in der Selektion der SchlaganfallpatientInnen für bestimmte Behandlungsformen immer größere Bedeutung zu.
Während wir also in die Lage versetzt werden, immer mehr Details im vom Schlaganfall betroffenen Gehirn abbilden zu können, so sehen wir offensichtlich noch lange nicht alles. Sowohl in der Akutphase als auch mehrere Monate nach einem Schlaganfall können entsprechende Veränderungen – eventuell noch nicht oder auch nicht mehr – erkennbar sein.
Genaues Wissen um die Möglichkeiten und Grenzen der derzeit verfügbaren Magnetresonanztechniken kann deshalb helfen, diese noch gezielter und effizienter einzusetzen und die Ergebnisse auch ausreichend kritisch zu bewerten. Die nachfolgenden Ausführungen sollen dabei eine gewisse Hilfestellung liefern.
MRT-Parenchymveränderungen beim Schlaganfall
Die Überlegenheit der MRT im Nachweis zerebraler ischämischer Läsionen gegenüber der CT steht außer Zweifel. Hyperintense Signalveränderungen des Gehirngewebes infolge eines Infarktes sind schon in der konventionellen MRT mit T2-gewichteten Sequenzen insbesondere in Hirnstamm und Kleinhirn rascher und leichter abzugrenzen als die einer Ischämie folgende Hypodensität des betroffenen Gehirngewebes in der CT. Diese „Augenfälligkeit“ wird durch den Einsatz von Pulssequenzen, welche das Signal von Liquor unterdrücken – wie etwa von FLAIR (fluid-attenuated inversion recovery) – weiter gesteigert.
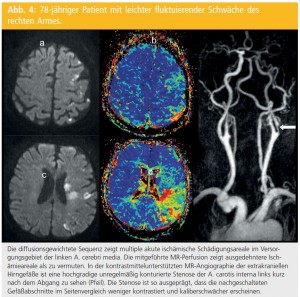
 Diffusionsgewichtete Bildgebung (DWI): Ein überragender Vorteil im Vergleich zur CT hat sich jedoch erst mit Einführung des DWI (Diffusion-weighted Imaging) ergeben, das auf der Abbildung der Mobilität der Wasserstoffprotonen im Gewebe beruht. Die Diffusivität der Wasserstoffprotonen nimmt bei akuter Ischämie sehr rasch ab, sodass Gewebeveränderungen mittels DWI bereits nach 20 Minuten als Areale hoher Signalintensität und damit früher eindeutig zu detektieren sind als dies mit konventioneller MRT oder CT möglich ist (Abb. 1).
Diffusionsgewichtete Bildgebung (DWI): Ein überragender Vorteil im Vergleich zur CT hat sich jedoch erst mit Einführung des DWI (Diffusion-weighted Imaging) ergeben, das auf der Abbildung der Mobilität der Wasserstoffprotonen im Gewebe beruht. Die Diffusivität der Wasserstoffprotonen nimmt bei akuter Ischämie sehr rasch ab, sodass Gewebeveränderungen mittels DWI bereits nach 20 Minuten als Areale hoher Signalintensität und damit früher eindeutig zu detektieren sind als dies mit konventioneller MRT oder CT möglich ist (Abb. 1).
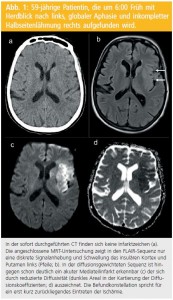
Eine Hyperintensität in der DWI ist nur in Ausnahmefällen reversibel und mündet somit meist in einen Infarkt. Zudem ist die Reduktion der Diffusivität, die anhand der Kartierung der Diffusionskoeffizienten überprüft werden kann, fast exklusiv bei akuten ischämischen Veränderungen zu finden und damit ein recht spezifischer Befund, der insbesondere auch hilft, akute von alten Infarkten abzugrenzen (Abb. 2). Dies hat die DWI zu einer Routinesequenz in der Abklärung des akuten Schlaganfalls gemacht.
 In gewissen Gehirnarealen wie etwa dem Hirnstamm kann es allerdings teilweise deutlich länger (bis zu mehrere Stunden) dauern, bis selbst bei Einsatz der konventionellen DWI Signalveränderungen auftreten. Als mögliche Ursache werden Unterschiede in der Gewebestruktur diskutiert. Investiert man in solchen Fällen Untersuchungszeit in Sequenzen mit wiederholten Diffusionsmessungen und reduziert die Aufnahmeschichtdicke auf 2 bis 3 mm, so entgehen einem Hirnstamminfarkte seltener. Man muss also wissen, dass in diesen Regionen eine negative MRT einen akuten Schlaganfall nicht ausschließt, falls die Untersuchung sehr rasch nach dem Akutereignis durchgeführt worden ist.
In gewissen Gehirnarealen wie etwa dem Hirnstamm kann es allerdings teilweise deutlich länger (bis zu mehrere Stunden) dauern, bis selbst bei Einsatz der konventionellen DWI Signalveränderungen auftreten. Als mögliche Ursache werden Unterschiede in der Gewebestruktur diskutiert. Investiert man in solchen Fällen Untersuchungszeit in Sequenzen mit wiederholten Diffusionsmessungen und reduziert die Aufnahmeschichtdicke auf 2 bis 3 mm, so entgehen einem Hirnstamminfarkte seltener. Man muss also wissen, dass in diesen Regionen eine negative MRT einen akuten Schlaganfall nicht ausschließt, falls die Untersuchung sehr rasch nach dem Akutereignis durchgeführt worden ist.
DWI-Veränderungen sind zu 30–70 % auch bei PatientInnen mit einer transienten ischämischen Attacke zu finden. Die Häufigkeit des Nachweises derartiger Signalveränderungen ist hier ebenfalls stark vom Zeitpunkt der MRT-Untersuchung abhängig. Da derartige Signalveränderungen wie die neurologische Symptomatik selbst ebenfalls flüchtig sein können, werden sie seltener beobachtet, wenn die MRT erst mehrere Tage nach dem klinischen Ereignis durchgeführt wird. Andererseits steigt die Wahrscheinlichkeit, eine diffusionspositive Läsion zu finden, mit der Dauer der klinischen Symptome.
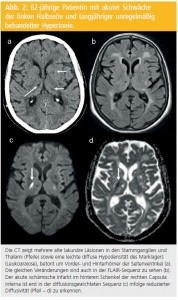
 Sensitivität und Spezifität: Für lange Zeit bestand die Vermutung und Sorge, dass die MRT im Nachweis intrazerebraler Blutungen weniger sensitiv und spezifisch sei als die CT. Diese Sorge konnte mittlerweile durch die Verfügbarkeit von DWI sowie den Einsatz blutsensitiver Sequenzen wie des Gradient Recalled Echo (GRE) oder des Susceptibilityweighted Imaging (SWI) ausgeräumt werden. Akutes Blut ist auf DWI-Bildern von mittlerer Signalintensität oder erscheint dunkel und unterscheidet sich daher deutlich von den hell aufleuchtenden ischämischen Arealen. Die GRE-Sequenz lässt akutes Blut ebenfalls als dunkel erscheinen. Hinzu kommt, dass in der FLAIR eine perakute Blutung als runde oder ovale Hyperintensität leicht abgrenzbar ist, während ein Territorialinfarkt allenfalls leicht hyperintens ist und sich in seiner Ausdehnung an der arteriellen Gefäßanatomie orientiert, also typischerweise Kortex mit angrenzendem Marklager betrifft. In zwei unabhängigen multizentrischen prospektiven Studien an über 300 PatientInnen konnte bei parallelem Einsatz von CT und MRT gezeigt werden, dass die MRT schon in der Akutphase im Nachweis akuter Blutungen der CT mindestens ebenbürtig ist (Abb. 3).
Sensitivität und Spezifität: Für lange Zeit bestand die Vermutung und Sorge, dass die MRT im Nachweis intrazerebraler Blutungen weniger sensitiv und spezifisch sei als die CT. Diese Sorge konnte mittlerweile durch die Verfügbarkeit von DWI sowie den Einsatz blutsensitiver Sequenzen wie des Gradient Recalled Echo (GRE) oder des Susceptibilityweighted Imaging (SWI) ausgeräumt werden. Akutes Blut ist auf DWI-Bildern von mittlerer Signalintensität oder erscheint dunkel und unterscheidet sich daher deutlich von den hell aufleuchtenden ischämischen Arealen. Die GRE-Sequenz lässt akutes Blut ebenfalls als dunkel erscheinen. Hinzu kommt, dass in der FLAIR eine perakute Blutung als runde oder ovale Hyperintensität leicht abgrenzbar ist, während ein Territorialinfarkt allenfalls leicht hyperintens ist und sich in seiner Ausdehnung an der arteriellen Gefäßanatomie orientiert, also typischerweise Kortex mit angrenzendem Marklager betrifft. In zwei unabhängigen multizentrischen prospektiven Studien an über 300 PatientInnen konnte bei parallelem Einsatz von CT und MRT gezeigt werden, dass die MRT schon in der Akutphase im Nachweis akuter Blutungen der CT mindestens ebenbürtig ist (Abb. 3).
Auch subarachnoidales Blut ist auf FLAIR-Sequenzen in der Regel gut zu erkennen. Aufgrund der Liquorpulsation und damit eventuell inkompletter Signalunterdrückung finden sich bei dieser Sequenz oft aber auch falsch positive Signalanhebungen in den basalen Liquorräumen, so dass für die Akutdiagnostik einer Subarachnoidalblutung (SAB) die CT nach wie vor die Methode der Wahl darstellt.
Rückschluss auf den Zeitpunkt des Schlaganfalls: Aufgrund der rascheren Entwicklung einer Diffusionsstörung, d. h. dem Nachweis von ischämischen Läsionen mittels DWI, gegenüber der etwas später einsetzenden Signalhyperintensität bei T2- und FLAIR-gewichteten Aufnahmen wurden auch Überlegungen angestellt, aus dem MRT-Befund auf die Dauer der ischämischen Schädigung – zumindest in den ersten Stunden – rückzuschließen.
Dies wäre insbesondere für PatientInnen be deutsam, bei denen der Zeitpunkt des Eintritts eines Schlaganfalls nicht exakt bekannt ist, wie etwa beim Aufwachen mit Schlaganfallsymptomen, und daher eine Thrombolysebehandlung eventuell nicht durchgeführt wird. Die bislang dazu vorliegenden Untersuchungen bestätigen überwiegend die Annahme, dass Infarkte erst wenige Stunden alt sind, wenn sie in der konventionellen Bildgebung (T2-Gewichtung und/oder FLAIR) noch nicht zeichnen, aber in der DWI bereits erkannt werden können. Im Einzelfall kann aber vermutlich aufgrund verschiedener Einflussfaktoren wie der Untersuchungssequenz, der Schlaganfallätiologie oder des Kollateralkreislaufs offensichtlich durchaus eine gewisse Varianz bestehen, so dass noch weitere Daten abzuwarten sind, bevor diesbezüglich klare Therapieempfehlungen abgegeben werden können. Eine multizentrische europäische Studie wird daher die PatientInnen, deren Infarkt noch nicht auf der FLAIR erkennbar ist, mit Thrombolyse behandeln, um zumindest für diese Gruppe eine neue Therapiemöglichkeit zu entwickeln.
Vorausgegangene Schädigungen: Neben dem Nachweis der akuten Veränderungen erweist sich die MRT auch gegenüber bereits vorausgegangener und eventuell unbemerkter Schädigung des Gehirns durch vaskuläre Prozesse als sehr sensitiv und spezifisch. So finden sich in populationsbasierten Studien selbst bei Personen ohne vorausgegangene neurologische Erkrankung alte Infarkte bei 5–10 % der Untersuchten.
Mögliche Ursachen dafür sind unter anderem die Lokalisation in nicht eloquenten Hirnarealen sowie die Auslösung nur unspezifischer Symptome wie etwa eines kurzen Schwindels, einer Sehstörung oder von Benommenheit, die nicht mit einem Schlaganfall assoziiert werden. Verlaufsuntersuchungen haben außerdem gezeigt, dass selbst die MRT das Ausmaß vorangegangener vaskulärer Schäden des Gehirns in manchen Fällen unterschätzen dürfte. So wurde insbesondere beobachtet, dass lakunäre Infarkte (subkortikale Infarkte _ 15 mm) nach mehreren Monaten bis Jahren oft nicht mehr nachweisbar sind.
Einblutungen in das Hirngewebe hinterlassen dafür lebenslange Marker, wenn bei der Untersuchung blutungssensitive Sequenzen (GRE oder SWI) zum Einsatz kommen. Es verbleiben im Gewebe nämlich Hämosiderinreste, die aufgrund ihres paramagnetischen Effektes und der dadurch bedingten Magnetfeldinhomogenität bei diesen Sequenzen zu weiträumiger Signalauslöschung führen, d. h. die Veränderungen erscheinen wesentlich ausgedehnter als sie tatsächlich sind (Abb. 3).
Dies wird auch als „Blooming-Effekt“ bezeichnet und bedingt, dass bereits minimale Blutaustritte, oft auch als Mikroblutungen bezeichnet, im Rahmen von Kleingefäßerkrankungen sowie Hämosiderineinlagerungen in den Meningen nach subarachnoidaler Einblutung nachweisbar geworden sind. Damit kann die MRT heute Hinweise auf Krankheitsentitäten wie eine zerebrale Amyloidangiopathie, eine hypertensive zerebrale Mikroangiopathie oder auch eine stattgehabte konvexale SAB liefern, was ebenfalls zur weiteren Typisierung der Schlaganfallätiologien und zum besseren Erkennen der Vielfältigkeit der Schlaganfallursachen beigetragen hat.
MR der zerebralen Gefäße
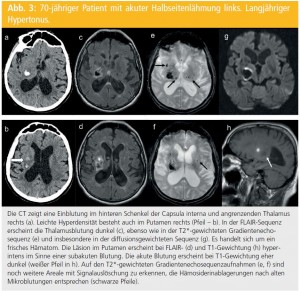
Im Anschluss an die morphologische Bildgebung ist mittels Magnetresonanzangiographie (MRA) auch eine rasche Darstellung der intrakraniellen hirnversorgenden Gefäße zum Nachweis des Verschlusses größerer Gefäßstämme oder -äste rasch und ohne Kontrastmittel (KM) möglich. Derartige Sequenzen lassen auch größere Aneurysmen erkennen, die allerdings dann zumeist in der nativen Bildgebung bereits sichtbar sind. Für eine genauere Gefäßdarstellung, insbesondere der extrakraniellen hirnversorgenden Gefäße, ist allerdings eine KM-unterstützte MRA notwendig (Abb. 4). Bei speziellen Fragestellungen wie etwa dem Verdacht auf eine Gefäßdissektion können ergänzende Schnittbilder zusätzliche hilfreiche Informationen wie den direkten Nachweis des Gefäßwandhämatoms liefern.
Da PatientInnen mit Verdacht auf eine SAB, wie vorab ausgeführt, primär der CT zugeführt werden, wird auch die anschließende Frage nach dem Vorliegen eines Aneurysmas meist mittels KM-unterstützter CTA beantwortet. Die Qualität der CTA ist bei den modernen Geräten heute bereits so hoch, dass in Bezug auf die Sensitivität im Aneurysmanachweis kaum ein Unterschied zur konventionellen Angiographie besteht. Für den Nachweis von Kaliberschwankungen oder Verschlüssen kleinster Gefäße wie etwa bei Verdacht auf das Vorliegen einer zerebralen Vaskulitis stellt die konventionelle Angiographie allerdings nach wie vor den Goldstandard dar.
MR-Perfusion
Neben Abbildung des Gehirnparenchyms und der hirnversorgenden Gefäße ist die MRTechnologie auch in der Lage, Informationen über fokale Veränderungen der Hirnperfusion zu liefern. Dabei werden die durch den Einstrom von intravenös verabreichtem Kontrastmittel in das Gehirn bedingten Signaländerungen genutzt, um verschiedene durchblutungsassoziierte Parameter zu errechnen und kartiert darzustellen (Abb. 4 und 5). Eine genauere Berechnung der absoluten Hirndurchblutungswerte ist allerdings aufwändiger und auch dann nur unter gewissen Einschränkungen möglich. Aus diesem Grund werden für die Akutabschätzung von Perfusionsdefekten meist nur relative Änderungen herangezogen.
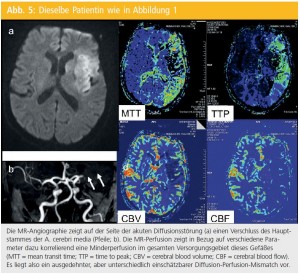 Konzept der Penumbra: In den letzten Jahren wurde die MR-Perfusion auf diese Weise beim Schlaganfall eingesetzt, um das Konzept der so genannten Penumbra zu ver – folgen. Man versteht darunter Anteile von Gehirngewebe um den Infarktkern, die durch die plötzliche Mangeldurchblutung, z. B. infolge eines Gefäßverschlusses, akut gefährdet, aber noch nicht irreversibel geschädigt sind. Daraus leitet sich die Annahme ab, dass diese Gehirnregionen durch eine Wiedereröffnung des Gefäßes noch zu retten wären. Mittels MR hat man versucht, die Penumbra nun als jenes Gebiet zu definieren, bei dem in der DWI noch keine Veränderungen zu erkennen sind, während gleichzeitig eine Minderperfusion gegeben ist, also ein DWI-Perfusion-Mismatch vorliegt (Abb. 5).
Konzept der Penumbra: In den letzten Jahren wurde die MR-Perfusion auf diese Weise beim Schlaganfall eingesetzt, um das Konzept der so genannten Penumbra zu ver – folgen. Man versteht darunter Anteile von Gehirngewebe um den Infarktkern, die durch die plötzliche Mangeldurchblutung, z. B. infolge eines Gefäßverschlusses, akut gefährdet, aber noch nicht irreversibel geschädigt sind. Daraus leitet sich die Annahme ab, dass diese Gehirnregionen durch eine Wiedereröffnung des Gefäßes noch zu retten wären. Mittels MR hat man versucht, die Penumbra nun als jenes Gebiet zu definieren, bei dem in der DWI noch keine Veränderungen zu erkennen sind, während gleichzeitig eine Minderperfusion gegeben ist, also ein DWI-Perfusion-Mismatch vorliegt (Abb. 5).
Wegen verschiedener Einflussfaktoren sowie insbesondere auch Unterschieden in den verwendeten Grenzwerten für eine relevante Hypoperfusion wird die MRT-Penumbra bisher aber noch nicht einheitlich definiert. Dies und die schwer abzuschätzende Dynamik der Akutsituation sind mögliche Gründe, warum dem Konzept des DWI-Perfusion-Mismatch in placebokontrollierten Thrombolysestudien bisher noch kein eindeutiger Erfolg als Behandlungskriterium beschieden war.
Die Ergebnisse klinischer Beobachtungsstudien sind aber durchaus ermutigend. Es ist deshalb anzunehmen, dass mit Verbesserung und Standardisierung der Perfusionsmessungen ein Instrument zur Verfügung gestellt werde könnte, das bei der Selektion von PatientInnen zur interventionellen Schlaganfalltherapie ergänzend zum Faktor Zeit und der MRA hilfreich ist.
Resümee
Mittlerweile stehen bereits eine Reihe von MR-Sequenzen und Techniken zur Verfügung, die eine sehr detaillierte Beurteilung der schlaganfallassoziierten Veränderungen von Gehirn, versorgenden Gefäßen und Hirndurchblutung ermöglichen. Diese Informationen dienen der sicheren und spezifischen Diagnostik, werden aber auch immer mehr für Entscheidungen über bestimmte Behandlungsabläufe herangezogen. Es ist damit zu erwarten, dass in den nächsten Jahren für die spezialisierte Akutbehandlung des Schlaganfalls die durchgehende Verfügbarkeit der MRT genauso eingefordert werden muss, wie dies derzeit für die CT gilt.
Literatur bei den Verfassern