Neuroimaging bei Epilepsie
Welche PatientInnen sollten eine Schädel-MRT-Untersuchung erhalten?
Die Kommission für Neuroimaging der Internationalen Liga gegen Epilepsie (ILAE)7, 8 empfiehlt in nichtakuter Situation eine strukturelle Bildgebung mittels der Schädel-MRT bei allen PatientInnen mit Epilepsien, mit Ausnahme der PatientInnen mit eindeutiger elektroklinischer Diagnose einer generalisierten idiopathischen Epilepsie (benigne myoklonische Epilepsie des Kindesalters, Absence-Epilepsie des Kindesalters, juvenile Absence-Epilepsie, juvenile myoklonische Epilepsie) oder bei benigner Epilepsie des Kindesalters mit zentrotemporalen Spikes. Trotzdem kann manchmal auch bei PatientInnen mit diesen Syndromen eine strukturelle Veränderung vorkommen. Diese Veränderungen sind meist unspezifisch und wurden bereits in einigen Studien berichtet9.
Die Österreichische Sektion der ILAE definierte die Indikation und Ziele der MRT bei PatientInnen mit Epilepsien10 folgendermaßen:
MRT-Indikationen:
Absolute MRT-Indikationen:
- erster unprovozierter Anfall
- Epilepsie (Definition: Auftreten von zumindest zwei unprovozierten Anfällen innerhalb eines Jahres)
- komplizierter Fieberkrampf
Relative MRT-Indikationen:
- akut-symptomatischer Anfall und durchgeführte Akut-CT
- Auch bei klinisch-neurologisch unauffälligen PatientInnen besteht je nach Ursache des unmittelbaren Auslösers im individuellen Fall die Indikation zur MRT.
- Kinder, bei denen eine MRT in Narkose durchgeführt werden muss, mit folgenden Epilepsiesyndromen:
- fokale idiopathische Epilepsien mit altersgebundenem Beginn
- generalisierte idiopathische Epilepsien mit altersgebundenem Beginn
Keine MRT-Indikation:
- einfache Fieberkrämpfe
Ziel der MRT-Untersuchung: Es ist entscheidend, dass der/die zuweisende Arzt/Ärztin dem/der RadiologIn Informationen über die Art der Anfälle bzw. Epilepsie übermittelt (z. B. einfach- oder komplex-fokaler Anfall, generalisierter tonisch-klonischer Anfall). Ziel der MRT-Untersuchung ist:
- die bessere Charakterisierung eines Epilepsiesyndroms
- die Identifizierung einer zugrunde liegenden Ätiologie eines Epilepsiesyndroms/epileptischen Anfalls, um damit prognostische Aussagen zu erhalten und eventuelle therapeutische Konsequenzen abzuleiten.
Welche Sequenzen sollten durchgeführt werden?
Die Neuroimaging-Kommission der ILAE7, 8 stellt fest: „MRT ist essenziell für die prächirurgische Evaluation. (…) Epilepsiechirurgie sollte niemals ohne vorausgegangene MRT durchgeführt werden, außer bei Ausnahmesituation wie spezifische Umstände oder spezifische Kontraindikation (z. B. Herzschrittmacher).“
Es wird empfohlen, mindestens T1- und T2-gewichtete Sequenzen und 3-dimensionale Volumenaufnahmen durchzuführen, wobei die koronaren und axialen Schichtenaufnahmen bzw. Rekonstruktion gewährleistet werden sollte.
Die konventionelle MRT-Untersuchung ist nicht ausreichend und inadäquat für Epilepsiediagnostik, da viele Veränderungen nicht erfasst werden können. Die routinemäßige MRT besteht aus kurzen Aufnahmen mit 3 bis 5 mm Schichtdicke und einem Abstand zwischen den Schichten von 2–3 mm. Sie enthalten nicht die SPGR (spoiled gradient recalled acquisition) oder MPRAGE (magnetization prepared rapid gradient echo) T1-gewichteter Aufnahmen, welche die Grau-weiß-Substanz-Differenzierung erhöhen, was wiederum die kortikale Architektur besser darstellt. Diese Aufnahmen sind auch nicht gewährleistet in koronaren, queren Ebenen, die perpendikulär zur langen Achse des Hippocampus liegen (was auch für die Temporallappen-Beurteilung wichtig ist).
Auf der anderen Seite inkludiert das Epilepsie-Protokoll das ganze Gehirn von Nasion bis Inion, T1-gewichteten MPRAGE- oder SPGR-Aufnahmen mit 1,5 mm Schichtdicke ohne den Abstand zwischen den Schichten. Diese Abbildungen werden als 3-D-Volumen aufgenommen und erlauben somit, die Ausrichtungsfehler der Aufnahmen zu korrigieren sowie die Umformatierung der Ansicht in mehreren Ebenen, um subtile Malformationen der kortikalen Entwicklung zu erfassen.
Das Epilepsie-Protokoll der MRT inkludiert auch die koronaren und axialen FLAIR-Sequenzen mit 3 mm Schichtdicke und einem Abstand von 0–1 mm zwischen den Schichten. Die konventionellen dünnen Schichten (3 mm) der T2-gewichteten axialen und koronaren Sequenzen werden ebenfalls aufgenommen. Eine Gadoliniumgabe ist nicht notwendig, außer wenn ein Tumor oder eine vaskuläre Malformation vermutet wird oder bei manchen neurokutanen Syndromen wie Sturge-Weber-Syndrome (in diesem Fall für die Identifizierung der leptomeningealen Angiomatose).
Die Anwendung des speziellen Epilepsie-Protokolls an den Epilepsiezentren kann epileptische Abnormalitäten mit größerer Sensitivität und Spezifität entdecken. In einer Studie mit 51 PatientInnen, die außerhalb der Epilepsiezentren einer MRT unterzogen wurden, zeigten 34 (67 %) der Aufnahmen keine fokale Abnormalitäten, dabei konnte in 27/34 der Fälle die Hippocampussklerose nicht entdeckt werden. Auf der anderen Seite zeigten die speziellen MRT-Untersuchungen die Veränderung bei 27/29 (93 %) der PatientInnen mit abnormaler Histologie des chirurgisch entnommenen Gewebes11. Die detaillierte Beschreibung der MRT-Protokolle für verschiedene Altersgruppen wurde von der österreichischen Sektion der ILAE vorgeschlagen10.
Zusätzliche Information durch Oberflächenspule?
25 PatientInnen mit therapieresistenten Epilepsien wurden einer prächirurgischen Abklärung mittels 3T-(Tesla-)MRT unterzogen12. Diese PatientInnen wurden entweder als MRT-negativ (n = 15) oder mit unklaren Befunden (n = 10) bei der vorhergehender MRT mit 1,0–1,5T eingestuft. Zusätzlich wurde eine Oberflächenspule über der verdächtigen epileptogenen Zone angewandt. Es konnte gezeigt werden, dass die Oberflächenspule die Visualisierung der kortikalen Läsionen mit besserer Demarkierung der Details erlaubt, was allerdings nicht signifikant unterschiedlich von vordiagnostizierten Läsionen ist und somit keine zusätzliche Information in Bezug auf die Art der Läsion ergibt. Eine epileptogene Läsion wurde bei 12/25 (48 %) der PatientInnen, die mittels 3T-MRT untersucht wurden, vermutet. Es wurden keine zusätzlichen Abnormitäten bei 13/25 (52 %) PatientInnen gefunden. 3T-MRT bietet im Vergleich zum älteren MRT mit 1,0–1,5T eine neue oder zusätzliche Information bei 5/25 (20 %) PatientInnen. Die hoch auflösende MRT kann für die Detektion von Läsionen (z. B. kortikale Malformationen) behilflich sein, allerdings mit einem limitierten zusätzlichen Beitrag der ergänzenden Oberflächenspule im 3T-MRI im Vergleich zu 1,5T-MRT12.
Wer soll die MRT der Epilepsie-PatientInnen beurteilen?
Die Erfahrung der RadiologInnen in Epileptologie ist entscheidend für die Erstellung der hoch qualifizierten Befunde. In einer Studie wurden die MRT-Befunde der „NichtexpertInnen“ mit den Befunden der „ExpertInnen“ bei 123 konsekutiven PatientInnen, die zwischen 1996 und 1999 einer Epilepsiechirurgie unterzogen wurden, verglichen. Dabei konnte gezeigt werden, dass die „NichtexpertInnen“ nur in 39 % der Fälle eine fokale Läsion identifizieren konnten, im Vergleich zu „ExpertInnen“, die eine 50%-ige Sensitivität zeigten; allerdings konnten die RadiologInnen, die sich mit Epilepsie beschäftigen, in 91 % der Fälle die epilepsiespezifische Läsionen feststellen13.
Bildgebung der Temporallappenepilepsien (TLE)
Die Temporallappenepilepsien stellen die häufigsten Formen der fokalen Epilepsien dar, wobei die mesialen Temporallappenepilepsien am häufigsten Therapieresistenz verursachen.
MRT-Aufnahmen des Hippocampus: Die Orientierung der hippocampalen Achse im MRT korrespondiert grob geschätzt mit der langen Achse des Hirnstamms. Am besten orientiert man sich an koronaren und axialen Aufnahmen.
Der Hippocampus wird am besten in koronaren Aufnahmen beurteilt. Das erlaubt die Abschätzung der Größe, der Struktur und den Vergleich der MR-Signale der beiden Hippocampi. Die ganze Länge des Hippocampus kann nur auf den axialen Schichten gesehen werden. Die parasagittalen Aufnahmen können die Einkerbungen der Gyrus dentatus an unterer Grenze identifizieren. Die hippocampale Achse ist exzellent für die Darstellung der meisten subkortikalen und Temporallappen-Strukturen14.
MRT-Merkmale der Hippocampussklerose (HS)
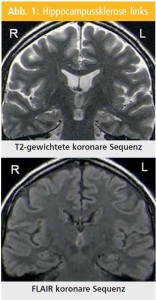
Abnormale hippocampale T2-gewichtete Signale: Die verlässlichsten und sensitivsten Sequenzen für die HS-Diagnostik sind die T2-gewichteten FLAIR-Sequenzen (fluid-attenuated inversion recovery)14–19. Die hohen T2-gewichteten Signale entstehen auch:
- bei Läsionen im Gyrus-parahippocampalis-Bereich,
- bei Fremdgewebe,
- bei Hippocampusdysplasie,
- vom partiellen Volumen des umgebenden Liquor,
- bei Flow-Artefakten, verursacht durch Carotiden.
Interpretationsprobleme entstehen oft aufgrund der nicht korrekten Deutung der Hippocampusstruktur. Die Orientierung der Schichten perpendikulär zur langen Achse vom Hippocampus hilft in den meisten Fällen, den partiellen Volumeneffekt zu vermeiden.
Signal-Hypointensität des Hippocampus in den T1-gewichteten Sequenzen: Die Anwendung der T1-gewichteten Sequenzen, Inversion Recovery (IR), ist sehr hilfreich bei den Untersuchungen der HS, insbesondere wenn der Hippocampus unverändert auf anderen Sequenzen dargestellt wird15, 16. Der atrophierte Hippocampus zeigt ein reduziertes Signal in den T1-gewichteten Aufnahmen, was dem hohen Signal in den T2-gewichteten Aufnahmen entspricht. Die IR-Sequenzen ermöglichen die exzellente anatomische Unterscheidung der Strukturen, was typischerweise mittels T1-Sequenzen alleine nicht möglich ist.
Hippocampusatrophie: Die visuelle Begutachtung der optimal aufgenommenen und orientierten Schichten ermöglicht die verlässliche Diagnosestellung der HS mit einer Sensitivität von 80–85 %17, 19 und ist bei erfahrenen SpezialistInnen fast so gut wie eine Volumenmessung der Hippocampusgröße20.
Verlust der inneren Struktur des Hippocampus: Die normale interne morphologische Struktur des Hippocampus wird von Alveus, der molekularen Zellschicht des Gyrus dentatus und der pyramidalen Zellschicht des Ammonshorns gebildet. Das alles ist besonders gut an koronaren MR-Schichten darstellbar. Der Verlust der normalen inneren Struktur bei der HS ist durch den Verlust der neuronalen Zellen und Gliose verursacht. Die IR-Aufnahmen stellen nicht nur die anatomischen Details, sondern auch den Kontrast zu normalem Hippocampus dar. Die innere Struktur kann aber aufgrund des Alveus auf den weniger kontrastgefärbten Schichten (typisch für T1-Volumen-Sequenzen) im Vergleich zum klar abnormalen Hippocampus fälschlich als normal angenommen werden. Wichtig ist bei der Visualisierung der inneren Struktur des Hippocampus die Berücksichtigung der hohen räumlichen Auflösung und des Kontrasts18.
Zusammenfassend sind die typischen Eigenschaften der HS im MRT die Atrophie, Hyperintensität auf den T2-gewichteten Aufnahmen und Hypointensität auf den T1-gewichteten Aufnahmen sowie Verlust der inneren Struktur (Abb. 1).
Spezielle und quantitative Verfahren
Bei erfahrenen SpezialistInnen ist die visuelle Diagnostik der HS ziemlich verlässlich. Die quantitativen und speziellen Methoden sind sehr hilfreich bei der Evaluation der „MR-negativen“ Temporallappenepilepsien, da viel zusätzliche Information gewonnen werden kann, insbesondere in Hinblick auf dezente Pathologien sowie für die Beurteilung der kontralateralen Hippocampusabnormitäten.
Volumetrie: Der Verlust des Volumens ist ein sensitiver und spezifischer Indikator der HS im klinischen Kontext der Epileptologie21–24. Mesiale temporale Atrophie ipsilateral zur Anfallsursprungszone scheint für TLE spezifisch zu sein25.
Die Volumetrie ist eine simple, aber verlässliche Methode für die Erfassung der Asymmetrie der Hippocampi. Sie kann fast in allen Zentren mit minimalem zusätzlichem Aufwand an Image-Bearbeitung oder technischer Erfahrung durchgeführt werden. Trotzdem bestehen einige Fallgruben: es ist schwer, eine absolute Abnormität zu definieren, da es eine ziemlich breite Streuung an Variationen der normalen Hippocampi gibt. Die Korrektur der Hippocampus-Volumen in ein totales intrakranielles Volumen ist eine sehr hilfreiche Methode, welche die Brauchbarkeit der Volumenmessungen erhöht. Manchmal werden bei der Volumenkorrektion Größe, Geschlecht, Gewicht und Alter berücksichtigt. Frauen haben kleinere Hippocampi als Männer26.
Es scheint, dass das Hippocampusvolumen sich in Abhängigkeit von Temporallappenanfällen ändern kann27, 28. Eine Volumenänderung des Hippocampus kann auch bei einigen anderen Krankheiten wie Demenz29, 30, Schizophrenie31,32, Amnesie33 und ganz selten auch bei normalen Personen34 gefunden werden.
T2-Relaxometrie: Die Entwicklung der T2-Relaxometrie für MRT der Epilepsien entwickelte sich durch die Beobachtung der Erhöhung des Signals in T2-gewichteten Aufnahmen des Hippocampus bei PatientInnen mit HS und aus dem Wunsch, eine quantitative und schnelle Untersuchungsmethode der Messung der Abnormitäten im Hippocampus zu finden, die objektivierbar mit Standardisierungsmöglichkeiten zwischen den unterschiedlichen Zentren wäre. Die T2-Relaxometrie wurde 1993 als quantitative Methode der Messungen der grauen Substanz vom Hippocampus zum ersten Mal eingesetzt35. Diese quantitative Messung ist eine robuste und verlässliche, objektive Methode für die Bestimmung der ganz minimalen, bilateralen und progressiven Pathologien des Hippocampus und somit ein Hilfsmittel für die Beurteilung des Hippocampus mittels visueller Interpretation der optimierten Aufnahmen36–38.
Automatisierte FLAIR-Analyse: Die regionale quantitative FLAIR-Analyse des Hippocampus ist ein sehr viel versprechendes Werkzeug für die Erkennung der ganz minimalen Signalalterationen. In der Studie, die diese Methode validierte, wurden die FLAIR-Signale von 103 PatientInnen mit HS mit den MRT von 131 gesunden Kontrollen verglichen. Die Sensitivität der Methode erreichte 97,1 %. Besonders verlässlich waren die Ergebnisse bei PatientInnen mit histologisch bestätigter HS. Diese Methode kann sogar eine bilaterale HS von den Veränderungen nach einem Status epilepticus unterscheiden39.
Nicht durch Hippocampussklerose verursachte Abnormitäten der mesialen Strukturen
Die Hippocampusdysplasie ist eine nichtspezifische Definition, die eine nicht normale Entwicklung des Hippocampus beinhaltet. Entscheidend dabei ist, dass die Dysplasie des Hippocampus die nichtkorrekte Seite der HS vortäuschen kann – ein kleinerer Hippocampus könnte als HS angenommen werden. Das kann leicht passieren, wenn T1- und T2-Sequenzen ohne Kontrast dargestellt werden oder wenn die Größe des Hippocampus als einziger Parameter für die Diagnostik der HS verwendet wird. Durch die Dysplasie ist der Hippocampus größer, und so kann der andere Hippocampus als sklerotisch vorgetäuscht werden. In Wirklichkeit kann der vergrößerte Hippocampus in Assoziation mit anderen Malformationen der Entwicklung des Kortex wie bei Hemimegalenzephalie beobachtet werden40. Die bilateralen hippocampalen Dysplasien wie bilaterale mesiale temporale Polymikrogyrie sind sehr selten und können auch als HS fehlinterpretiert werden41.
Hippocampale Malrotation: Die Malrotation des Hippocampus wird auch als eine Entwicklungsanomalie angesehen, wobei die Rolle dieser Veränderung in der Anfallserzeugung noch lange nicht geklärt ist42–44. Die MRT-Charakteristika sind: die inkomplette Inversion des Hippocampus mit abnormal runden Konturen, die normale Signalintensität und Lage, die unscharfe innere Struktur, der abnormale Winkel des kollateralen Sulcus, die abnormale Position und Größe der Fornix, die normale Größe der Temporallappen und die Vergrößerung des Temporalhorns, oft assoziiert mit der Agenesie der Corpus callosum. Es ist sehr wenig über die Histologie des radiologisch identifizierten globulären oder pyramidal geformten malrotierten Hippocampus bekannt. Ein histopathologisch abnormal gefalteter hippocampaler Sektor mit typischen Eigenschaften der klassischen Ammonshornssklerose wurden bei einem Patienten mit MRT-malrotierten Hippocampus beschrieben45.
Extrahippocampaler Temporallappen
Sklerose der Amygdala: Im pathologischen Prozess der mesialen temporalen Sklerose können außer Hippocampus auch die Amygdala, der Temporalpol und entorhinaler Kortex involviert sein36, 46, 47.
Die Amygdalae werden am besten an den gekippten axialen Schichten identifiziert, wo eine klare Separation des Hippocampus und der Amygdala möglich ist, zusammen mit standardisierten koronaren Aufnahmen. Die visuelle Diagnostik der Amygdalasklerose ist mit Ausnahme ganz seltener Fälle schwierig. Am effektivsten sind quantitative Methoden wie die T2-Relaxometrie und die Volumetrie23,36. Vergrößerte Amygdalae mit Signalzunahme auf den T2-Sequenzen (speziell auf FLAIR-Sequenzen) können auch ein Teil der fokalen kortikalen Dysplasie vom Non-Taylor-Type sein. In solchen Fällen sollte besonders auf die andere Seite geachtet und diese wegen kleinerer Größe nicht sofort als atrophiert diagnostiziert werden48.
Abnormalitäten des Gyrus parahippocampalis: Ein indirektes Zeichen der mesialen Sklerose ist die Atrophie und Signaländerung des Gyrus parahippocampalis. Zusätzlich kommt es zur Verdünnung der weißen Substanz und Unschärfe der Grau-weiß-Substanz-Differenzierung. In manchen Fällen ist die Abnormität der parahippocampalen weißen Substanz der einzige Hinweis auf den Anfallsursprung. Diese Areale sollten bei PatientInnen mit MRT-negativen Epilepsien ganz genau evaluiert werden48.
Duale Pathologie: Die Kombination der Abnormitäten des Hippocampus (meistens HS) mit extrahippocampalen Läsionen wird als „duale Pathologie“ bezeichnet49, 50.
Die duale Pathologie in der Histologie des temporalen Neocortex wurde zum ersten Mal bei den PatientInnen mit therapieresistenter Epilepsie beschrieben, die einer Temporallappenresektion aufgrund der HS unterzogen wurden51, 52. 15–50 % der PatientInnen mit HS haben eine duale Pathologie – eine Malformation der kortikalen Entwicklung (MCD) und andere entwicklungsstörungsbedingte Läsionen, wie Porenzephalie oder Ulegyrie (verursacht durch perinatale ischämische Hirnläsion)41a, 53, 54. Selten kommt die „duale Pathologie“ bei PatientInnen mit vaskulären Malformationen (7 %) oder Hirntumoren (2 %) vor21.
In einer Studie wurde versucht, den Zusammenhang zwischen den Typen der MCD und Hippocampusformation (HF) zu finden40. Eine kleine HF war bei allen Formen der MCD präsent, die malrotierte HF kam meistens vor bei PatientInnen mit periventrikulären nodulären Heterotopien, während die vergrößerte HF mit Lissenzephalie-Argyrie-Pachygyrie, subkortikalen Bandheterotopien und Hemimegalenzephalie assoziiert war40.
Die Häufigkeit der Abnormitäten der HF bei PatientInnen mit MCD beträgt etwa 25 bis 30 % (Cendes et al.21 bis 25 %; Montenegro et al.40 bis 29,5 %; Kuchukhidze et al.55 bis 31 %).
Andererseits wurde MCD bei 15–30 % der PatientInnen mit klassischer HS gefunden51, 56. Die besten chirurgischen Ergebnisse bei den dualen Pathologien werden durch Resektion nicht nur des sklerotischen Hippocampus, sondern aller Läsionen erzielt57–59. Die Entwicklung der neuen MRT-Methoden und Postprocessing-Protokolle ermöglichen die Entdeckung dieser kleinen Malformationen39, 60, 61.
TLE-Zusammenfassung
Die Eigenschaften wie Volumenverlust, Signaländerung und abnormale Morphologie sind bereits bekannt. Der Volumenverlust mit abnormalem Signal im Hippocampusbereich hat nicht die gleiche Bedeutung wie nur Volumenverlust alleine. Die HS im Kontext mit einer anderen Läsion muss anders interpretiert werden. Auf der anderen Seite sind die Abnormitäten oft nicht nur auf Hippocampus oder den ganzen epileptogenen Temporallappen begrenzt. Es sind 3 große Subgruppen der HS, die mittels MRT identifiziert werden sollen:
- klassische HS – HS mit Volumenverlust und Signaländerung in der ganzen Läsion;
- HS mit zusätzlicher Abnormität, die nicht eine definitiv andere Läsion ist (wie z. B. Weiße-Substanz-Abnormität des Temporalpols, Temporallappen- oder ganze Hemisphären-Atrophie)
- HS mit zusätzlicher klar identifizierbarer Läsion wie z. B. fokaler Tumor oder MCD (im Sinne einer dualen Pathologie).
Weitere zerebrale Abnormitäten
Die Beschreibung der diversen Läsionen, die eine Epilepsie verursachen können, würde den Rahmen des Artikels sprengen. Wir beschränken uns auf einige, die durch die Entwicklung von Neuroimaging und Epilepsiechirurgie das Interesse erweckt haben.
Malformationen der kortikalen Entwicklung (MCD)
Diese werden aufgrund der Refraktärität der Anfälle im Kindesalter und auch bei Er wachsenen zunehmend erkannt6. Sie werden durch abnormale neuronale Proliferation/Apoptosis, Migration oder Organisation verursacht62. Die MRT mit hoher Auflösung ermöglicht die bessere Darstellung des Kortex. Die subtilen Abnormitäten der weißen Substanz können wichtige Hinweise auf Bestehen der MCD sein (insbesondere wenn es sich um Ballonzellendysplasien handelt). Aus diesem Grund ist es wichtig, FLAIR-Sequenzen anzufertigen. Eine besondere Herausforderung ist die Diagnose der fokalen kortikalen Dysplasie (FCD). Bei ca. 25 % der operierten Erwachsenen und bis zu 50 % der Kinder wird FCD als Ursache für Epilepsie berichtet63–68. Trotzdem ist es schwer, die exakte Prävalenz der FCD nur auf Basis von Neuroimaging-Studien abzuschätzen. Mittlerweile wurden verschiedene Klassifikationen, die sich auf Bildgebung, genetische Untersuchungen und Histopathologie stützen, vorgeschlagen62, 68–71. Die ganz rezente histopathologische Klassifikation der FCD reflektiert die klinischen Aspekte der FCD deutlich mehr als alle früheren Nomenklaturen und wird auch von ILAE empfohlen72. Einige Studien sind auf die klinischen Unterschiede zwischen Subtypen der FCD fokussiert, trotzdem ist es evident, dass unterschiedliche FCD-Subgruppen unterschiedliche elektroklinische und radiologische Befunde zeigen71, 73–78. Dennoch bleibt die Korrelation zwischen den unterschiedlichen histopathologischen Typen der FCD und dem chirurgischen Outcome ein Diskussionsthema58, 79–83.
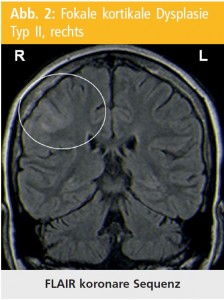
FCD Typ-II: Das Spektrum der MRT-Veränderungen ist für FCD Typ II gut ausgearbeitet und enthält folgende Parameter: die Verdickung des Kortex, das abnormale Muster von Gyri und Sulci, die verwaschene Grau-weiß-Substanz-Differenzierung und Transmantel-Lokalisation der Signaländerungen, welche die weiße und auch die graue Substanz betrifft67,71, 74, 77, 84, 88 (Abb. 2).
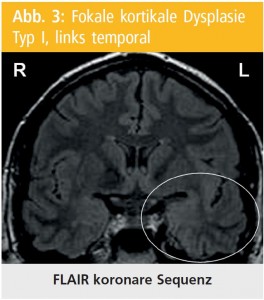
FCD Typ I: Im Gegensatz zu FCD Typ II ist die MRT-Diagnostik der FCD vom Typ I eine große Herausforderung. Die typische MRT der FCD-I zeigt eine regionale Reduktion des Volumens der weißen Substanz in Assoziation mit diskreter Signaländerung in T2-gewichteten Sequenzen (Abb. 3). In den letzten Jahren wurden mehrere Methoden von Image-Post-Processing zur Verbesserung der Diagnostik der FCD im MRT entwickelt61,89–91. Beim Großteil von ihnen wird selbstentwickelte Software verwendet. Das schränkt die verbreitete Anwendung sehr ein. Die voxelbasierte morphometrische MRT-Analyse wird mittels statistical parametric mapping software (SPM5, Welcome Department of Imaging Neuroscience Group; http://www.fil.ion.ucl.ac.uk/spm) verwendet. Diese Methode wurde von H.-J. Huppertz und seiner Arbeitsgruppe entwickelt und hat eine weite Anwendung in vielen europäischen Epilepsiezentren gefunden92. Die Methode hebt die Hirnareale mit unscharf abgegrenzten Grau-weiß-Substanz- Arealen und abnormer Gyrierung hervor. Dabei werden 3-dimensionale „feature maps“ erstellt, was bei der Detektion der FCD sehr hilfreich ist. Die Erkennungsrate der FCD IIa wird von 65 % (bei NeuroradiologInnen mit Schwerpunkt Epilepsie) bis 82 % (bei Anwendung der Post-Processing-Methode) erhöht93. Da die genaue Abgrenzung der FCD in der MRT im Rahmen der prächirurgischen Abklärung die Wahrscheinlichkeit für den guten postoperativen Outcome deutlich erhöhen kann, wird empfohlen, die morphometrische Analyse bei allen PatientInnen, die keine Läsion in der MRT zeigen, durchzuführen.
1 Falconer MA, Serafetinides EA, Corsellis JAN, Etiology and pathogenesis of temporal lobe epilepsy. Arch Neurol 1964; 10:233–240
2 Dreifuss FE, Proposal for revised clinical and electroencephalographic classification of epileptic seizures. Epilepsia 1981; 22:489–501
3 Delgado-Escueta AV, Walsh GO, Type I complex partial seizures of hippocampal origin: excellent results of anterior temporal lobectomy. Neurology 1985; 35:143–154
4 Duncan JS, Sagar HJ, Seizure characteristics, pathology, and outcome after temporal lobectomy. Neurology 1987; 37:405–409
5 Hauser WA, The natural history of temporal lobe epilepsy. In: Luders H, (ed): Epilepsy surgery. Raven Press, New York 1991, pp 133–141
6 Palmini A, Andermann F, Olivier A, Tampieri D, Robitaille Y, Focal neuronal migration disorders and intractable partial epilepsy, results of surgical treatment. Ann Neurol 1991; 30:750–757
7 Commission on Neuroimaging of the International League Against Epilepsy, Guidelines for neuroimaging evaluation of patients with uncontrolled epilepsy considered for surgery. Epilepsia 1998; 39:1375–1376
8 Commission on Neuroimaging of the International League Against Epilepsy, Recommendations for neuroimaging of patients with epilepsy. Epilepsia 1997; 38:1255–1256
9 Betting LE, Mory SB, Lopes-Cendes I, Li LM, Guerreiro MM, Guerreiro CA, Cendes F, MRI reveals structural abnormalities in patients with idiopathic generalized epilepsy. Neurology 2006; 67:848–852
10 Serles W, Baumgartner Ch, Feichtinger M, Felber St, Feucht M, Podreka I, Trinka E, Prayer D, Richtlinien für ein standardisiertes MRT-Protokoll für Patienten mit epileptischen Anfällen in Österreich. Mitteilungen der Österreichischen Sektion der Internationalen Liga gegen Epilepsie 2003; 3:2–13
11 McBride MC, Bronstein KS, Bennett B, Erba G, Pilcher W, Berg MJ, Failure of standard magnetic resonance imaging in patients with refractory temporal lobe epilepsy. Arch Neurol 1998; 55:346–348
12 Strandberg M, Larsson EM, Backman S, Källén K, Pre-surgical epilepsy evaluation using 3T MRI. Do surface coils provide additional information? Epileptic Disord 2008; 10:83–92
13 von Oertzen J, Urbach H, Jungbluth S, Kurthen M, Reuber M, Fernández G, Elger CE: J Neurol Neurosurg Psychiatry 2002; 73;643–647
14 Jackson GD, Berkovic SF, Duncan JS, Connelly A: Optimizing the diagnosis of hippocampal sclerosis using magnetic resonance imaging. AmJNeurorad 1993; 14:753–762
15 Urbach H, Imaging of the epilepsies. Eur Radiol 2005; 15:494–500
16 Van Paesschen W, Qualitative and quantitative imaging of the hippocampus in mesial temporal lobe epilepsy with hippocampal sclerosis. Neuroimaging Clin N Am 2004; 14:373–400
17 Jackson GD, Duncan JS, Connelly A, Ausfin SJ: Increased signal in the mesial temporal region on T2 weighted MRI; a quantitative study of hippocampal sclerosis. Neurology 1991; 41(Suppl 1),170–171
18 Kuzniecky R, Jackson GD, Magnetic resonance in epilepsy. Raven Press, New York,1995
19 Berkovic SF, Andermann F, Olivier A, Ethier R, Melanson D, Robitaille Y, Kuzniecky R, Peters T, Feindel W, Hippocampal sclerosis in temporal lobe epilepsy demonstrated by magnetic resonance imaging. Ann Neurol 1991; 29:175–182
20 Spencer SS, McCarthy G, Spencer DD, Diagnosis of medial temporal lobe seizure onset: relative specificity and sensitivity of quantitative MRI. Neurology 1993; 43:2117–2124
21 Cendes F, Andermann F, Gloor P, Evans A, Jones-Gotman M, Watson C, Melanson D, Olivier A, Peters T, Lopes-Cendes I, Leroux G, MRI volumetric measurement of amygdala and hippocampus in temporal lobe epilepsy. Neurology 1993; 43:719–725
22 Bernasconi N, Bernasconi A, Caramanos Z, Antel SB, Andermann F, Arnold DL: Mesial temporal damage in temporal lobe epilepsy, a volumetric MRI study of the hippocampus, amygdala and parahippocampal region. Brain 2003a; 126:462–469
23 Bernasconi N, Natsume J, Bernasconi A, Progression in temporal lobe epilepsy: differential atrophy in mesial temporal structures. Neurology 2005; 65:223–228
24 Cavus I, Pan JW, Hetherington HP, Abi-Saab W, Zaveri HP, Vives KP, Krystal JH, Spencer SS, Spencer DD, Decreased hippocampal volume on MRI is associated with increased extracellular glutamate in epilepsy patients. Epilepsia 2008; 49:1358–1366
25 Bernasconi N, Andermann F, Arnold DL, Bernasconi A, Entorhinal cortex MRI assessment in temporal, extratemporal, and idiopathic generalized epilepsy. Epilepsia 2003; 44:1070–1074
26 Briellmann RS, Berkovic SF, Jackson GD, Men may be more vulnerable to seizure-associated brain damage. Neurology 2000; 55:1479–1485.
27 Briellmann RS, Newton MR, Wellard RM, Jackson GD, Hippocampal sclerosis following brief generalized seizures in adulthood. Neurology 2001; 57:315–317
28 Briellmann RS, Berkovic SF, Syngeniotis A, King MA, Jackson GD, Seizure-associated hippocampal volume loss, a longitudinal magnetic resonance study of temporal lobe epilepsy. Ann Neurol 2002; 51:641–644
29 Wang L, Swank JS, Click IE, Gado MH, Miller MI, Morris JC, Csernansky JG, Changes in hippocampal volume and shape across time distinguish dementia of the Alzheimer type from healthy aging. Neuroimage 2003; 20:667–682
30 Barnes J, Foster J, Boyes RG, Pepple T, Moore EK, Schott JM, Frost C, Scahill RI, Fox NC, A comparison of methods for the automated calculation of volumes and atrophy rates in the hippocampus. Neuroimage. 2008; 40:1655–1671
31 Exner C, Nehrkorn B, Martin V, Huber M, Shiratori K, Rief W, Sex-dependent hippocampal volume reductions in schizophrenia relate to episodic memory deficits. J Neuropsychiatry Clin Neurosci. 2008; 20:227–230
32 Strasser HC, Lilyestrom J, Ashby ER, Honeycutt NA, Schretlen DJ, Pulver AE, Hopkins RO, Depaulo JR, Potash JB, Schweizer B, Yates KO, Kurian E, Barta PE, Pearlson GD, Hippocampal and ventricular volumes in psychotic and nonpsychotic bipolar patients compared with schizophrenia patients and community control subjects, a pilot study. Biol Psychiatry 2005; 57:633–639
33 Di Paola M, Caltagirone C, Fadda L, Sabatini U, Serra L, Carlesimo G, Hippocampal atrophy is the critical brain change in patients with hypoxic amnesia. Hippocampus 2008; 18:719–728
34 Kobayashi E, Li LM, Lopes-Cendes I, Cendes F, Magnetic resonance imaging evidence of hippocampal sclerosis in asymptomatic, first degree relatives of patients with familial mesial temporal lobe epilepsy. Arch Neurol 2002; 59:1891–1894
35 Jackson GD, Connelly A, Duncan JS, Grünewald RA, Gadian DG, Detection of hippocampal pathology in intractable partial epilepsy, increased sensitivity with quantitative magnetic resonance T2 relaxometry. Neurology 1993b; 43:1793–1799
36 Pell GS, Briellmann RS, Pardoe H, Abbott DF, Jackson GD, Composite voxel-based analysis of volume and T2 relaxometry in temporal lobe epilepsy. Neuroimage 2008; 39:1151–1161
37 Coan AC, Bonilha L, Morgan PS, Cendes F, Li LM, T2- weighted and T2 relaxometry images in patients with medial temporal lobe epilepsy. J Neuroimaging 2006; 16:260–265
38 Bartlett PA, Symms MR, Free SL, Duncan JS, T2 relaxometry of the hippocampus at 3T. AJNR Am J Neuroradiol 2007; 28:1095–1098
39 Huppertz HJ, Wagner J, Weber B, House P, Urbach H, Automated quantitative FLAIR analysis in hippocampal sclerosis. Epilepsy Res 2011 [Epub ahead of print], doi.10.1016/j.eplepsyres.2011.08.001
40 Montenegro MA, Kinay D, Cendes F, Bernasconi A, Bernasconi N, Coan AC, Li LM, Guerreiro MM, Guerreiro CA, Lopes-Cendes I, Andermann E, Dubeau F, Andermann F, Patterns of hippocampal abnormalities in malformations of cortical development. J Neurol Neurosurg Psychiatry 2006; 77:367–371
41 Kuchukhidze G, Helbok R, Unterberger I, Koppel – staetter F, Bodner T, Trinka E, Bilateral mesial temporal polymicrogyria: a case report. J Neurol Neurosurg Psychiatry 2008; 79:483–484
41aKuchukhidze G, Unterberger I, Dobesberger J, Embacher N, Walser G, Haberlandt E, Gotwald T, Maier H, Ortler M, Felber S, Bauer G, Trinka E, Electroclinical and Imaging Findings in Ulegyria and Epilepsy – a Study on 25 Patients. Journal of Neurology, Neuro surgery and Psychiatry 2008; 79:547–552
42 Baulac M, De Grissac N, Hasboun D, Oppenheim C, Adam C, Arzimanoglou A, Semah F, Lehéricy S, Clémenceau S, Berger B, Hippocampal developmental changes in patients with partial epilepsy, magnetic resonance imaging and clinical aspects. Ann Neurol 1998; 44:223–233
43 Barsi P, Kenéz J, Solymosi D, Kulin A, Halász P, RásonyiG, Janszky J, Kalóczkai A, Barcs G, Neuwirth M, Paraicz E, Siegler Z, Morvai M, Jerney J, Kassay M, Altmann A, Hippocampal malrotation with normal corpus callosum, a new entity? Neuroradiology 2000; 42:339–345
44 Peltier B, Hurtevent P, Trehan G, Derambure P, Pruvo JP, Soto-Ares G, [MRI of hippocampal malformations in patients with intractable temporal lobe epilepsy] J Radiol 2005; 86:69–75
45 Thom M, Sisodiya SM, Lin WR, Mitchell T, Free SL, Stevens J, Scaravilli F, Bilateral isolated hippocampal malformation in temporal lobe epilepsy. Neurology 2002; 58:1683–1686
46 Hudson LP, Munoz DG, Miller L, McLachlan RS, Girvin JP, Blume WT, Amygdaloid sclerosis in temporal lobe epilepsy. Ann Neurol 1993; 33:622–631
47 Gonçalves Pereira PM, Oliveira E, Rosado P, Relative localizing value of amygdalo-hippocampal MR biometry in temporal lobe epilepsy. Epilepsy Res 2006; 69:147–164
48 Jackson GD, Briellmann RS and Kuzniecky R, Temporal lobe epilepsy. In: JacksonGD, Kuzniecky,R (eds): Magnetic resonance in epilepsy. Raven Press, New York 2006, pp. 99–176
49 Babb TL, Brown WJ, Pathological findings in epilepsy. In: Engel J Jr, (ed): Surgical treatment of the epilepsies. Raven Press, New York 1987, pp 511–540
50 Cascino GD, Boon P, Fish DR, Surgically remediable lesional syndromes. In: Engel J Jr, (ed): Surgical treatment of the epilepsies. 2nd ed. Raven Press, New York 1993, pp 77-86
51 Levesque MF, Nakasato N, Vinters HV, Babb TL, Surgical treatment of limbic epilepsy associated with extrahippocampal lesions, the problem of dual pathology. J Neurosurg 1991; 75:364–370
52 Nakasato N, Levesque MF, Babb TL, Seizure outcome following standard temporal lobectomy: correlation with hippocampal neuron loss and extrahippocampal pathology. J Neurosurg 1992; 77:194–200
53 Cendes F, Cook MJ, Watson C, Andermann F, Fish DR, Shorvon SD, Bergin P, Free S, Dubeau F, Arnold DL, Frequency and characteristics of dual pathology in patients with lesional epilepsy. Neurology 1995; 45:2058–2064
54 Kim HI, Lee MC, Lee JS et al., Bilateral perisylvian ulegyria, clinicopathological study of patients presenting with pseudobulbar palsy and epilepsy. Neuropathology 2006; 26:236–242
55 Kuchukhidze G, Koppelstaetter F, Unterberger I, Dobesberger J, Walser G, Zamarian L, Haberlandt E, Maier H, Ortler, Gotwald T, Gelpi E, Czech T, Feucht M, Bauer G, Delazer M, Felber S, Trinka E, Hippocampal abnormalities in malformations of cortical development: MRI study. Neurology2010; 74:1575–1582
56 Raymond AA, Fish DR, Stevens JM, Cook MJ, Sisodiya SM, Shorvon SD, Association of hippocampal sclerosis with cortical dysgenesis in patients with epilepsy. Neurology 1994; 44:1841–1845
57 Aghakhani Y, Kinay D, Gotman J, Soualmi L, Andermann F, Olivier A, Dubeau F, The role of periventricular nodular heterotopia in epileptogenesis. Brain 2005; 128:641–651
58 Fauser S, Schulze-Bonhage A, Honegger J, Carmona H, Huppertz HJ, Pantazis G, Rona S, Bast T, Strobl K, Steinhoff BJ, Korinthenberg R, Rating D, Volk B, Zentner J, Focal cortical dysplasias, surgical outcome in 67 patients in relation to histological subtypes and dual pathology. Brain 2004; 127:2406–2418
59 Sisodiya SM, Moran N, Free SL, Kitchen ND, Stevens JM, Harkness WF, Fish DR, Shorvon SD, Correlation of widespread preoperative magnetic resonance imaging changes with unsuccessful surgery for hippocampal sclerosis. Ann Neurol 1997; 41:490–496
60 Sisodiya SM, Free S, Fish DR, Shorvon SD, Novel magnetic resonance imaging methods for quantifying changes in the cortical ribbon in patients with epilepsy. Adv Neurol 1999; 81:81–87
61 Bastos AC, Comeau M, Andermann F, Melanson D, Cendes F, Dubeau F, Fontaine S, Tampieri D, Olivier A, Diagnosis of subtle focal dysplastic lesions, curvilinear reformatting from three dimensional magnetic resonance imaging. Ann Neurol 1999; 46:88–94
62 Barkovich AJ, Kuzniecky RI, Jackson GD, Guerrini R, Dobyns WB: A developmental and genetic classification for malformations of cortical development. Neurology 2005; 65:1873–1887
63 Wyllie E, Comair YG, Kotagal P, Bulacio J, Bingaman W, Ruggieri P, Seizure outcome after epilepsy surgery in children and adolescents. Ann Neurol 1998; 44:740–748
64 Mathern GW, Giza CC, Yudovin S, Vinters HV, Peacock WJ, Shewmon DA, Shields WD, Postoperative seizure control and antiepileptic drug use in pediatric epilepsy surgery patients, the UCLA experience, 1986–1997. Epilepsia 1999; 40:1740–1749
65 Sisodiya SM, Surgery for malformations of cortical development causing epilepsy. Brain 2000; 123:1075–1091
66 Tuxhorn I, Moch A, Holthausen H, Pediatric epilepsy surgery, state of the art, recent developments and future perspectives. Epileptic Disord 2000; 2:53–55
67 Colombo N, Citterio A, Galli C, Tassi L, Lo Russo G, Scialfa G, Spreafico R, Neuroimaging of focal cortical dysplasia, neuropathological correlations. Epileptic Disord 2003a; 5(Suppl. 2):67–72
68 Hildebrandt M, Pieper T, Winkler P, Kolodziejczyk D, Holthausen H, Blumcke I, Neuropathological spectrum of cortical dysplasia in children with severe focal epilepsies. Acta Neuropathol (Berl) 2005; 110:1–11
69 Mischel PS, Nguyen LP, Vinters HV, Cerebral cortical dysplasia associated with pediatric epilepsy. Review of neuropathologic features and proposal for a grading system. J Neuropathol Exp Neurol 1995; 54:137–153
70 Raymond AA, Fish DR, Sisodiya SM, Alsanjari N, Stevens JM, Shorvon SD, Abnormalities of gyration, heterotopias, tuberous sclerosis, focal cortical dysplasia, microdysgenesis, dysembryoplastic neuroepithelial tumour and dysgenesis of the archicortex in epilepsy. Clinical, EEG and neuroimaging features in 100 adult patients. Brain 1995; 118:629–660
71 Tassi L, Colombo N, Garbelli R, Francione S, Lo Russo G, Mai R, Cardinale F, Cossu M, Ferrario A, Galli C, Bramerio M, Citterio A, Spreafico R, Focal cortical dysplasia, neuropathological subtypes, EEG, neuroimaging and surgical outcome. Brain 2002; 125:1719–1732
72 Blümcke I, Thom M, Aronica E, Armstrong DD, Vinters HV, Palmini A, Jacques TS, Avanzini G, Barkovich AJ, Battaglia G, Becker A, Cepeda C, Cendes F, Colombo N, Crino P, Cross JH, Delalande O, Dubeau F, Duncan J, Guerrini R, Kahane P, Mathern G, Najm I, Ozkara C, Raybaud C, Represa A, Roper SN, Salamon N, Schulze- Bonhage A, Tassi L, Vezzani A, Spreafico R, The clinicopathologic spectrum of focal cortical dysplasias, a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission.Epilepsia. 2011; 52:158–174.
73 Tassi L, Pasquier B, Minotti L, Garbelli R, Kahane P, Benabid AL, Battaglia G, Munari C, Spreafico R, Cortical dysplasia, electroclinical, imaging, and neuropathologic study of 13 patients. Epilepsia 2001; 42:1112–1123
74 Colombo N, Tassi L, Galli C, Citterio A, Lo Russo G, Scialfa G, Spreafico R, Focal cortical dysplasias, MR imaging, histopathologic, and clinical correlations in surgically treated patients with epilepsy. Am J Neuro – radiol 2003b; 24:724–733
75 Francione S, Vigliano P, Tassi L, Cardinale F, Mai R, Lo Russo G, Munari C, Surgery for drug resistant partial epilepsy in children with focal cortical dysplasia, anatomical- clinical correlations and neurophysiological data in 10 patients. J Neurol Neurosurg Psychiatry 2003; 74:1493–1501
76 Lawson JA, Birchansky S, Pacheco E, Jayakar P, Resnick TJ, Dean P, Duchowny MS, Distinct clinicopathologic subtypes of cortical dysplasia of Taylor. Neurology 2005; 64:55–61
77 Widdess-Walsh P, Kellinghaus C, Jeha L, Kotagal P, Prayson R, Bingaman W, Najm IM, Electro-clinical and imaging characteristics of focal cortical dysplasia, correlation with pathological subtypes. Epilepsy Res 2005; 67:25–33
78 Fauser S, Schulze-Bonhage A, Epileptogenicity of cortical dysplasia in temporal lobe dual pathology, an electrophysiological study with invasive recordings. Brain 2006; 129:82–95
79 Keene DL, Jimenez CC, Ventureyra E, Cortical microdysplasia and surgical outcome in refractory epilepsy of childhood. Pediatr Neurosurg 1998; 29:69–72
80 Chassoux F, Devaux B, Landre E, Turak B, Nataf F, Varlet P, Chodkiewicz JP, Daumas-Duport C, Stereo – electroencephalography in focal cortical dysplasia, a 3D approach to delineating the dysplastic cortex. Brain 2000; 123:1733–1751
81 Kloss S, Pieper T, Pannek H, Holthausen H, Tuxhorn I, Epilepsy surgery in children with focal cortical dysplasia (CD), results of longterm seizure outcome. Neuro – pediatrics 2002; 33:21–26
82 Kral T, Clusmann H, Blumcke I, Fimmers R, Ostertun B, Kurthen M, Schramm J, Outcome of epilepsy surgery in focal cortical dysplasia. J Neurol Neurosurg Psychiatry 2003; 74:183–188
83 Krsek P, Pieper T, Karlmeier A, Hildebrandt M, Kolodziejczyk D, Winkler P, Pauli E, Blümcke I, Holthausen H, Different presurgical characteristics and seizure outcomes in children with focal cortical dysplasia type I or II. Epilepsia 2009; 50:125–137
84 Lee SK, Choe G, Hong KS, Nam HW, Kim JY, Chung CK, Lee DS, Chang KH, Neuroimaging findings of cortical dyslamination with cytomegaly. Epilepsia 2001; 42:850–856
85 Matsuda K, Mihara T, Tottori T, Otubo T, Usui N, Baba K, Matsuyama N, Yagi K, Neuroradiologic findings in focal cortical dysplasia, histologic correlation with surgically resected specimens. Epilepsia 2001; 42(Suppl. 6), 29–36
86 Urbach H, Scheffler B, Heinrichsmeier T, von Oertzen J, Kral T,Wellmer J, Schramm J, Wiestler OD, Blumcke I, Focal cortical dysplasia of Taylor’s balloon cell type, a clinicopathological entity with characteristic neuroimaging and histopathological features, and favourable postsurgical outcome. Epilepsia 2002; 43:33–40
87 Bautista JF, Foldvary-Schaefer N, Bingaman WE, Lüders HO, Focal cortical dysplasia and intractable epilepsy in adults, clinical, EEG, imaging, and surgical features. Epilepsy Res 2003; 55:131–136
88 Ruggieri PM, Najm I, Bronen R, Campos M, Cendes F, Duncan JS, Weiser HG, Theodore WH, Neuroimaging of the cortical dysplasias. Neurology 2004; 62(Suppl. 3):27–29
89 Bernasconi A, Bernasconi N, Bernhardt BC, Schrader D, Advances in MRI for „cryptogenic“ epilepsies. Nat Rev Neurol 2011; 7:99–108
90 Colliot O, Antel SB, Naessens VB, Bernasconi N, Bernasconi A, In vivo profiling of focal cortical dysplasia on high-resolution MRI with computational models. Epilepsia 2006; 47:134–142
91 Srivastava S, Maes F, Vandermeulen D, Van PW, Dupont P, Suetens P, Feature-based statistical analysis of structural MR data for automatic detection of focal cortical dysplastic lesions. Neuroimage 2005; 27:253–266
92 Huppertz HJ, Grimm C, Fauser S, Kassubek J, Mader I, Hochmuth A, Spreer J, Schulze-Bonhage A, Enhanced visualization of blurred gray-white matter junctions in focal cortical dysplasia by voxelbased 3D MRI analysis. Epilepsy Res 2005; 67:35–50
93 Wagner J, Weber B, Urbach H, Elger C, Huppertz HJ, Morphometric MRI analysis improves detection of focal cortical dysplasia type II. Brain 2011 [Epub ahead of print], doi:10.1093/brain/awr204