1972–2012 – Rückblick auf 40 Jahre „Non-Stop Revolution“ in der Diabetologie

Vergegenwärtigt man sich, auf welchem Erkenntnisstand sich die Diabetologie Anfang der 1970er-Jahre*) befand, so wird deutlich, welch enorme Fortschritte seitdem auf diesem Gebiet gemacht wurden: Diabetes wurde damals ausschließlich nach dem Manifestationsalter als juveniler Diabetes oder Altersdiabetes klassifiziert. Immunpathogenese und Immungenetik des Typ-1-Diabetes wurden erst nach der Entdeckung der Inselzellantikörper und des Systems humaner Leukozytenantigene (HLA) schrittweise entschlüsselt; für letztere Leistung erhielten J. Dausset, B. Benacerraf und G. D. Snell im Jahr 1980 den Nobelpreis für Medizin. Zuvor hatte R. DeFronzo mit seinen Mitarbeitern (Am J Physiol 1979) die Glukose-Clamp-Technik entwickelt und damit die Ära der Insulinresistenzforschung eingeläutet und W. Creutzfeldt (Diabetologia 1979) sein „Inkretinkonzept“ vorgestellt, aus dem ein Vierteljahrhundert später die DPP-4-Hemmer und GLP-1-Rezeptoragonisten hervorgehen sollten. Die Einteilung nach Typ-1-Diabetes und Typ-2-Diabetes stammt aus dem Jahr 1988, der „Latent Autoimmune Diabetes in Adults“ (LADA) wurde einige Jahre später in der Gruppe von P. Zimmet erstmals beschrieben (Tuomi et al., Diabetes 1993).
Aus heutiger Sicht kaum vorstellbar ist auch, dass Anfang der 1970er-Jahre an Pharmaka zur Blutzuckersenkung ausschließlich tierisches Insulin, Sulfonylharnstoffe der ersten Generation und Metformin zur Verfügung standen, jedoch keine Möglichkeiten der Blutzuckerselbstkontrolle, der HbA1c-Messung oder der Albuminuriebestimmung. Die einzige nennenswerte Endpunktstudie zur antidiabetischen Therapie war das University Group Diabetes Program (UGDP), Outcome-Studien zur Blutdruck- und zur Lipidsenkung bei Diabetikern gab es nicht. „Altersdiabetes“ war mit einer kardiovaskulären Mortalität von 70–80 % assoziiert, Patienten mit Typ-2-Diabetes an der Hämodialyse die Ausnahme und Krebserkrankungen in diesem Kollektiv ohnehin kein Thema.
Pathogenese und Therapie des Autoimmundiabetes
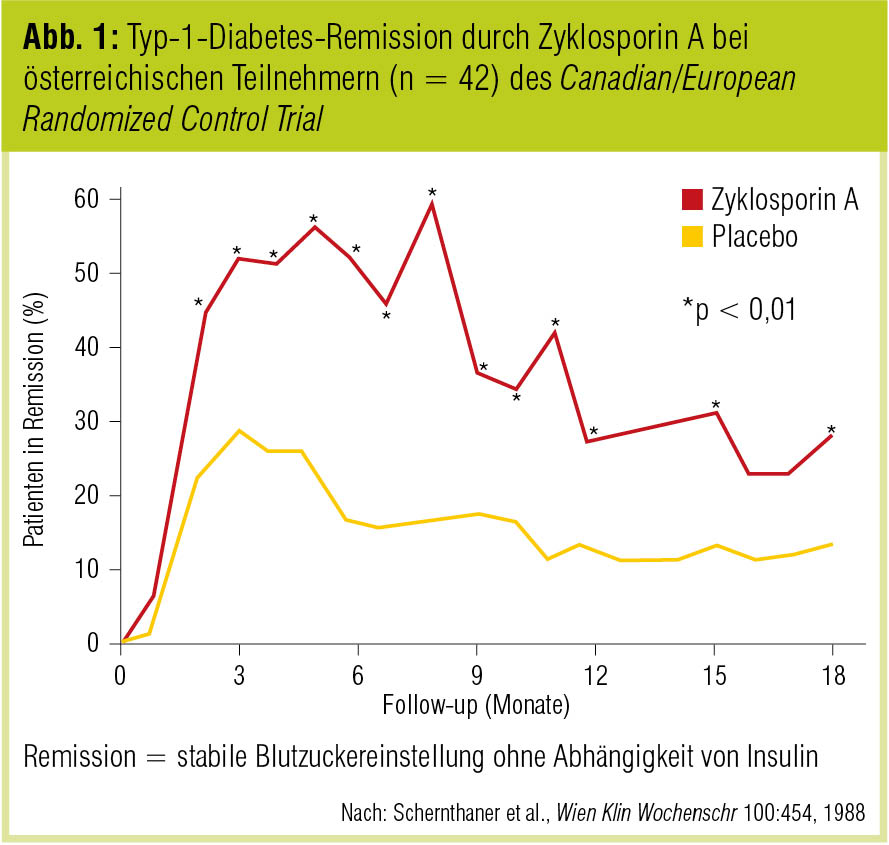
Nachdem verschiedene Arbeitsgruppen die Assoziation des Typ-1-Diabetes mit Antigenen des HLA-Gen-Komplexes (B8, B15, Cw3, Dw3, Dw4, DRw3, DRw4) beschrieben hatten (z. B. Nerup et al., Lancet 1974; Cudworth et al., Diabetes 1975; Schernthaner et al., Horm Metab Res 1975; Schernthaner et al., Lancet 1977), organisierten H. Kolb, G. Schernthaner und F. A. Gries im April 1982 das erste internationale Meeting zur Pathogenese und Therapie des Autoimmundiabetes, um die bis dahin gesammelten Erkenntnisse zusammenzuführen und die weiteren Forschungsschwerpunkte zu skizzieren (Kolb et al., Diabetologia 1983). Studien mit Zyklosporin A bei frisch manifestiertem Typ-1-Diabetes (Canadian/European Randomized Control Trial Group, Diabetes 1988; Schernthaner et al., Wien Klin Wochenschr 1988; Abb. 1) lieferten in der Folge den formalen Nachweis, dass Typ-1-Diabetes eine immunmediierte Erkrankung ist, deren Verlauf durch die Modulation des Immunsystems verzögert werden kann, wenngleich sich die Hoffnungen, durch zeitlich begrenzte Immunsuppression die Autoimmunität längerfristig kontrollieren zu können, nicht erfüllt haben (Martin et al., Diabetologia 1991).
Eine nachhaltige Wiederherstellung der endogenen Insulinsekretionsfähigkeit nach länger bestehendem Typ-1-Diabetes ist auch heute noch nicht abzusehen, allerdings wurden im Bereich der Primär- und der Sekundärprävention (nach Auftreten von Autoimmunantikörpern) u. a. mit Anti-CD3/CD20-Antikörpern, rekombinantem GAD-Antigen oder dem Hsp60-Derivat DiaPep277) zuletzt bemerkenswerte Fortschritte erzielt (Skyler & Ricordi, Diabetes 2011; Pozilli & Strollo, Immunotherapy 2012).
Kardiovaskuläre Prognose von Diabetespatienten
Nach Daten der Framingham-Studie (Preis et al., Circulation 2009) lag die kardiovaskuläre Mortalität bei Diabetespatienten in den USA im Zeitraum 1976–2001 um 69 % und die Gesamtmortalität um 40 % niedriger als in der Vergleichsperiode 1950–1975. Basierend auf Umfragedaten des National Health Interview Survey ging die Übersterblichkeit infolge Diabetes alleine zwischen 1997 und 2006 um 60 % (kardiovaskulär) bzw. 44 % (gesamt) zurück (Gregg et al., Diabetes Care 2012).
Das nationale dänische Diabetesregister weist für den Zeitraum 1990–2006 einen Rückgang der Mortalität bei Diabetikern um 4 % aus, im Vergleich zu 2 % in der nichtdiabetischen Bevölkerung; in den ersten drei Jahren nach Einschluss in das Register war die Mortalität sogar um 40 % reduziert (Carstensen et al., Diabetologia 2012). In Übereinstimmung damit zeigt eine britische Populationsstudie mit fast 50.000 Patienten, bei denen zwischen 1996 und 2006 Typ-2-Diabetes neu diagnostiziert wurde, einen Rückgang der Gesamtmortalität um 47 % (Männer) bzw. 26 % (Frauen) innerhalb von zwei Jahren nach Diabetesdiagnose. Damit war die relative Mortalität der Patienten, die 2006 neu diagnostiziert wurden, um 37 % geringer als bei jenen, die zehn Jahre zuvor diagnostiziert wurden (Charlton et al., Diabetes Care 2008).
Rückgang mikrovaskulärer Komplikationen
Noch markanter erscheint die Abnahme der diabetischen Nierenerkrankung: In den USA hat die altersadjustierte Rate der Diabetespatienten mit terminaler Nierenerkrankung (ESRD) seit Beginn der 1990er-Jahre sukzessive abgenommen (Burrows et al., Diabetes Care 2010), bezogen auf die Zahl der jährlichen Neudiagnosen von Typ-2-Diabetes allein von 1996 bis 2007 um 35 % (Williams, Semin Dial 2010). Einen nahezu identen Rückgang (33 %) der Typ-2-Diabetiker mit inzidenter Dialysepflichtigkeit (wiederum bezogen auf die Diabetesneuerkrankungen) zeigt das Österreichische Dialyse- und Transplantationsregister (ÖDTR) für den Zeitraum 2004–2010. Besonders erfreulich ist die Entwicklung bei Typ-1-Diabetes: In der DCCT/EDIC-Studie lag die ESRD-Inzidenz nach 22 Jahren bei 0,5–1,1 Fällen pro 1.000 Patienten und Jahr (DCCT/EDIC Research Group, N Engl J Med 2011), in einer populationsbasierten Kohortenstudie aus Schweden nach median 20 Jahren bei 1,1 % und nach 30 Jahren bei 2,5–4 % (Möllsten et al., Diabetes 2010). Typ-1-Diabetes verliert als Zuweisungsgrund zur Nierenersatztherapie damit zunehmend an Bedeutung.
Der Vergleich von 35 Studien bei Patienten mit Typ-2-Diabetes, die vor bzw. nach 2000 publiziert wurden, zeigt eine Abnahme schwerwiegender Augenerkrankungen im Ausmaß von 50–67 %, die Gesamthäufigkeit der diabetischen Retinopathie war um 50 % reduziert. Bei Patienten mit HbA1c-Werten < 7 % lag der Anteil mit proliferativer diabetischer Retinopathie oder Makulaödem bei 3 % bzw. 4 % (Yau et al., Diabetes Care 2012).
Schließlich konnte auch das Risiko für Fußamputationen bei Diabetikern deutlich gesenkt werden: Aus den USA berichten Li et al. (Diabetes Care 2012) über einen altersadjustierten Rückgang der Amputationsraten zwischen 1996 und 2008 um 67 %. Nach Angaben der US Veteran Health Administration sank die Rate der Fußamputationen zwischen 2000 und 2004 um 34 %, jene von Amputationen oberhalb des Knies um 49 % (Tseng et al., Diabetes Care 2011).
Residualrisiko und Stellenwert der Blutzuckerkontrolle
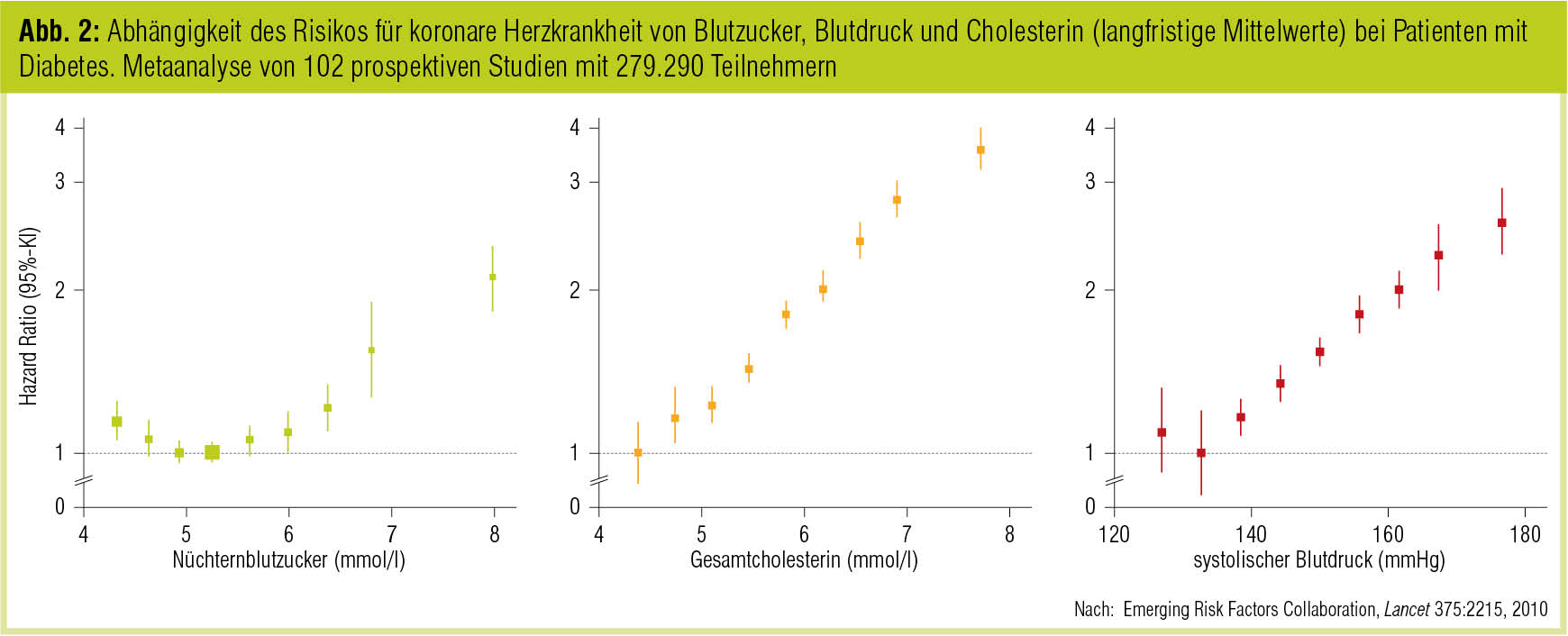
Trotz der beschriebenen Fortschritte haben Diabetespatienten unabhängig von anderen Einflussfaktoren nach wie vor ein rund doppelt so hohes Risiko für makrovaskuläre Komplikationen wie Nichtdiabetiker (Emerging Risk Factors Collaboration, Lancet 2010), was allerdings auch daran liegt, dass viele Patienten die etablierten Zielwerte für Blutzucker, Blutdruck und LDL-Cholesterin nicht einhalten können (Kotseva et al., Lancet 2009). Die Auswertungen der Emerging Risk Factors Collaboration (Lancet 2010) belegen für jeden dieser Parameter eine klare Abhängigkeit des Risikos für kardiovaskuläre Erkrankungen, wobei sich im Fall des Blutzuckers der auch in anderem Zusammenhang beschriebene (Currie et al., Lancet 2010) J-förmige Kurvenverlauf zeigt (Abb. 2).
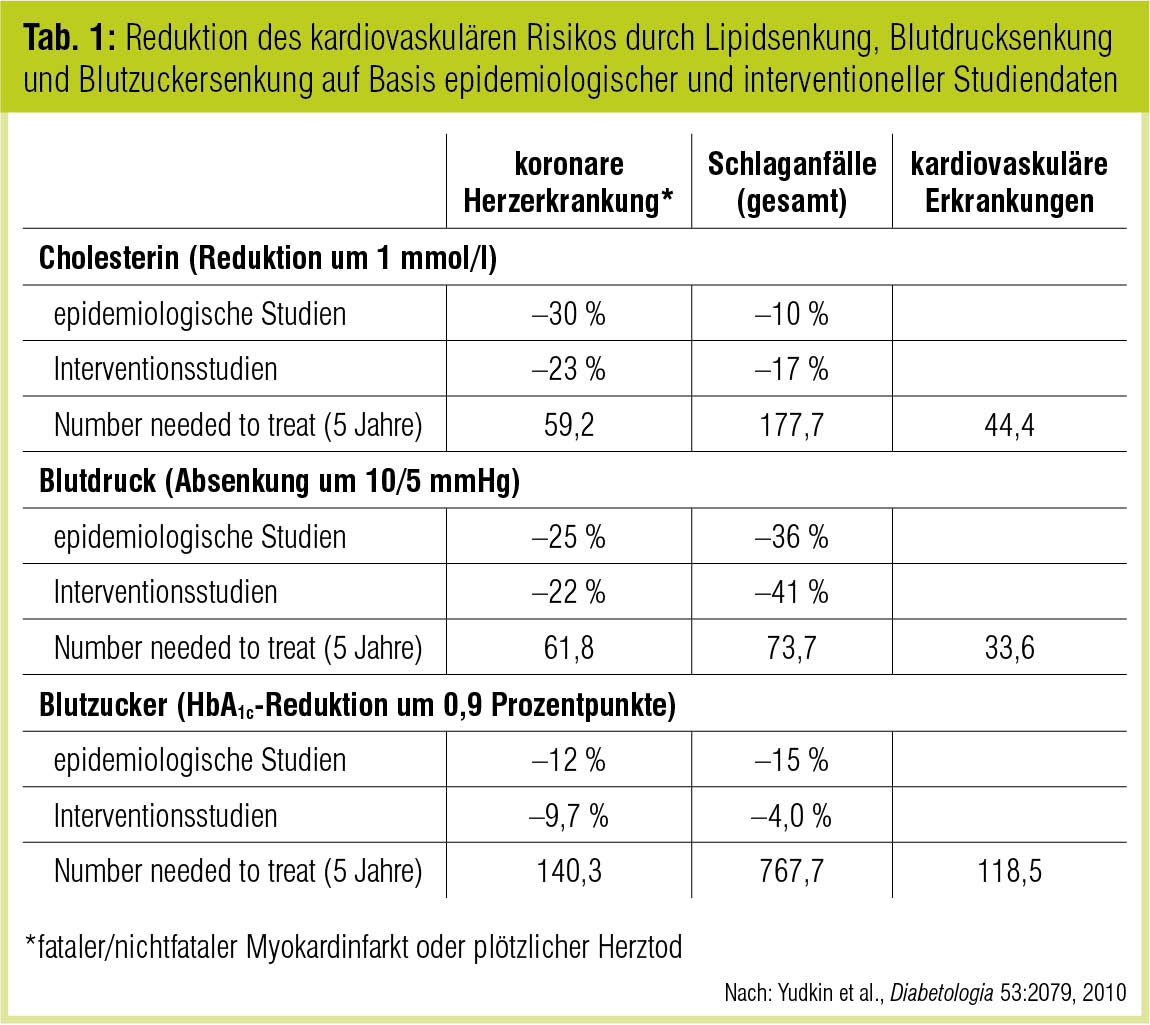
Yudkin et al. (Diabetologia 2010) haben darauf hingewiesen, dass bei Patienten mit Typ-2-Diabetes durch pharmakologische Absenkung des LDL-Cholesterins (um 1 mmol/l) bzw. des Blutdruck (um 10/5 mmHg) deutlich mehr kardiovaskuläre Ereignisse verhindert werden können als durch die HbA1c-Reduktion um 0,9 Prozentpunkte (wie in der UKPDS; Tab. 1). Für die Blutzuckerkontrolle im Rahmen eines multifaktoriellen Risikomanagements sprechen allerdings nicht nur die unbestreitbaren mikrovaskulären Benefits (Schernthaner et al., Nephrol Dial Transplant 2010; Hemmingsen et al., Cochrane Database Syst Rev 2011; Yau et al., Diabetes Care 2012), sondern auch die eindeutige epidemiologische Evidenz dafür, dass eine chronisch schlechte Diabeteseinstellung vermehrte makrovaskuläre Komplikationen zur Folge hat. Wie die Langzeitbeobachtung finnischer Diabetespatienten illustriert, gilt dies bei Typ-1-Diabetes noch in ungleich größerem Maß als bei Typ-2-Diabetes (Juutilainen et al., Diabetes Care 2008).
Von der UKPDS zu ACCORD, ADVANCE und VADT
Die 1977 begonnene und ab 1983 publizierte UKPDS gilt nach wie vor als Schlüsselreferenz für den Typ-2-Diabetes. Allerdings wird die Studie angesichts der inkludierten Patienten (frisch manifestierter Typ-2-Diabetes, Body Mass Index [BMI] 27,5 kg/m2), der Therapiemodalitäten und der Hintergrundmedikation den heutigen Herausforderungen kaum noch gerecht. Spätere Outcome-Studien (PROactive, ACCORD, ADVANCE, VADT) inkludierten Kollektive mit sukzessive längerer Diabetesdauer, höheren Ausgangswerten für HbA1c und BMI sowie vermehrten kardiovaskulären Vorerkrankungen; gleichzeitig kamen neuere, zum Teil auch mehr Antidiabetika sowie moderne Hypertensiva und Lipidsenker zum Einsatz (Schernthaner, Wien Med Wochenschr 2010).
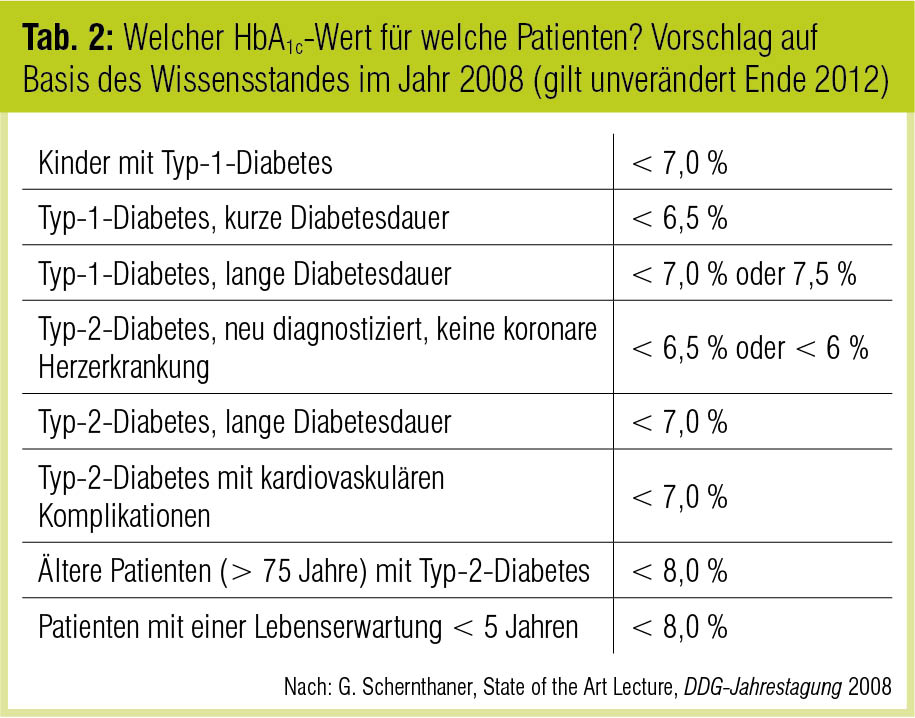
Die Erwartung, eine hinreichend intensive Diabetestherapie könne auch makrovaskuläre Komplikationen in relevantem Ausmaß reduzieren, haben diese Studien pauschal nicht bestätigt, allerdings lagen die HbA1c-Unterschiede zwischen den Behandlungsgruppen nach Studienende nur in ACCORD (1,1 Prozentpunkte) und VADT (1,5 Prozentpunkte) über den 0,9 Prozentpunkten der UKPDS. Die Studien haben vielmehr aufgezeigt, dass Nutzen und Risiken der intensivierten Diabetestherapie abhängig von Alter, Diabetesdauer und vorbestehenden Gefäßerkrankungen (Tab. 2) und wahrscheinlich auch abhängig von der Inzidenz schwerer Hypoglykämien differenziert zu betrachten sind (Skyler et al., J Am Coll Cardiol 2009; Schernthaner, Wien Med Wochenschr 2010).
An dieser Position, die heute von den meisten diabetologischen Fachgesellschaften (Inzucchi et al., Diabetologia 2012; Clodi et al., Wien Klin Wochenschr 2012) vertreten wird, haben auch die Ergebnisse der ORIGIN-Studie nichts geändert, die bei Patienten mit vergleichsweise kurzer Typ-2-Diabetesdauer, aber hohem kardiovaskulären Risiko keinen Outcome-Vorteil einer intensivierten Blutzuckersenkung mit Basalinsulin im Vergleich zu einer oralen Standardtherapie fand (ORIGIN Trial Investigators, N Engl J Med 2012).
Neue (alte) Ziele in der Blutdrucktherapie
Auch in der Blutdrucktherapie haben rezente Analysen deutlich gemacht, dass die Gesetzmäßigkeit des „the lower, the better“, wie sie die Ergebnisse der MRFIT-Studie noch nahelegten (Stamler et al., Diabetes Care 1993), nicht uneingeschränkt gilt. Nach den Metaanalysen von Bangalore et al. (Circulation 2011) und Reboldi et al. (J Hypertens 2011) ist davon auszugehen, dass ein Zielblutdruck von 140/90 mmHg für die meisten Patienten mit Typ-2-Diabetes adäquat sein sollte. Durch eine strengere Einstellung (< 130/80 mmHg) lassen sich zwar Schlaganfälle und renale Komplikationen weiter reduzieren, allerdings steigt, insbesondere bei Werten von < 120 mmHg systolisch, das Risiko für schwerwiegende kardiale Komplikationen (Sleight et al., J Hypertens 2009; Cooper-deHoff et al., JAMA 2010). Die antihypertensive Medikation sollte im Regelfall einen ACE-Hemmer oder Angiotensinrezeptorblocker, kombiniert mit einem Kalziumkanalblocker und/oder Thiaziddiuretikum enthalten, die duale Blockade des Renin-Angiotensin-Aldosteron-Systems hingegen vermieden werden.
Insgesamt gilt, dass die Blutdruckkontrolle – ähnlich wie die antihyperglykämische Therapie – abhängig von Alter, Pulsdruck, kardiovaskulärem Morbiditätsstatus und Vorliegen bzw. Progressionsrisiko von Nephropathie und Retinopathie individualisiert erfolgen sollte (KDIGO Blood Pressure Work Group, Kidney Int Suppl 2012; Schernthaner et al., Wien Klin Wochenschr 2012).
Bariatrische Chirurgie und „obesity paradox“
Lebensstilmaßnahmen zur Gewichtskontrolle bilden eine zentrale, aber meist schwierig umzusetzende Komponente der Diabetestherapie. Der Nutzen im Hinblick auf die Prävention des Typ-2-Diabetes und auf metabolische Parameter ist unbestritten (Tuomilehto et al., N Engl J Med 2001; Hamman et al., Diabetes Care 2006; Wing et al., Diabetes Care 2011), allerdings war bisher – zuletzt in der LOOK-AHEAD-Studie – nicht schlüssig nachzuweisen, dass durch die Gewichtsintervention kardiovaskuläre Endpunkte verhindert werden können.
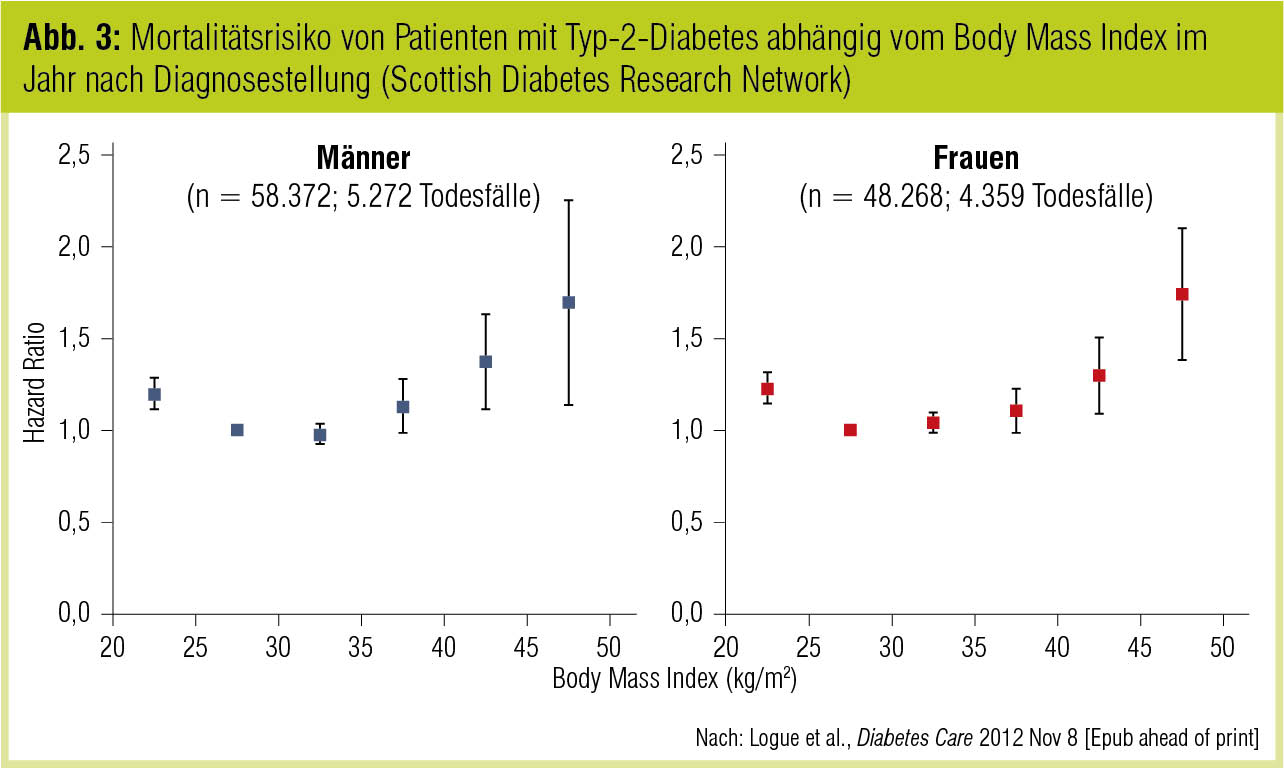
In der jüngsten Version der Konsensusempfehlungen der American Diabetes Association und der European Association for the Study of Diabetes (Inzucchi et al., Diabetologia 2012) werden Gewichtseffekte als ein relevantes Kriterium der individualisierten Therapiewahl angeführt (nach Effektivität und Hypoglykämierisiko). Die Evidenz dafür, dass niedrigeres Körpergewicht die kardiovaskuläre Prognose bei Patienten mit manifestem Typ-2-Diabetes verbessert, ist allerdings inkonklusiv. Auf der einen Seite zeigen rezente Ergebnisse der SOS-Studie (Sjöström et al., JAMA 2012), dass eine chirurgisch erreichte Gewichtsreduktion bei schwer adipösen Patienten langfristig die kardiovaskulären Ereignisraten drastisch reduzieren kann. Auf der anderen Seite stehen epidemiologische Ergebnisse der Scottish Diabetes Research Network Epidemiology Group, wonach Patienten mit Typ-2-Diabetes, die im Jahr nach Diagnosestellung einen BMI von 30 kg/m2 hatten, unabhängig von HbA1c, Jahr der Diagnose, Lipidstatus, Blutdruck oder sozioökonomischem Status das geringste Mortalitätsrisiko trugen (Abb. 3); dabei waren neben respiratorischen und malignen Erkrankungen auch kardiovaskuläre Todesursachen signifikant reduziert (Logue et al., Diabetes Care 2012, in press). In die gleiche Richtung weist eine Analyse von 5 Kohortenstudien mit insgesamt mehr als 27.000 Teilnehmern, in der Typ-2-Diabetiker, die bei Diagnosestellung normalgewichtig waren, ein höheres Mortalitätsrisiko hatten als Personen, die zu diesem Zeitpunkt übergewichtig oder adipös waren (Carnethon et al., JAMA 2012).
Die physiologischen Grundlagen dieses „obesity paradox“ sind erst teilweise aufgeklärt, könnten aber – wie schon beim Blutzucker und beim Blutdruck – einmal mehr einen Paradigmenwechsel in Richtung einer differenzierteren Bewertung der individuellen Risikokonstellation einleiten (Florez & Castillo-Florez, JAMA 2012; Coutinho et al., J Am Coll Cardiol 2013).