Typ-2-Diabetes: Vom Einfluss der Gene zum Rhythmus der Nahrungsaufnahme
Die Grundlagenforschung hat in den vergangenen Jahren viele Erkenntnisse gebracht, welche die Prävention und die Therapie des Typ-2-Diabetes beeinflussen könnten. So wurden unter anderem neue mögliche Erklärungen und potenzielle prädiktive Marker des Betazellversagens, aber auch Hinweise für die Optimierung der Diät zur Vermeidung von Adipositas gefunden und beschrieben.
Genomics: Neues zur Relevanz der Gene
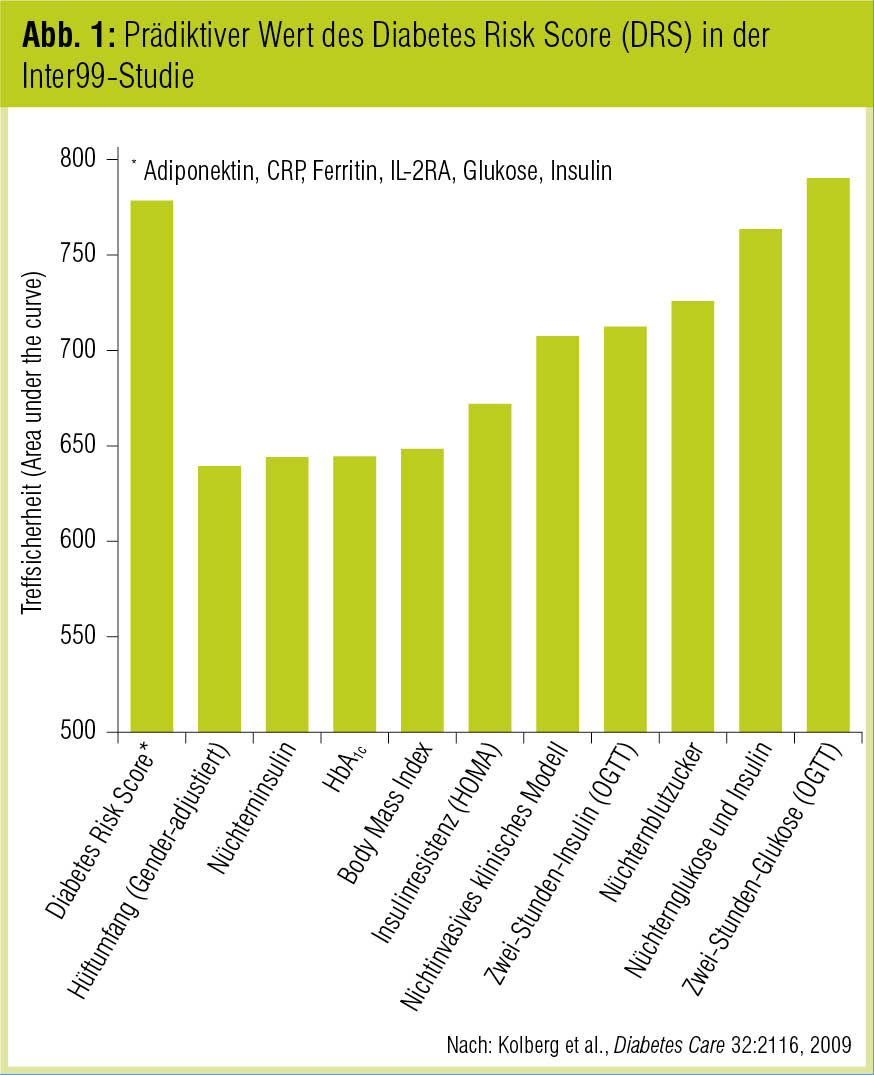
Vor zwei Jahren kannte man erst 25 Gene, die in hohem Maß mit dem Auftreten von Diabetes assoziiert sind, seither hat die Zahl deutlich zugenommen. Über den prädiktiven Wert der bekannten Risikofaktoren Alter, Geschlecht und Body-Mass-Index (Kolberg et al., Diabetes Care 2009; Abb. 1) hinaus tragen Diabetessuszeptibilitätsgene jedoch nach wie vor enttäuschend wenig zur Abschätzung des Diabetesrisikos bei (Herder & Roden, Eur J Clin Invest 2011).
Diese Erkenntnis wird durch neue Metaanalysen bestätigt: Durch den Vergleich der Daten von 34.840 Diabetespatienten mit 114.981 nichtdiabetischen Kontrollpersonen (überwiegend aus Europa) wurden 8 neue Suszeptibilitätsgene des Typ-2-Diabetes identifiziert, womit sich deren Zahl auf insgesamt 63 erhöht hat (Morris et al., Nat Genet 2012). Bei einer Prävalenz des Typ-2-Diabetes von 8 % erklären diese 63 autosomalen Genorte aber nach wie vor nur 5,7 % der Varianz des Typ-2-Diabetes-Risikos.
Interessant ist aber auch, dass viele der Genorte mit der Insulinsekretion assoziiert sind, einige aber in keinem Zusammenhang mit der Betazellfunktion zu stehen scheinen. Beispielsweise ergab eine weitere Analyse des Datenpools hinsichtlich der Transkripte von Single-Nucleotide-Polymorphismen (SNP) eine Verbindung zwischen Diabetessuszeptibilitätsgenen und Proteinen, die an der Transkription von Adipokinen und an der Regulation des Zellzyklus beteiligt sind. Diese diabetesassoziierten Gene beeinflussen demnach auch die Funktion anderer Zellen als der Betazellen (Morris et al., Nat Genet 2012).
Metabolomics: Metabolitenmuster bestimmt das Diabetesrisiko
Im Bereich der metabolischen Biomarker wurden im vergangenen Jahr ebenfalls einige neue Prädiktoren identifiziert, die eine frühzeitigere Abschätzung des Diabetesrisikos erlauben könnten, darunter Fettsäuremetaboliten und Aminosäuren, die mit bekannten Diabetesgenen in Verbindung stehen (Floegel et al., Diabetes 2013; Wang-Sattler et al., Mol Syst Biol 2012). Ein solcher Metabolit, Azetylkarnitin, ist ein Folgeprodukt der inkompletten Fettoxidation, der eine Rolle bei der Entstehung der Insulinresistenz zugeschrieben wird.
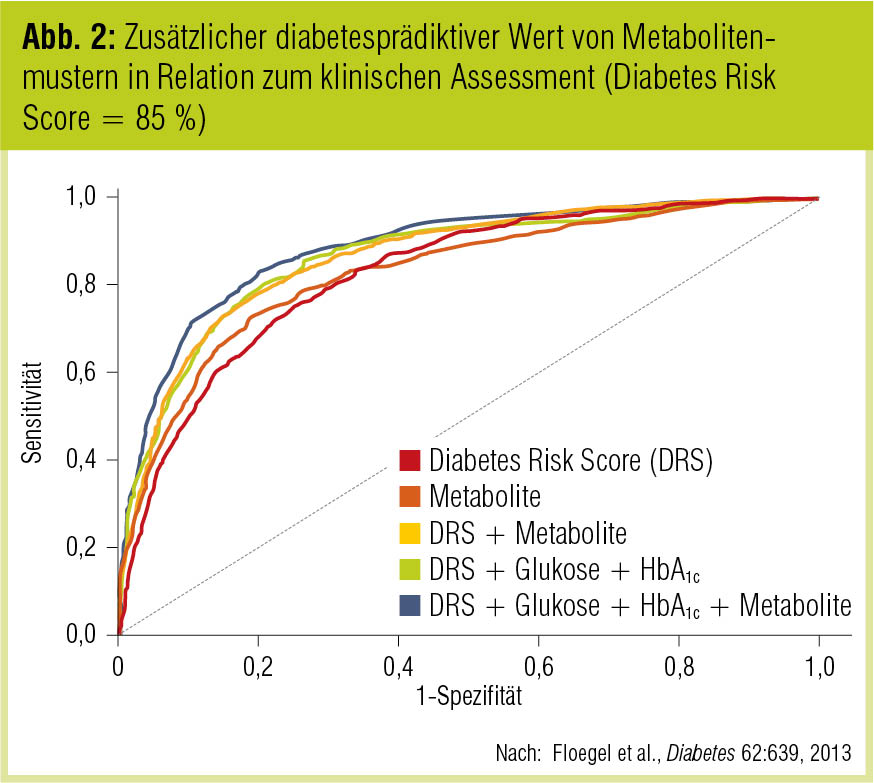
Anhand des Metabolitenmusters kann das Diabetesrisiko derzeit ähnlich gut abgeschätzt werden wie mit dem auf klinischen Faktoren beruhenden deutschen Diabetes-Risiko-Score (DRS; Abb. 1). In der von Floegel et al. (Diabetes 2013) analysierten Population – 27.548 erwachsene Teilnehmer der European Prospective Investigation into Cancer and Nutrition (EPIC) Potsdam Study – konnte das Diabetesrisiko zu 85 % vorhergesagt werden (Abb. 2). Dieses Ergebnis muss allerdings noch in anderen Populationen bestätigt werden.
Metagenomics: die Rolle des Mikrobioms
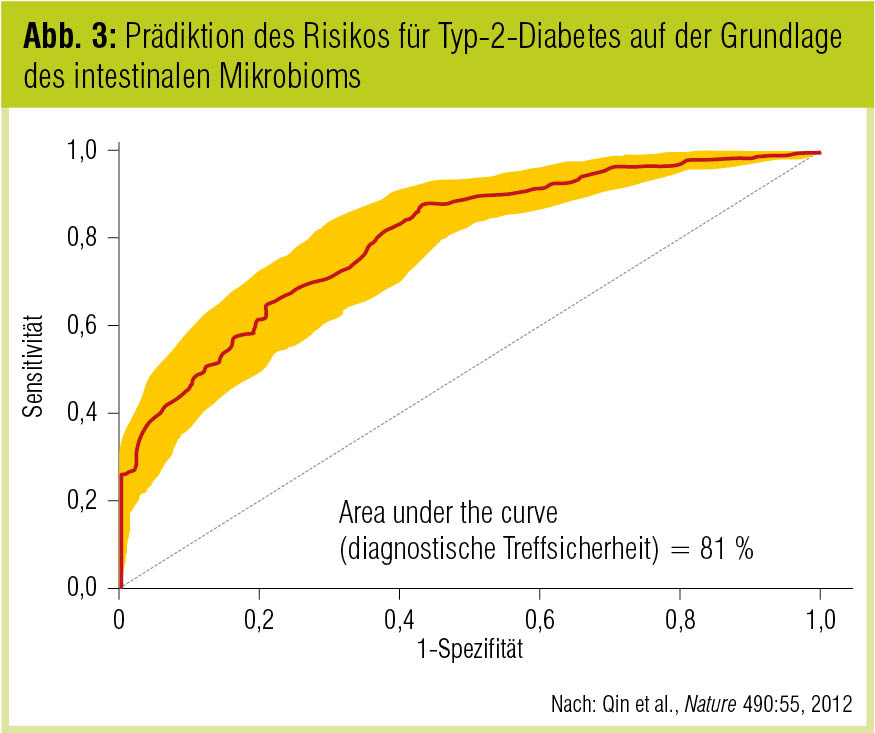
Auch zum Konnex zwischen Darmflora und Stoffwechsellage gibt es neue Erkenntnisse. Qin et al. (Nature 2012) führten in einem chinesischen Kollektiv (n = 345) eine „metagenomweite Assoziationsstudie“ durch und bei Personen mit Typ-2-Diabetes ein von der physiologischen Darmflora abweichendes intestinales Mikrobiom im Sinne einer moderaten funktionellen Dysbiose; diese war gekennzeichnet durch einen geringeren Anteil butyratproduzierender Bakterien und mehr opportunistische Keime – darunter solche, die den oxidativen Stress erhöhen. Der daraus abgeleitete Mikrobiota-Risikoindex für Typ-2-Diabetes hatte bei der Analyse von 23 weiteren Individuen eine diagnostische Treffsicherheit von 81 % (Abb. 3).
Eine Studie, für die Schwangere und deren Kinder untersucht wurden, zeigt, dass sich das Mikrobiom bei Frauen mit Gestationsdiabetes im Laufe der Schwangerschaft verändert und in dieser Form von der Mutter auf den Fötus übergeht (Koren et al., Cell 2012). Erst vier Jahre nach der Geburt etablierte sich bei den Kindern ein physiologisches Mikrobiom. In weiteren Untersuchungen derselben Gruppe wurde Stuhl von Frauen mit Gestationsdiabetes auf Mäuse übertragen. Diese entwickelten Adipositas und Insulinresistenz, und es kam zu einem Anstieg der Inflammationsmarker.
Einen Therapieansatz, der diese Erkenntnisse untermauert, verfolgten Vrieze et al. (Gastroenterology 2012). Sie infundierten Männern mit metabolischem Syndrom duodenal entweder eigene aufbereitete Fäzes oder aber Fäzes von schlanken Männern im Sinne einer allogenen Infusion. Bei jenen Probanden, die eine allogene Fäzesinfusion erhalten hatten, kam es zu einem signifikanten Anstieg der Insulinsensitivität und zu einer höheren Mikrobiomdiversität, außerdem nahm der Anteil der butyratproduzierenden Bakterien zu und die Ausscheidung kurzkettiger Fettsäuren sank – ein weiterer Beleg dafür, dass das mikrobielle Gleichgewicht im Magen-Darm-Trakt für die Gesundheit von entscheidender Bedeutung sein kann.
Interaktion zwischen Muskel und Stoffwechsel
Verschiedene rezente Publikationen widmeten sich dem Zusammenspiel zwischen Muskulatur, Fettstoffwechsel und Insulinresistenz. Der für den Energiestoffwechsel wichtige PPAR-γ-abhängige Kofaktor 1-α; (PGC1-α) wird durch verschiedene Faktoren aktiviert, deren Spiegel bei körperlicher Aktivität erhöht sind, darunter PPAR-δ und AMP-aktivierte Proteinkinase (AMPK). PGC1-α aktiviert Respirationsfaktoren im Genom, welche die Verbrennung in den Mitochondrien ankurbeln.
Boström et al. (Nature 2012) fanden, dass das Fettgewebe von Tieren mit muskulärer PGC1-α-Überexprimierung vermehrt Eigenschaften von braunem Fettgewebe aufweist. Wurde PGC1-α auf undifferenzierte Fettzellen aufgebracht, so differenzierten diese zu braunen Fettzellen. In den Muskelzellen wird bei körperlicher Aktivität das Membranprotein FNDC5 hinaufreguliert. Dieses löst bei Übertragung auf undifferenzierte Fettzellen die Transformation in braunes Fett aus – vorausgesetzt, die extrazelluläre Domäne von FNDC5 wird nach dem Transport zur Zellmembran proteolytisch aktiviert; das Spaltprodukt erhielt den Namen Irisin. Eine Überexprimierung des «Myokins“ verbessert die Glukosetoleranz, erhöht den Sauerstoffverbrauch und verringert die Gewichtszunahme (Boström et al., Nature 2012). Stärkster Prädiktor für die Irisinkonzentration beim Menschen ist der Bizepsumfang; die Korrelation mit Ghrelin oder Adiponektin scheint hingegen nicht sehr ausgeprägt zu sein (Huh et al., Metabolism 2012). Möglicherweise gibt es neben einer Insulinresistenz aber auch eine Irisinresistenz.
Freie Fettsäuren und Insulinresistenz
Seit Längerem weiß man, dass das Hepatokin Fetuin-A die Insulinwirkung beeinträchtigt und die subklinische Inflammation begünstigt. Erhöhte Fetuin-A-Spiegel beeinträchtigen das Ansprechen auf Lebensstilmaßnahmen und gehen mit einem erhöhten Risiko für kardiovaskuläre Komplikationen einher (Stefan et al., Diabetes Care 2006). Demgegenüber lenkt eine Arbeit von Pal et al. (Nat Med 2012) das Interesse auf Fetuin-A als mögliches Therapeutikum bei Insulinresistenz und Typ-2-Diabetes. Demnach ist Fetuin-A das Bindeglied zwischen freien Fettsäuren und dem Toll-like receptor 4 (TLR4), der eine Schlüsselrolle bei der Aktivierung inflammatorischer Pathways spielt, die zur Insulinresistenz führen. Es wurde gezeigt, dass freie Fettsäuren die Expression proinflammatorischer Zytokine in Fettzellen nur in Anwesenheit sowohl von Fetuin-A als auch von TLR4 induzieren. Wurde einer der beiden Faktoren entfernt, konnte die durch freie Fettsäuren induzierte Insulinresistenz verhindert werden – damit wäre Fetuin-A das „missing link“ zwischen fettreicher Diät und Insulinresistenz. Neben Fetuin-A könnten in Zukunft auch die Lipidsensoren Vascular endothelial growth factor B (VEGF-B; aktiviert den endothelialen Transport freier Fettsäuren und die fördert die Insulinresistenz) und G-protein coupled receptor (GPR120; Rezeptor für ungesättigte freie Fettsäuren) als Targets für die Prävention und Therapie von Adipositas und Typ-2-Diabetes genutzt werden.
Antientzündliche Therapie wirkt auf AMPK
Bereits seit einigen Jahren ist bekannt, dass Salizylate das HbA1c in geringem Maß senken können, wenn auch nicht ausreichend, um dieses Prinzip therapeutisch zu nutzen (vergleiche den Beitrag “Chronische Inflammation: Angriffspunkte der therapeutischen Intervention”, DIABETES FORUM 1/2013). Nun weiß man, dass dieser Effekt von Salizylat auf der Aktivierung der AMPK durch Threonin-172-Phosphorylierung beruht (Hawley et al., Science 2012). Dies unterstreicht die Bedeutung von AMPK als Therapietarget.
Insulindefizienz durch Entdifferenzierung der Betazellen
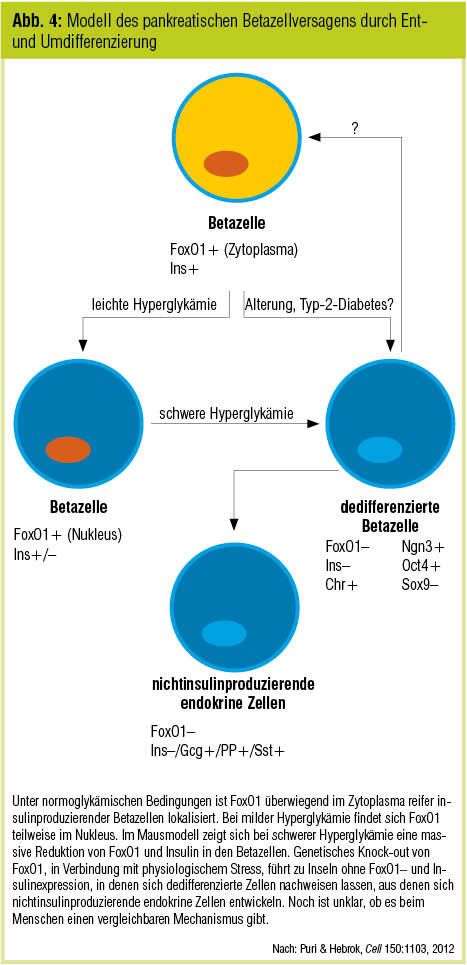
Eine Dysbalance zwischen Selbsterneuerung und Apoptose der Betazellen wurde bisher als eine Ursache für die dem Typ-2-Diabetes zugrunde liegende Betazelldysfunktion vermutet (Puri & Hebrok, Cell 2012; Abb. 4). Folgt man dem Ergebnis einer Studie von Talchai et al. (Cell 2012), so könnte diese Annahme ein Irrtum sein. Demnach entwickeln FoxO1-defiziente Mäuse (FoxO1 greift unter anderem in das „insulin signaling“ ein und fungiert als negatives Regulatorgen der Adipogenese) als Reaktion auf physiologischen Stress (Trächtigkeit, Altern) eine Hyperglykämie mit reduzierter Betazellmasse. Nach den Analysen spielte die Rückbildung von Betazellen zu undifferenzierten Zellen eine wesentlich wichtigere Rolle für das Betazellversagen als die Apoptose. Eine Wiederherstellung der Betazellfunktion sollte demnach eher auf die Restitution der Betazelldifferenzierung abzielen als auf die Vermehrung der Betazellmasse.
Optimale Ernährung im Tiermodell
Ebenfalls aus Tierexperimenten kommen neue Belege dafür, dass nicht nur die über die Nahrung zugeführte Kalorienmenge, sondern auch das Timing der Nahrungsaufnahme den Stoffwechsel und damit die Gewichtszunahme wesentlich beeinflusst. Bei gleicher Kalorienaufnahme aus fettreicher Diät nahmen Mäuse, die nur während 8 Stunden pro Tag fressen durften, weniger an Gewicht zu als Mäuse, denen die Futteraufnahme zu jeder Tages- und Nachtzeit möglich war (Hatori et al., Cell Metab 2012). Ein Grund dafür dürfte darin liegen, dass bei den zeitlich nicht fresslimitierten Mäusen der Tag-Nacht-Rhythmus nahezu aufgehoben war. Umgekehrt begrenzte die zeitliche Beschränkung der Nahrungsaufnahme die Phasen mit erhöhten Insulinspiegeln, wirkte Übergewicht, Apoptose und Inflammation entgegen und verbesserte die Funktion verschiedener metabolischer Regelkreise (darunter die CREB-, mTOR- und AMPK-Pathways). Den Zeitraum der Nahrungsaufnahme zu beschränken scheint demnach sinnvoll.
Eine aktuelle Studie von Mattison et al. (Nature 2012) wiederum lässt Zweifel am Nutzen einer Kalorienrestriktion aufkommen. So brachte eine frühzeitige Kalorienreduktion im Affenmodell keine oder nur geringe Vorteile für die Gesundheit. Allerdings könnte die fehlende statistische Signifikanz auch auf eine zu geringe Fallzahl zurückzuführen sein.