Zielgerichtete neue Therapien, Therapie von Lebermetastasen, Empfehlungen der European Neuroendocrine Tumor Society (ENETS) – Gastroenteropankreatische neuroendokrine Tumoren
Diagnose, Histologie
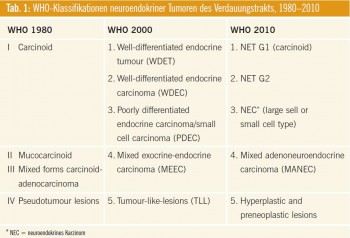
Am Anfang steht die Diagnose und damit die Histologie. Auch hier gab es kürzlich Änderungen, vor allem in der Nomenklatur (Tab. 1). Histologisch werden neuroendokrine Tumoren – mit Ausnahme der Lungen-NET – in hochdifferenzierte Tumoren (G1 und G2) und wenig differentierte Karzimome (G3) eingeteilt.
Die Diagnose beinhaltet neben der Morphologie der Zellen mit Angabe des Gradings nun auch die Angabe des Proliferationsindex (angegeben in Mitosen pro HPF oder Ki-67 in %), da dies für die Wahl der Therapie und auch für die Abschätzung der Prognose unerlässlich ist (Tab. 2). Weitere prognostische Faktoren sind das Alter, das Stadium und die Primärtumorlokalisation. Auch die Höhe des Chromogranins A und B wurde als prognostischer Faktor vorgestellt (K. Jensen, Kopenhagen; P. Bech, London).
GEP-NET
In Analogie zum ENETS-Meeting bezieht sich die nachfolgende Darstellung auf hochdifferenzierte neuroendokrine Tumoren des gastroenteropankreatischen Trakts (GEP-NET).
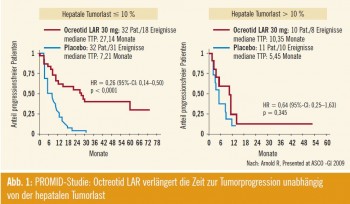
PROMID-Studie, Octreotid LAR: Nicht mehr brandaktuell, jedoch zur Vollständigkeit der Angabe randomisierter Studiendaten wurden die Ergebnisse der PROMID- Studie beleuchtet, die zur klaren Indikation bei symptomatischen Patienten auch die Empfehlung zur Therapie bei asymptomatischen Patienten anfügt. In diese Studie wurden 85 Patienten, die an einem hochdifferenzierten neuroendokrinen Tumor des Dünndarms litten, eingeschlossen und in Octreotid LAR 30 mg bzw. einen Placeboarm randomisiert. 40 % der Patienten litten an einem so genannten Karzinoid-Syndrom und wurden als „functioning“ gewertet. Die Aufteilung in die Placebo- bzw. Therapiegruppe wurde als gut balanciert gewertet, wenngleich die Zeit bis zum Studieneinschluss in der Behandlungsgruppe mit 7,5 Monaten doppelt so lang war wie in der Placebogruppe mit 3,3 Monaten. Weiters wurde der Progressionsstatus vor Therapiebeginn nicht evaluiert und somit in der Randomisierung nicht berücksichtigt. Es konnte eine Verlängerung des progressionsfreien Überlebens (PFS 14,3 vs. 6,0 Monate) gezeigt werden. Bei einer niedrigen hepatalen Tumorload, sprich Tumormassen von unter 10 %, konnte ein noch deutlicher Benefit im PFS gezeigt werden (Abb. 1).
Neue Daten zu Sunitinib: Weitere randomisierte, placebokontrollierte Daten liegen für neuroendokrine Tumoren des Pankreas vor. Zum einen wurden die kürzlich im New England Journal of Medicine publizierten Daten zu Sunitinib präsentiert: In diese Studie wurden 171 Patienten mit einem fortgeschrittenen neuroendokrinen Tumor des Pankreas und dokumentierter Progression innerhalb von 12 Monaten vor Therapiebeginn eingeschlossen. Es wurde 1 : 1 in einen Behandlungsarm mit Sunitinib 37,5 mg täglich kontinuierlich vs. einen Placeboarm und Best Supportive Care randomisiert. Es zeigte sich ein progressionsfreies Überleben von 11,4 vs. 5,5 und eine objektive Responsrate von 9,3 % vs. 0 % (Sunitinib vs. Placebo) bei einem akzeptablem Nebenwirkungsprofil.
RADIANT-3, Everolimus: Zum anderen wurden die Daten der RADIANT-3-Studie vorgestellt. Hier wurden ebenfalls Patienten mit hochdifferenzierten neuroendokrinen Tumoren des Pankreas mit dokumentierter Progression vor Studieneinschluss inkludiert. Es konnten insgesamt 410 Patienten 1 : 1 in einen Behandlungsarm mit Everolimus 10 mg täglich sowie einen Placeboarm randomisiert werden. Auch hier zeigte sich ein signifikant verlängertes PFS von 11,0 vs. 4,4 Monaten für den Behandlungsarm – jedoch bei einer hohen Rate an Grad-1/2- Toxizitäten. Es wurde aber eine niedrige Rate an schweren Nebenwirkungen beobachtet.
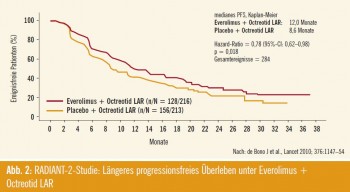
RADIANT-2, Octreotid LAR plus Everolimus: Eine weitere Neuvorstellung reihte sich zu den Ergebnissen der RADIANT- 2-Studie hinzu. Hier wurde eine heterogene Gruppe an Patienten mit neuroendokrinen Tumoren mit unterschiedlichsten Primärlokalisationen wie auch Differenzierungsgrad eingeschlossen. Insgesamt wurden 378 Patienten in die Arme Octreotid LAR plus Placebo sowie Octreotide LAR plus Everolimus randomisiert. Als Studienendpunkt wurde der Response der 5-Hydroxyindolessigsäure (5-HIES), gemessen im 24-Stunden- Harn, als Surrogatparameter des Karzinoidsyndroms sowie für das Auftreten einer „Carcinoid heart disease“ gewählt. Hier zeigte sich ein besserer Rückgang der 5-HIES in der Kombinationsgruppe, eine Signifikanz im radiolo – gischen Response konnte in der zentralen Befundauswertung nicht beobachtet werden, jedoch in der „Vor Ort“-Auswertung (Abb. 2).
Temozolomid und Capecitabin: Eine retrospektive Analyse von Strosberg wurde zur Kombination von Temozolomid und Capecitabin vorgestellt. Es wurden die Daten von 30 Patienten mit hochdifferenzierten neuroendokrinen Tumoren des Pankreas vorgestellt, welche mit Capecitabin (750 mg/m2 2-mal täglich an den Tagen 1–14) und Temozolomid (200 mg/m2 einmal täglich an den Tagen 10– 14), Wiederholung alle 28 Tage, als Erstlinientherapie behandelt wurden. Es konnte ein PFS von 18 Monaten dokumentiert werden mit einer objektiven Responserate von 70 %, jedoch wurden die radiologischen Responskriterien nicht offengelegt.
Therapie von Lebermetastasen
Eine weitere wichtige Option stellt die Therapie von Lebermetastasen dar, zumal die ablative Lebertherapie bei bekannten Lebermetastasen auch im Rahmen von radikalen Operationen außerhalb der Leber von der ENETS empfohlen wird.
Es gibt eine Reihe von lokoablativen Verfahren der Leber, welche wie folgt unter Einbeziehung mehrerer Literaturstellen angegeben wurden. Randomisierte Studien finden sich zu diesem Thema kaum.
Radiofrequenzablation: Mit dieser Methode konnten Komplettremissionsraten von bis zu 80 % erzielt werden. Für die Möglichkeit der Durchführung müssen verschiedene Kriterien erfüllt sein wie zum Beispiel: weniger als 6 Läsionen mit einer Größe unter 4 cm. Bei Läsionen zu nahe am Leberhilus oder an großen Gefäßen ist diese Technik kontraindiziert. Es wird eine Symptomkontrolle in 71 bis 95 % angegeben und ein PFS von 8 bis 10 Monaten erreicht.
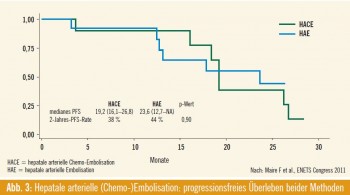
Hepatale arterielle (Chemo-)Embolisation: Es lassen sich mit beiden Methoden – der blanden Embolisation und der Chemoembolisierung – radiologische Responsraten von 32–82 % erzielen, bei einer Symptomkontrolle von rund 60 bis 95 %. Das PFS wird mit 18–24 Monaten angegeben (Abb. 3). Es finden sich beinahe schon historische Daten aus dem Jahr 2008, wo diese beiden Verfahren gegeneinander verglichen wurden, ohne dass sich ein signifikanter Unterschied nachweisen ließ. Die blande Embolisation ist aufgrund der benötigten Partikel die kostspieligere Variante.
Selektive interne Radiotherapie, SIRT: Eine weitere Möglichkeit der lokoablativen Therapie von Lebermetastasen bietet die SIRT, ein Verfahren, bei dem 90Yttrium- Partikel ebenfalls mittels Lebervenenkatheter eingebracht werden. Auch hier zeigt sich – bei ebenso dünner Datenlage – eine vergleichbare Responserate von 52–66 %.
Peptidrezeptorvermittelte Radiothe – rapie, PRRT: Eine zwar schon länger durchgeführte, jedoch nun mit verschiedenen Radiopharmakons mögliche, leider aber ebenso mit noch wenigen prospektiven Daten untermauerte Methode findet sich in der Anwendung einer PRRT, der Peptid-Radio-Rezeptor-Therapie. Hierbei gibt es Kombinationen von 90Yttrium oder 177Lutetium als Radiopharmakon mit Octreotid oder Octreotat als Peptid.
Vorgestellt wurden bisher unpublizierte Daten von Kwekkeboom. An diesem Zentrum wurden 279 Patienten mit 177Lutetium behandelt und retrospektiv analysiert. Bei dieser äußerst hetero – genen Patientengruppe mit Tumoren jeg licher Primärlokalisation und jeden Differenzierungsgrades zeigte sich eine Responsrate von 36 %, eine hohe Stabilisierungsrate mit einem OS von 51 Monaten. Das Ergebnis einer randomisierten Studie zwischen 177Lutetium PRRT und Octreotid wird mit Spannung für heuer erwartet.
Empfehlungen der ENETS
Abschließend die Zusammenfassung der Empfehlungen der ENETS, die für September 2011 angekündigt wurden:
Bildgebung
- Je nach Grading ist eine 68Ga-DOTATOC- PET/CT bei G-1,2-Tumoren sowie ein 18FDG-PET/CT bei G3-Kar – zinomen empfohlen.
- Somatostatinrezeptorszintigraphie hat einen fraglichen Stellenwert, wird aber vorerst empfohlen
- MRI empfiehlt sich für Kolon-Rektum- NET bei T3- und T4-Tumoren, ein endoskopischer Ultraschall bei T1- und T2-Tumoren
- bei CgA-negativen Tumoren eventuell NSE-Bestimmung (Messung der neuronenspezifischen Enolase)
Therapie nach Primärtumorlokalisation, Symptomen und Genetik
Pankreas:
- Bei „Functioning“-Pankreas-NET: MEN1 abklären
- Sekretintest bei Verdacht auf Gastrinom
Sporadisches Gastrinom:
- kein laparoskopisches Vorgehen indiziert
Non-functioning Pankreas-NET:
- Biopsie bei Tumoren zwischen 1–2 cm empfohlen (ultraschallge steuerte Feinnadel-Aspiration, FNA-EUS)
- bei Tumoren unter 1 cm: Observanz
- bei MEN 1: Operation indiziert
- nach Operation von G1- und G2- Tumoren ist keine adjuvante Therapie indiziert.
Dünndarm:
- Diagnostische Optionen sind Kapselendosonographie, Enteroklysma-CT, MR und die Kolonoskopie zur Abklärung einer eventuell synchronen neoplastischen Erkrankung.
- Die Primärtumorresektion ist auch im Metastasenstadium indiziert, zum einen wegen der Komplikationsgefahr (Ileus), zum anderen wegen der Möglichkeit der ablativen Lebertherapie bei Radikaloperation außerhalb der Leber.
Appendix:
- unter 2 cm: Appendektomie (da meist Zufallsbefund: keine weitere OP!)
- über 2 cm und tiefe Invasion: radikale OP
Stadium IV, systemische Therapie
- PRRT? Es gibt keine randomisierten Studien zur peptidrezeptorvermittelten Radiotherapie, die verfügbaren Daten legen jedoch ein gutes Ansprechen und eine gute Symptomkontrolle nahe.
- Option für Octreotid auf Basis der PROMID-Studie
- Option für Everolimus beim Insulinom
- Option für Everolimus/Sunitinib bei PNET, fraglich bei GI-NET
ZUSAMMENFASSEND war die 8. Jahreskonferenz der europäischen neuroendokrinen Tumorgesellschaft ein sehr in formatives Zusammentreffen, wenngleich das wesentlichste Statement zur Therapie neuroendokriner Tumoren mehrfach zitiert wie folgt lautete: „Es fehlen Studien.“ Die Datenlage ist dünn, und ein Vergleich der verschiedenen Therapiemöglichkeiten untereinander fehlt noch gänzlich. Somit lässt sich festhalten, dass das Einbringen dieser seltenen Patienten in klinische Studien unerlässlich ist, um weitere Therapiestandards etablieren zu können.