Von der Morphologie zur molekularen Diagnostik – et vice versa
Die Entdeckung der molekularen Klassifikation beim Mammakarzinom durch Perou et al. und die Unterteilung der Tumoren in luminale, basale und HER2-amplifizierte Subtypen hat wesentlich zum Verständnis der Mammakarzinogenese beigetragen. Ob diese Einteilung zur prognostischen und prädiktiven Wertigkeit etablierter pathohistologischer Marker signifikante zusätzliche Informationen liefert, ist Gegenstand vieler Studien. Die zentrale Fragestellung bei der diesjährigen St. Gallen Konsensus Konferenz in der Disziplin Pathologie versuchte zu klären, ob therapeutische Entscheidungen beim Mammakarzinom auf der molekularpathologischen Subtypenklassifikation basieren sollen oder ob etablierte histologische und immunhistochemische Marker diese Aufgabe ebenso gut und praktikabler erfüllen können.
HER2-Diagnostik: Im Vorfeld der Abstimmung sind drei kontroverse diagnostische Themen diskutiert worden. Zuerst wies Giuseppe Viale in seinem Vortrag auf Unterschiede in der HER2- Diagnostik nach den Richtlinien der FDA beziehungsweise ASCO/USCAP hin. Während die Zulassung von Trastuzumab sich nach den FDA-Guidelines richtet, die eine 3+ Positivität mit einer starken membranständigen Färbung bei mehr als 10 % der Tumorzellen wertet und eine Genamplifikation ab einer HER2/Zentromer-17-Ratio ≥ 2 definiert, geben die ASCO/USCAP-Richtlinien die gleichen Bewertungen ab 30 % Positivität beziehungsweise ab einer Ratio von 2,2. Demnach bedeuten die – durch klinische Studien validierte – FDA-Richtlinien eine breitere Zulassung für Trastuzumab.
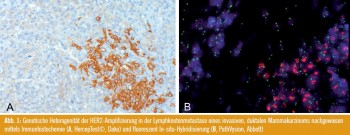
Weitere nicht eindeutig geklärte Situationen stellen die Chromosom-17-Polysomie und die genetische Heterogenität der Tumoren dar. Unter genetischer Heterogenität versteht man eine mittels In-situ- Hybridisierung nachgewiesener HER2- Amplifikation in mehr als 5 %, aber weniger als 50 % der Tumorzellen (Abb. 1). Die Identifizierung dieses Phänomens wurde von Viale als eine aktuelle Herausforderung der pathologischen Diagnostik präsentiert.
Durch die beiden oben genannten Problemstellungen wurde ein Überdenken der derzeitigen Richtlinien bezüglich der Cut-off-Werte für Positivität und damit eine Änderung der Indikationsstellung angeregt.
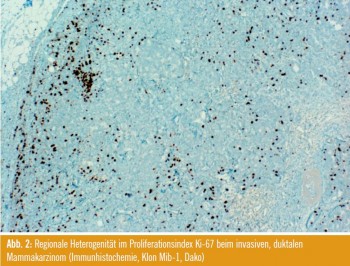
Proliferationsindex Ki67: Das zweite kontroverse Thema war die prognostische und prädiktive Wertigkeit des Proliferationsindex Ki67. Die große Inter- und Intraobserver-Variabilität der Bestimmung ist in mehreren Studien belegt und wurde auch im Rahmen einer Posterpräsentation diskutiert (Z. Varga et al.). Die Gründe für die fehlende Standardisierbarkeit beinhalten Unterschiede in den verwendeten Untersuchungsmaterialien (ganze Tumorblöcke vs. tissue microarrays, Abb. 2), unterschiedliche Färbemethoden und Bewertungsmodi. Um Ki67 als anerkannten prognostischen und prädiktiven Faktor zu etablieren, werden die Empfehlungen einer internationaler Arbeitsgruppe unter der Leitung von Daniel Hayes zur Bestimmung mit Spannung später in diesem Jahr erwartet.
Genexpressionsanalysen: Zur Anwendung von kommerziell verfügbaren Genexpressionsanalysen (MammaPrint, Oncotype DX) haben zwei Experten, Giuseppe Viale und Soon Paik, Stellung genommen. Diese Assays haben eine eingeschränkte prognostische und prädiktive Aussagekraft bei Tumoren mit hohem Differenzierungsgrad, hoher ER-Positivität und niedrigem Proliferationsindex. Gleichzeitig liefern sie wenig Zusatzinformation bei niedrig differenzierten, ER-negativen, hochproliferativen Tumoren. Dem steht eine sehr hohe Reproduzierbarkeit gegenüber, die sich jedoch auf jeweils ein einziges zentrales Labor bezieht. Beide Vortragende waren sich einig, dass der Einsatz von Genexpressionsanalysen vor allem bei Tumoren mit intermediärem Rezidivrisiko (z. B. schwache ER-Positivität, G2) sinnvoll ist.
Molekulare Subtypen
Die Therapieempfehlungen der 11. St. Gallen Consensus Konferenz 2009 richteten sich nach der immunhistochemischen Bestimmung dreier bekannter prognostischer und prädiktiver Marker: Östrogen-Rezeptor (ER), Progesteronrezeptor (PR) und HER2. Demnach können hormonsensible Karzinome, die über 1 % ER exprimieren, je nach Tumorstadium und HER2-Positivität mit endokriner oder mit Chemotherapie ± Trastuzumab behandelt werden. Patientinnen mit HER2-positiven Tumoren sollten eine Chemotherapie in Kombination mit Trastuzumab erhalten. Tumoren, die weder Steroidhormon-Rezeptoren noch HER2 exprimieren – so genannte triplenegative Tumoren –, werden mit Chemotherapie behandelt.
ER+ ≈ Luminal A, B: Möchte man diese Empfehlungen auf die molekularen Subtypen anwenden, kann man die ER-positiven Tumoren, die hormonsensibel sind, als luminale Karzinome identifizieren. Diese werden wiederum in Luminal-Aund Luminal-B-Subtypen unterteilt. Luminal- B-Tumoren sind ebenfalls ER-positiv, sie sind aber aggressiver, weisen einen niedrigeren Differenzierungsgrad und höheren Proliferationsindex auf.
Basal-Typ ≈ triplenegativ: Die Basal- Typ-Karzinome entsprechen in einem Großteil der Fälle den triplenegativen Mammakarzinomen. Die HER2-amplifizierten Tumoren bilden eine eigene Entität in dieser Klassifikation. Allerdings waren die Experten des St. Gallen Panels darüber einig, dass die prognostische und prädiktive Aussagekraft dieser Einteilung nur auf invasive, duktale Mammakarzinome zutrifft. Aus diesem Grund sind alle Empfehlungen des Panels auf diese Entität beschränkt.
Bestimmung des molekularen Subtyps
Die erste Frage des St. Gallen Panels bezog sich auf folgende Entscheidung: „Soll die Bestimmung der molekularen Subtypen ausschließlich auf bereits verfüg – baren und verlässlichen pathologische Markern beruhen?“ Diese Faktoren, die über Prognose und Therapieansprechen von Mammakarzinomen Auskunft geben, sind der Differenzierungsgrad, die Expression von ER, PR und HER2 sowie der Proliferationsmarker Ki67, obwohl dieser von den ASCO/USCAP-Richtlinien derzeit nicht als prognostischer Faktor anerkannt wird.
Vom Panel wurde nochmals betont, dass es sich hierbei um die Gleichwertigkeit pathomorphologischer Untersuchungen mit Genexpressionsanalysen handelt. Das Panel hat die ausschließliche Anwendung von bereits etablierten pathologischen Markern zur Subtypbestimmung mit breiter Mehrheit (Ja: 86,4 %) akzeptiert.
Basaler Subtyp: In weiterer Folge wurde die Bestimmung des basalen Subtyps diskutiert. Genexpressionsanalysen zeigen, dass diese Tumoren in etwa 70–80 % der Fälle triplenegativen Mammakarzinomen entsprechen. Die immunhistochemische Identifizierung dieses Subtyps ist derzeit nicht eindeutig definiert. Sowohl eine Positivität für die basalen Zytokeratine 5 und 6 als auch eine Expression des EGFR werden als Marker diskutiert. Bei dieser Fragestellung wurde vom Panel auf die derzeit fehlende therapeutische Relevanz im klinischen Alltag hingewiesen. Weiters gestalten ein nicht klar definierter Bewertungsmodus und fehlende Cut-off-Werte eine Empfehlung schwierig. Aufgrund der unklaren Situation wurde diese Empfehlung mit einer 80,5%-igen Mehrheit abgelehnt.
Luminal-B-Subtyp: Die immunhistochemische Definition vom Luminal-B-Subtyp im ER+-Kollektiv anhand pathologischer Marker ist ebenfalls nicht eindeutig geklärt. Vorgeschlagen wurden ein niedriger Differenzierungsgrad (G3), PRNegativität und ein Proliferationsindex größer als 14 %. Bezüglich HER2-Überexpression hat diese Frage keine Einschränkungen vorgegeben. Nach den Ergebnissen der Abstimmung sind die Merkmale des Luminal-B-Subtyps nach wie vor nicht eindeutig definiert, das Panel hat trotzdem mit geringer Mehrheit (Ja: 51,1 %) dieser Frage zugestimmt.
Luminal-A-Subtyp: Wesentlich eindeu – tiger ist das Votum über die Definition des Luminal-A-Subtyps ausgefallen: über 84 % der Mitglieder waren damit einverstanden, dass Luminal-A-Mammakarzinome ER- und PR-positiv und HER2-negativ sind sowie einen niedrigen Pro – liferationsindex von weniger als 14 % aufweisen.
HER2-Positivität: Im Vorfeld wurden die Richtlinien für die Bestimmung der HER2-Positivität diskutiert. Das Panel hat über die weitere Empfehlung der FDA-Guidelines im Gegensatz zu den ASCO/USCAP-Guidelines abgestimmt und mit einer Über-2/3-Mehrheit (Ja: 68,1 %) die weitere Anwendung der FDA-Richtlinien außerhalb klinischer Studien befürwortet oder empfohlen.
Therapeutische Relevanz
Die nächsten Fragen befassten sich mit der therapeutischen Relevanz der molekularen Klassifikation. Das Panel war großteils der Meinung, um eine therapeutische Entscheidung zu treffen, müssen die molekularen Subtypen nicht mittels Genexpressionsanalysen bestimmt werden, sie sind – aus Gründen der Praktikabilität – auch immunhistochemisch definierbar.
Die Frage, ob die Wahl der Chemotherapie durch den Tumorsubtyp beeinflusst werden soll, sorgte für eine rege Diskussion unter den Panelmitgliedern. In der Frage, ob damit die Art der zytotoxischen Substanz oder die allgemeine Chemotherapie- Indikation gemeint ist, hat sich Letzteres durchgesetzt. Interessanterweise haben einzelne Mitglieder trotz der Ergebnisse der letzten beiden Abstimmungen die therapeutische Relevanz dieser Empfehlung in Frage gestellt. Nach der Diskussion fiel das Votum ziemlich eindeutig aus: 74,4 % der Mitglieder meinten, dass die Entscheidung, ob eine Patientin mit Chemotherapie behandelt wird, vom molekularen Tumorsubtyp beeinflusst werden soll.
Genexpressions-Assays: Die kommerziell verfügbaren Genexpressionsanalysen Oncotype DX und MammaPrint sind dafür entwickelt worden, bei der Entscheidung über eine Chemotherapie-Indikation bestimmende Informationen zu liefern. Über diesen beiden meist ver – breiteten Assays wurde getrennt abgestimmt. Die Verwendung von Oncotype DX zur Prädiktion der Chemosensitivi – tät in einer hormonrezeptorpositiven Kohorte fand eine breite Zustimmung von über 91,3 %.
Umso überraschender war das Ergebnis der Abstimmung über das europäische Gegenstück MammaPrint: Beinahe 2/3 des Panels (Nein: 63,8 %) hat die Anwendung zur Vorhersage des Chemotherapie- Ansprechens ohne Einschränkung des Patientenkollektivs abgelehnt.
Fazit St. Gallen 2011
Als wahrscheinlich wichtigste Erkenntnis der Konferenz lässt sich feststellen, dass die Subtypeneinteilung beim invasiven, duktalen Mammakarzinom nicht nur mittels Genexpressionsanalysen, sondern auch mit pathologischen Markern möglich ist. Die prognostische und prädiktive Rolle dieser Marker wurde vom Panel bestätigt, somit bleiben sie Eckpfeiler der Therapieentscheidungen. Mehrmals kam zum Ausdruck, dass Genexpressionsanalysen nur in ausgewählten Fällen zusätzliche, therapeutisch relevante Information liefern können.
Nach Rekapitulation der Ergebnisse der letzten Konsensus-Konferenz können wir anhand der rezenten Empfehlungen eine Korrelation pathologischer Prognosefaktoren und molekularer Subtypen beim invasiven, duktalen Mammakarzinom ableiten, die möglicherweise die Empfehlungen für 2011 widerspiegelt (Tab.).
Die wichtigste Kontroverse, die diese Empfehlungen aufwerfen, betrifft die Interpretation der Bestimmung der Steroidhormon- Rezeptoren. Nach diesen Empfehlungen gelten Karzinome bereits ab einer Positivität von > 1 % als hormonsensitiv. In der österreichischen Praxis werden allerdings Bewertungssysteme bevorzugt, die Tumoren ab einer Positivität von > 10 % als hormonsensitiv klassifizieren. Dieses Scoring hat sich sowohl in der alltäglichen Praxis wie auch als Therapiegrundlage für klinische Studien bestens bewährt und genießt eine breite Akzeptanz unter PathologInnen und klinischen KollegInnen. Die Biologie und das Risikoprofil der Mammakarzinome, die ER sehr schwach exprimieren (1 bis 10 %) spricht eher dafür, in Therapieentscheidungen zusätzliche Faktoren (auch kommerziell verfügbare Genexpressionsanalysen) mit einzubeziehen. Inwieweit eine Neuorientierung in diesem Zusammenhang sinnvoll ist, wird sich wohl in den kommenden Jahren weisen.
Literatur:
– Perou CM et al., Molecular portraits of human breast tumours. Nature 2000; 406(6797):747–52
– Wolf F AC et al., American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. J Clin Oncol 2007; 25(1):118–45
– O’Toole AS. et al., Molecular assays in breast cancer pathology. Pathology 2011; 43(2):116-27
– Tang P et al., Molecular classification of breast carcinomas by immunohistochemical analysis: are we ready? Diagn Mol Pathol 2009; 18(3):125–32
– Cheang MC et al., Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst. 2009; 101(10):736–50