Chemo- und Immuntherapie
Jedes zweite Jahr findet in St. Gallen der wohl bekannteste Kongress zur Therapie des Mammakarzinoms im Frühstadium statt. Dabei spielt die Präsentation neuer Studiendaten traditionell eine untergeordnete Rolle, hingegen wird in zahlreichen Vorträgen ein Überblick über den aktuellen Wissensstand geboten. Das eigentliche Highlight jedoch ist das internationale Experten-Panel am Abschlusstag, in dem über zuvor festgelegte, aktuelle Fragen zu den Behandlungsstandards in den einzelnen beteiligten Fachgebieten diskutiert und abgestimmt wird. Im vorliegenden Artikel soll eine Übersicht über die Abstimmungsergebnisse des Panels im Bereich der adjuvanten und neoadjuvanten Chemo- und Immuntherapie geboten werden.
Zum Abstimmungsverhalten des Panels ist anzumerken, dass bereits 2009 allgemein formulierte Fragen, also solche, die Begriffe wie „kann“ oder „könnte“ enthielten, eher positiv beantwortet wurden als solche, bei denen die Formulierung ein „muss“ enthielt. Dieser Trend setzte sich 2011 fort, seitens der amerikanischen Experten wurde nicht zuletzt aus rechtlichen Gründen generell versucht, Formulierungen mit harten, möglicherweise rechtlich bindenden Aussagen zu vermeiden.
Fragen zur Chemo- und Immuntherapie
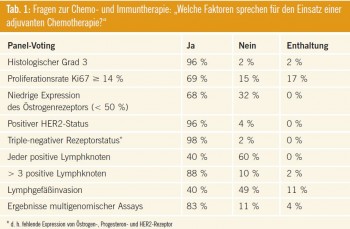
Welche Faktoren sprechen für den Einsatz einer adjuvanten Chemotherapie?
Abstimmung des Panels vgl. Tab. 1.
Kommentar: Das Abstimmungsverhalten des Panels in Hinblick auf die Frage nach der Indikation zur adjuvanten Chemotherapie spiegelt einen Wandel wider: So geht die Bedeutung klinischer Faktoren wie Lymphgefäßinvasion oder Lymphknotenbefall zurück, dagegen gewinnt die Tumorbiologie (Proliferationsrate Ki67, Grading, Hormonrezeptorexpression, HER2-Expression) an Bedeutung. Multigenomische Assays – also mRNA-Expressionsanalysen aus dem Tumormaterial – können mittlerweile als etabliert angesehen werden. Ihre Bedeutung ist am ehesten dort zu finden, wo mittels konventioneller Pathologie keine eindeutige Risikoeinschätzung möglich ist. Dabei ist jedoch streng genommenen eine prospektive Validierung noch ausständig. Diese erfolgt derzeit in der TAILORx-Studie für Oncotype DX® sowie in der MINDACT-Studie für Mamma- Print®.
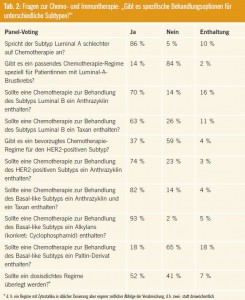
Gibt es spezifische Behandlungsoptionen für unterschiedliche Subtypen?
Abstimmung des Panels vgl. Tab. 2.
Kommentar: Auch hier spiegelt sich die Bedeutung der Tumorbiologie im Verständnis der Erkrankung wider. So wird „Brustkrebs“ heute als Überbegriff für eine heterogene Erkrankungsgruppe verstanden, deren Subtypen sich in Hinblick auf Genese, Prognose und Therapieansprechen deutlich unterscheiden. Die intrinsische Klassifikation teilt das Mammakarzinoms entsprechend der mRNA-Expression in unterschiedliche Subtypen ein1. Dabei zeigen die luminalen Subtypen (Luminal A und B) ein mRNA-Expressionsmuster ähnlich dem der reiferen Zellen an der Oberfläche des Milchgangsepithels. Diese Subtypen unterscheiden sich voneinander in Hinblick auf das Ausmaß der Hormonrezeptorexpression und das Rückfallsrisiko. So zeichnet sich der Subtyp Luminal A durch starke Expression des Östrogenund Progesteronrezeptors, ein niedriges Grading, eine niedrige Proliferationsrate und insgesamt eine guten Prognose aus. Dementsprechend war auch das Abstimmungsverhalten des Panels: In diesem Subtyp ist kein wesentlicher Vorteil einer Grading sowie eine höhere Proliferationsrate vorliegen, woraus sich ein erhöhtes Rückfallsrisiko ergibt. Auf Basis dieser Daten sah das Panel eine Chemotherapie bei Luminal B als sinnvoll an, wobei sowohl Anthrazykline als auch Taxane zum Einsatz kommen sollten.
Der HER2-positive Subtyp zeichnet sich durch eine Überexpression von HER2 aus, einem ligandenlosen Wachstumsfaktor- Rezeptor der EGFR-Familie. Ein spezifisches Chemotherapie-Regime, das für diesen Hochrisiko-Subtyp besonders geeignet ist, existiert nach Einschätzung des Panels nicht. Entscheidend ist die Behandlung mit dem monoklonalen Anti- HER2-Antikörper Trastuzumab (siehe Punkt 3)2.
Der Basal-like Subtyp ist der vierte klinisch relevante Subtyp, der seinerseits ein Genexpressionsmuster ähnlich dem der unreifen Zellen an der Basis des Milchgangepithels aufweist. Im klinischen Alltag wird der Begriff „Basal-like“ meist mit dem triplenegativen Phänotyp gleichgesetzt, einem Subtyp des Mammakarzinoms, der sich durch fehlende Expression des Östrogen-, Progesteron-, und HER2-Rezeptors auszeichnet. Noch gibt es keine spezifische zielgerichtete Therapie für diese Art des Mammakarzinoms, weshalb die Chemotherapie auch weiterhin die entscheidende Rolle spielt. Nach Ansicht des Panels sollten dabei Anthrazykline, Taxane sowie Cyclophosphamid zur Anwendung kommen, eine ausreichende Datenlage, die den Einsatz von Platinen rechtfertigen würde, existiert dagegen auch weiterhin nicht.
Zu den dosisdichten Regimen ist anzumerken, dass sie dem klassischen nordamerikanischen Standard (4-mal AC gefolgt von 4-mal Paclitaxel alle drei Wochen) überlegen sind. Dies gilt jedoch nicht bei Verwendung von Docetaxel oder eines optimalen Anthrazyklin-basierten Schemas3, weshalb dosisdichte Regime einen, aber nicht den einzigen Behandlungsstandard darstellen.
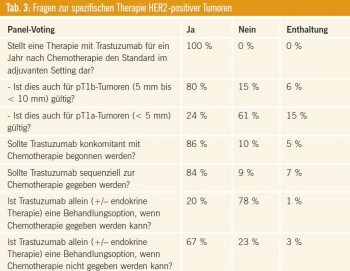
Fragen zur spezifischen Therapie HER2-positiver Tumoren
Abstimmung des Panels vgl. Tab.
3. Kommentar: Trastuzumab ist bei HER2-positiven Tumoren der unbestrittene Therapiestandard im adjuvanten Setting. Dabei sollte die Behandlungsdauer 52 Wochen betragen, wobei der Beginn der Antikörpertherapie sowohl konkomitant mit der Chemotherapie als auch sequenziell nach Ende der Chemotherapie möglich ist4, 5. Es ist jedoch anzumerken, dass die vorliegende Datenlage einen Vorteil der konkomitanten Strategie suggeriert, wenn also Trastuzumab bereits gleichzeitig mit einem Taxan verabreicht wird4–6. Neuerlich zeigt sich auch hier die Bedeutung der Tumorbiologie: Nur in seltensten Fällen würden Tumoren < 1 cm mit einer adjuvanten Chemotherapie behandelt werden. Bei Vorliegen einer HER2- positiven Erkrankung hingegen wird das individuelle Rückfallsrisiko so hoch eingeschätzt, dass auch bei pT1b-Tumoren (5 mm bis <10 mm) eine adjuvante Chemo-Immuntherapie gerechtfertigt erscheint7, 8.
Eine chemotherapiefreie adjuvante Therapie mit Trastuzumab ist auch weiterhin bei fehlender Datenlage kein Therapiestandard, sondern stellt eine Option in Einzelfällen dar, wenn eine Chemotherapie aus anderen Gründen kontraindiziert ist.
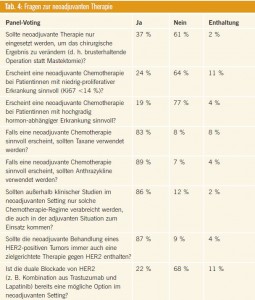
Fragen zur neoadjuvanten Therapie
Abstimmung des Panels vgl. Tab. 4.
Kommentar: Die neoadjuvante Chemotherapie wird heute ganz generell als Behandlungsoption angesehen, wenn anhand der Tumorbiologie auch eine postoperative Chemotherapie indiziert erscheinen würde. Dabei sollten Regime zum Einsatz kommen, die Taxane und Anthrazykline enthalten und der adjuvanten Standardtherapie entsprechen.
Wie im adjuvanten Setting erscheint eine neoadjuvante Chemotherapie bei hochgradig hormonabhängigen Tumoren mit niedriger Proliferationsrate nicht sinnvoll, bei HER2-positiven Tumoren sollte Trastuzumab bereits im adjuvanten Setting verabreicht werden. Eine duale Rezeptorblockade in der präoperativen Situation erscheint an Hand präliminärer Daten viel versprechend9, 10, noch ist es jedoch zu früh, um ein solches Vorgehen als Therapiestandard anzusehen.
1 Perou CM et al., Nature 2000; 406:747–52
2 Slamon D et al., Science 2007; 235;177–82
3 Burnell M et al., J Clin Oncol 2010; 28:77–82
4 Romond EH et al., N Engl J Med 2005; 353:1673–84
5 Piccart-Gebhart MJ et al. N Engl J Med 2005; 353:1659–72
6 Spielmann M et al., J Clin Oncol 2009; 27:6129–34
7 Rakkhit R et al., Cancer Res 2008; 96(Suppl. 2):97s
8 Joerger M et al., Ann Oncol 2011; 22:17–23
9 Baselga J et al., Cancer Res 2010; 70(Suppl.):82s
10 Gianni L et al., Cancer Res 2010; 70(Suppl.):82