Potentielles Frühsymptom einer neurodegenerativen Erkrankung
Definition und Klinik
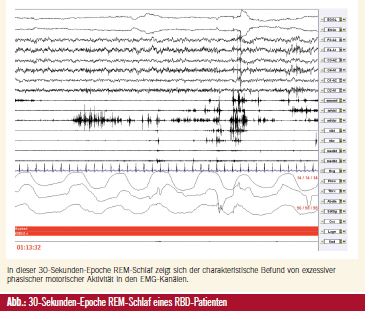
Die RBD, die 1986 erstmals von Schenck und Mitarbeitern anhand einer Fallserie systematisch beschrieben wurde1, gehört zur Gruppe der Parasomnien. Sie ist durch ein Ausagieren von Träumen und einen Verlust der im physiologischen REM-Schlaf vorliegenden Muskelatonie gekennzeichnet (Abb.). Betroffene berichten beispielsweise geträumt zu haben, dass sie angegriffen wurden und sich zur Wehr setzen mussten, während sie in Wirklichkeit aus dem Schlaf heraus den Bettpartner attackierten oder sich selbst durch entsprechendes Verhalten wie Bettstürze, Ausschlagen gegen die Wand etc. schädigten. Nicht selten kann es im Rahmen der RBD-Episoden zu Selbst- oder Fremdverletzungen kommen. Dies ist zum Teil auch mit erheblichen forensischen Implikationen verbunden.
Die Kriterien zur Diagnosestellung einer RBD wurden 2005 von der Amerikanischen Akademie für Schlafmedizin in einer überarbeiteten Version der Internationalen Klassifikation für Schlafstörungen revidiert2. Die aktuellen Diagnosekriterien sind in der Tabelle wiedergegeben.
Neu im Vergleich zu den alten Kriterien ist, dass jetzt zur Diagnosestellung die Durchführung einer Polysomnographie notwendig ist (Tab.). Grund für die Ergänzung um das Polysomnographie-Kriterium ist das klinisch nicht zuverlässig von einer RBD unterscheidbare differentialdiagnostische Spektrum, welches von schlafbezogenen Atmungsstörungen über Non-REM-Parasomnien, hypnopompen Halluzinationen, rhythmischen Bewegungsstörungen, nächtlichen Anfällen, einer schlafbezogenen paroxysmalen Dystonie bis zu schlafbezogenen dissoziativen Störungen sowie einer posttrauma tischen Belastungsstörung2 reicht und je nach Diagnose unterschiedliches therapeutisches Prozedere impliziert.
Epidemiologie
Die idiopathische RBD ist eine Schlafstörung, die vorwiegend bei Männern jenseits des 50. Lebensjahres auftritt3. Die beschriebene deutliche Geschlechtspräferenz für Männer dürfte wahrscheinlich auf die vermutlich wesentlich schwerere Manifestation der RBD bei Männern zurückzuführen sein. Ältere epidemiologische Studien zur Prävalenz der RBD ergeben eine Häufigkeit von ca. 0,5%4, 5. Validierte Messinstrumente kamen in den bisherigen Studien nicht zum Einsatz. Auch wurde eine Polysomnographie nur bei einer Subgruppe der Personen mit klinischer RBD durchgeführt, sodass die Dunkelziffer gerade von Patienten mit leichter RBD höher sein dürfte. Dies zeigte sich auch in einer Querschnittsstudie des Schlaflaborkollektivs der Universitätsklinik für Neurologie in Innsbruck, bei der die Diagnose einer RBD in der Mehrzahl der Fälle nur auf genaues Nachfragen eruiert werden konnte6. Die RBD-Prävalenz bei Morbus Parkinson beträgt ca. 40%7, 8, bei Multisystematrophie ca. 95%9, bei der Lewy-Körperchen-Demenz ca. 92%10. Weitere neurologische Erkrankungen, für die eine Assoziation mit einer RBD berichtet wurden, sind andere neurodegenerative Erkrankungen (Morbus Huntington, spino zerebelläre Ataxie 2 und 3, Guadeloupean Parkinson), autoimmuno logische Erkrankungen (Narkolepsie, Multiple Sklerose, limbische Enzephalitis), Epilepsie bei Patienten > 60 Jahre sowie Missbildungssyndrome (Chiari Malformation)11. Daneben ist das Auftreten einer chronischen RBD auch in Zusammenhang mit verschiedenen Medikamenten, insbesondere sämtlichen Antidepressiva mit Ausnahme von Buproprion, beschrieben12. Auch gibt es Fallberichte zu Rivastigmin, Selegilin und Bisoprolol, wobei letzteres in einer großen Fallserie an 703 Patienten des Schlaflabors der Universitätsklinik für Neurologie in Innsbruck nicht bestätigt werden konnte6. Die Frage, ob Antidepressiva, die im klinischen Alltag häufig verordnet werden, eine RBD als alleiniger Faktor auslösen können bzw. ob diese eine RBD nur vorzeitig bei entsprechender Prädisposition verursachen können, ist derzeit noch unbeantwortet.
RBD-Ätiologie
Aus tierexperimentellen Studien ist bekannt, dass RBD durch Läsionen im pontomesenzephalen Tegmentum entsteht. Eine entscheidende Rolle nimmt dabei der sublaterodorsale Nukleus (= Locus subcoeruleus im Katzenmodell) ein11, der von Relevanz für die Muskeltonuskontrolle im REM-Schlaf ist. Für den Menschen liegen vereinzelte Fallberichte von symptomatischer RBD bei verschiedenen Hirnstammpathologien vor, die übereinstimmend Läsionen im Bereich des pontomesenzephalen Übergangs beschreiben. Rezent sind erstmals In-vivo-Befunde bei Patienten mit RBD mittels fortgeschrittenen MR-Techniken erhoben worden, die ebenfalls Hinweise auf eine Fehlfunktion pontomesenzephaler Systeme lieferten13, 14.
Diagnostik
Mittlerweile ist nach den revidierten Kriterien der Internationalen Klassifikation für Schlafstörungen eine Polysomnographie zur Diagnosesicherung einer RBD zwingend notwendig2. Anamnestisch ist insbesondere die Frage nach Ausagieren von Trauminhalten oder nach Stürzen aus dem Bett mit nachfolgenden Verletzungen wichtig. Wenn möglich sollte immer zusätzlich eine Fremdanamnese mit dem Bettpartner erhoben werden. Für den klinischen Alltag wurden von verschiedenen Arbeitsgruppen Patientenfragebögen entwickelt, welche systematisch Symptome zur RBD abfragen. Allerdings haben diese Fragebögen nach wie vor Defizite und können allenfalls als Screening-Instrumente eingesetzt werden. Die Diagnosekriterien fordern das Vorhandensein von exzessiver tonischer oder phasischer Muskelaktivität in den Kinn- und/oder Extremitäten-EMG-Ableitungen im REM-Schlaf zur Diagnosestellung2. Genaue Cut-off-Scores bzw. eine Angabe der anzuwendenden EMG-Montage, womit sich unsere Arbeitsgruppe in Kooperation mit dem Hospital Clinic de Barcelona in den letzten Jahre beschäftigte15, 16, befinden sich aktuell kurz vor der Veröffentlichung.
Weitere Erkenntnisse zur Manifestation motorischer Ereignisse bei der RBD stammen aus der kombinierten Videopolysomnographie, die mittlerweile zur Standardausstattung jedes Schlaflabors zählt. Von diagnostischer Relevanz ist, dass die sogenannten “violenten” Verhaltensweisen, welche das Charakteristikum der RBD sind, nur die Spitze des Eisbergs repräsentieren, während kleine myokloniforme Bewegungen, vorwiegend im Bereich der distalen Extremitäten, die Majorität der RBD-Bewegungen selbst bei schwer betroffenen Patienten darstellen17. Für den klinischen Alltag bedeutet dies, besonderen Augenmerk auf diese kleinen Bewegungen zu legen, da nicht in jeder Nacht violentes Verhalten aufgezeichnet wird. Erwähnenswert ist ferner, dass sämtliche elaborative Verhaltensweisen in Zusammenhang mit schnellen Augenbewegungen auftreten18, 19.
RBD – Frühzeichen einer neurodegenerativen Erkrankung?
Während die idiopathische Form der RBD in der allgemeinen Bevölkerung eher selten ist, ist im Vergleich dazu die Prävalenz der RBD bei Synukleinopathien deutlich höher und wird in der Literatur mit bis zu 95% aller Patienten mit Multisystematrophie beschrieben. Von besonderem Interesse sind Verlaufsstudien von Patientengruppen mit idiopathischer RBD ohne weitere neurologische Symptome. Mehrere derartige Untersuchungen aus verschiedenen Zentren zeigten, dass bis zu 65% der Patienten mit idiopathischer RBD bei Langzeitnachbeobachtung einen Morbus Parkinson, eine Multisystematrophie oder eine Lewy-Körperchen-Demenz entwickeln20-22. Das Konzept der idiopathischen RBD als nichtmotorisches Frühsymptom einer Parkinson-Krankheit passt gut zur Hypothese von Braak und Mitarbeitern zur kaudorostralen Ausbreitung der Parkinson-Pathologie im menschlichen Gehirn23. Auch diese Hypothese geht von einem Befall des kaudalen Hirnstamms vor Beteiligung der Substantia nigra aus.
Management der RBD
Abgesehen von Einzelfallberichten und Fallserien zur Behandlung der RBD sowie einer kleinen doppelblinden, placebokontrollierten, monozentrischen Studie, liegen bislang keine großen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studien vor. Die Therapie der RBD ist somit off-label. Am besten untersucht ist Clonazepam. Zu dieser Substanz gibt es auch größere Fallserien3. Die Behandlung wird üblicherweise mit 0,25 bis 0,5 mg begonnen und kann je nach Bedarf bis auf 1 bis 2 mg gesteigert werden. Häufig sprechen die Patienten bereits auf niedrige Dosierungen sehr gut an. Bei einer Minderheit der Patienten bleibt jedoch eine nennenswerte Verbesserung der RBD-Beschwerden aus. Wichtig ist außerdem, dass Clonazepam wie alle Benzodiazepine durch seine muskelrelaxierende Wirkung eine vorbestehende komorbide schlafbezogene Atmungsstörung aggravieren kann, sodass ein Therapieversuch bei klinischem RBD-Verdacht ohne polysomnographische Diagnosesicherung aufgrund des differentialdiagnostischen Spektrums sowie potentieller Therapienebenwirkungen nach Möglichkeit vermieden werden sollte.
Eine weitere wichtige Substanz in der Behandlung der RBD stellt Melatonin dar, welches üblicherweise in einer Dosierung von 3 bis 5 mg eingesetzt wird. Erwähnenswert ist, dass nur in einem Teil der Fallserien Melatonin als Monotherapie zum Einsatz kam. Letztes Jahr wurde erstmalig eine kleine doppelblinde, randomisierte, Cross-over-Studie zur Melatoninbehandlung der RBD bei 8 Patienten publiziert, die unter 3 mg Melatonin eine geringfügige subjektive und objektive Verbesserung der RBD über 4 Wochen nachweisen konnte24.
Im Einzelfall ist auch ein Versuch der Behandlung der RBD mit Quetiapin oder niedrigdosiertem Olanzapin zu diskutieren, wobei auch hierzu keine objektiven Daten vorliegen. Mehr oder weniger gut belegte Einzelfallberichte und kleine Serien über positive Effekte von Cholinesterasehemmern, Gammahydroxybutyrat und anderen erlauben derzeit noch keine therapeutische Empfehlung. Ein positiver Effekt von L-Dopa und Dopaminagonisten konnte mittlerweile nicht bestätigt werden12.
Neben der medikamentösen Therapie kommt nichtmedikamentösen Therapieoptionen eine große Rolle zu. Vordergründig ist dabei die ausführliche Beratung des Patienten hinsichtlich Bettsicherungsmaßnahmen. Vor allem ist auf das Bett selbst und dessen unmittelbare Umgebung zu achten, da im Gegensatz zum Schlafwandeln bei der RBD das Bett selbst selten verlassen wird. Ein bewegungsgetriggertes Bettalarmsystem als nichtmedikamentöse therapeutische Option bei Patienten mit schwerer nicht-medikamentös therapierbarer RBD wird von Schenck und Mitarbeitern als weitere Therapiealternative empfohlen. Anzumerken ist, dass vor Einleitung einer Behandlung der RBD ausgeschlossen sein muss, dass es sich um eine rein medikamentös induzierte Form handelt. In diesem Fall stellt eine Änderung des Therapieregimes – soweit möglich – das Prozedere der ersten Wahl dar.
resümeeDie Forschung auf dem Gebiet der RBD erbrachte in den letzten Jahren großen Wissenszuwachs. Für die Zukunft ist insbesondere die Frage von großem Interesse, welcher Patient mit der Diagnose einer idiopathischen RBD zur Risikopopulation für die Entwicklung einer neurodegenerativen Erkrankung zählt. Ein weiterer sehr wichtiger Punkt stellt eine Verbesserung der Awareness der Bevölkerung für die Diagnose RBD dar. Dies wäre nicht nur hinsichtlich der Früherkennung einer neurodegenerativen Erkrankung von großer Bedeutung, sondern auch hinsichtlich der zum Teil gravierenden Verletzungen, die im Rahmen von RBD-Episoden auftreten können, und die zu einem großen Prozentsatz unter symptomatischer Therapie vermeidbar wären.
1) Schenck CH et al., Chronic behavioral disorders of human REM sleep: a new category of parasomnia. Sleep 1986; 9:293-308
2) American Academy of Sleep Medicine. ICSD-2-International classification of sleep disorders, 2nd ed.: diagnostic and coding manual. Westchester, Illinois: American Academy of Sleep Medicine 2005:148-152
3) Mahowald MW & Schenck CH, REM sleep parasomnias. In: Kryger MH, Roth T, Dement WC, editors. Principles and Practice of Sleep Medicine. Philadelphia: Elsevier 2005; p. 897-916
4) Ohayon MM et al., Violent behavior during sleep. J Clin Psychiatry 1997; 58:369-376 5) Chiu HF et al., Sleep-related injury in the elderly – an epidemiological study in Hong Kong. Sleep 2000; 23:513-517
6) Frauscher B et al., REM sleep behavior disorder in 703 sleep-disorder patients: the importance of eliciting a comprehensive sleep history. Sleep Med 2010; 11:167-71
7) Wetter TC et al., Polysomnographic measures in Parkinson’s disease: a comparison between patients with and without REM sleep disturbances. Wien Klin Wochenschr 2001; 113:249-253
8) Gagnon JF et al., REM sleep behavior disorder and REM sleep without atonia in Parkinson’s disease. Neurology 2002; 59:585-589
9) Plazzi G et al., REM sleep behavior disorders in multiple system atrophy. Neurology 1997; 48:1094-1097
10) Boeve BF et al., REM sleep behavior disorder and degenerative dementia: an association likely reflecting Lewy body dementia. Neurology 1998; 51:363-370
11) Boeve BF, REM sleep behavior disorder: Updated review of the core features, the REM sleep behavior disorder-neurodegenerative disease association, evolving concepts, controversies, and future directions. Ann N Y Acad Sci 2010; 1184:15-54
12) Frauscher B & Högl B, REM sleep behavior disorder: discovery of RBD, clinical and laboratory diagnosis, and treatment. In: Chokroverty S, Allen RP, Walters AS editors. Sleep & Movement Disorders: in press
13) Scherfler C et al., White and gray matter abnormalities in idiopathic rapid eye movement sleep behavior disorder: A diffusion-tensor imaging and voxel-based morphometry study. Ann Neurol 2010; Epub ahead of print
14) Unger MM et al., Diffusion tensor imaging in idiopathic REM sleep behavior disorder reveals microstruc – tural changes in the brainstem, substantia nigra, olfactory region, and other brain regions. Sleep 2010; 33:767-773
15) Frauscher B et al., Quantification of electromyographic activity during REM sleep in multiple muscles in REM sleep behavior disorder. Sleep 2008; 31:724-31
16) Iranzo A et al., Usefulness of the SINBAR electromyographic montage to detect the motor and vocal manifestations occurring in REM sleep behavior disorder. Sleep Med 2011; 12:284-8
17) Frauscher B et al., Video analysis of motor events in REM sleep behavior disorder. Mov Disord 2007; 22:1464-70
18) Frauscher B et al., The relation between abnormal behaviors and REM sleep microstructure in patients with REM sleep behavior disorder. Sleep Med 2009; 10:174-81 19) Manni R et al., Motor-behavioral episodes in REM sleep behavior disorder and phasic events during REM sleep. Sleep 2009; 32:241-5
20) Schenck CH et al., Delayed emergence of a parkinsonian disorder in 38% of 29 older men initially diagnosed with idiopathic rapid eye movement sleep behavior disorder. Neurology 1996; 46:388-93
21) Iranzo A et al. Rapid-eye-movement sleep behavior disorder as an early marker for a neurodegenerative disease: a descriptive study. Lancet Neurol. 2006;5:572-577
22) Postuma RB et al., Quantifying the risk of neurodegenerative disease in idiopathic REM sleep behavior disorder.Neurology. 2009; 72:1296-1300
23) Braak H et al., Pathology associated with sporadic Parkinson’s disease – where does it end. J Neural Transm Suppl 2006; 70:89-97
24) Kunz D & Mahlberg R, A two-part, double-blind, placebo-controlled trial of exogenous melatonin in REM sleep behavior disorder. J Sleep Res 2010; 19:591-6