ACOSOG Z0011 aus radioonkologischer Sicht
Die geringe Inzidenz axillärer Rezidive von 3,6 % im ALND-Arm (dem Arm mit axillärer Dissektion) bzw. von 1,8 % im SLN-Arm (dem Arm mit Sentinel-Lymphknoten- Dissektion) gab Anlass zur Spekulation, dass dies auf eine unbeabsichtigte (oder beabsichtigte?) teilweise (oder komplette?) Mitbestrahlung der ipsilateralen Axilla zurückzuführen sein könnte.
Studienvorgaben zur adjuvanten Radiotherapie nach Lumpektomie unabhängig vom Behandlungsarm: Bei allen Patientinnen sollte eine postoperative Bestrahlung der Restbrust mittels Photonen über opponierende tangentiale Felder („tangents“) in Rückenlage erfolgen, wobei ausschließlich die Brustdrüse mit einem Sicherheitssaum von 1,0–2,0 cm mit einer Dosis zwischen 45–50 Gy bei einer Einzelfraktion von 1,8–2,0 Gy (5- mal wöchentlich) behandelt werden sollte. Die Bestrahlungsplanung konnte sowohl auf Basis von Lokalisationsaufnahmen als auch 3-dimensional-konformal mittels Computertomographie erfolgen. Weiters gefordert wurde die Applikation einer Minimaldosis von 50 Gy im Operationsbett, die bei einer Bestrahlung der Restbrust mit < 50 Gy über eine kleinvolumige („Boost“-)Bestrahlung erfolgen sollte. Eine Erhöhung der Boost-Dosis > 50 Gy im Operationsbett stand den teilnehmenden Zentren frei. Nicht erlaubt war ein „drittes Feld“ (im Sinne eines „Supraklavikularfeldes“ im Anschluss an die Tangenten) mit Inklusion des Level III der Axilla, der Infra- und Supraklavikularregion.
Eine Qualitätssicherung der Radiotherapie mit zentralem Review war nicht vorgesehen, jedoch eine Beurteilung von Verifikationsaufnahmen, Dosisverschreibung und begleitender medizinphysikalischer Dokumentation anhand von Stichproben (obige Informationen basieren auf persönlicher Anfrage an die Studienzentrale im März 2011). In der Publikation selbst1 findet sich lediglich der Hinweis, dass eine spezifische Therapie der Axilla – insbesondere ein drittes Bestrahlungsfeld – nicht vorgesehen ist, jedoch alle Patientinnen eine Bestrahlung der Restbrust über opponierende tangentiale Felder erhalten sollten.
Durchführung der Radiotherapie im Rahmen der Studie: Da eine prospektive Qualitätssicherung der Radiotherapie nicht geplant war und bis dato Stichprobenergebnisse nicht kommuniziert wurden, ist unklar, ob oder in welchem Prozentsatz und Ausmaß teilnehmende Zentren unbewusst (inadäquate Bestrahlungsplanung) oder bewusst (Feldmodifikationen wie „Wide tangents“, „High tangents“, „Wide and high tangents“) aus Sorge, die Axilla unbehandelt zu wissen, von den Vorgaben abgewichen sind.
Anlässlich einer von der AGO/OEGGG am 30. 9. 2011 in Innsbruck organisierten Konsensuskonferenz zur ACOSOG- Z0011-Studie, an der auch Prof. Dr. Eric A. Strom (Radioonkologe am MD Anderson Cancer Center) teilnahm, wurde berichtet, dass eine retrospektive Evaluierung der radioonkologischen Protokollkonformität nun geplant sei.
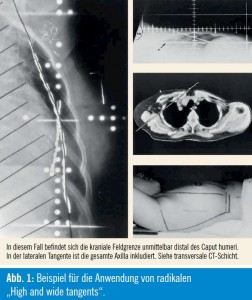
In seinem Vortrag präsentierte er unter anderem einen 3-D-konformalen CT- Bestrahlungsplan, um die am MD Anderson übliche Technik der tangentialen Restbrustbestrahlung zu demonstrieren, der erkennen ließ, dass eine Unterdosierung in den medialen Anteilen der Restbrust in Kauf genommen wurde, um einen Teil der Axilla („Wide tangents“) mitzuerfassen. Im zweiten Fallbeispiel (Planung anhand von Lokalisationsaufnahmen) wurde illustriert, dass mit kranialer Ausweitung der Feldgrößen (bis 2 cm unter das Caput humeri: „Wide and high tangents“) auch die Inklusion von Level III – ohne zusätzliches „drittes Feld“ – ermöglicht wird.
Die Frage, ob alle Patientinnen am MD Anderson einer CT-geplanten Bestrahlung unterzogen würden, wurde mit dem Hinweis, dass ein derart großes Patientenaufkommen dies nicht zuließe, verneint.
Für Interessierte sei hier auf eine Publikation von Schlembach et al. aus dem Jahr 20012 verwiesen. Inhalt war eine retrospektive Auswertung von 65 Patientinnen, die auf Basis von Lokalisationsaufnahmen mit der am MD Anderson üblichen Technik behandelt worden waren. Es wurde untersucht, in welchen Fällen die Sentinelregion und Lymphknoten der Level I und II (anhand der Lage von Gefäßclips) am Feldrand oder innerhalb der Tangenten gelegen waren. Im Text wird darauf hingewiesen, dass bei 55–65 % jener Patientinnen, die an der ACOSOG-Z0011-Studie teilnehmen und in den SLN-Arm randomisiert werden, mit einem axillären Lymphknotenbefall zu rechnen ist. Es wird konkludiert, dass ein sorgfältiges „tangentialen Felddesign“ notwendig ist, um allfällig mikroskopisch befallene axilläre Lymphknoten in den Leveln I und II zu erfassen. Eine Felderweiterung nach kranial wird explizit empfohlen (Abb. 1); Anmerkung: Bei diesem Felddesign wird auch der Level III (mit)behandelt, der bei ALND nicht entfernt würde und üblicherweise – meist über ein „drittes Feld“ – nur dann bestrahlt wird, wenn nach ALND ≥ 4 Lymphknoten einen Befall aufweisen).
Von der geringen Rate axillärer Rezidive überrascht wurde auf folgende Erklärung zurückgegriffen: In der ersten Publikation zur Inzidenz lokoregionärer Rezidive3 wurde konstatiert, dass es bekannt sei, dass „Standard tangents“ die „Sentinel region, much of Level I, and a portion of Level II“ mitbestrahlen. Hier wurde auf die Publikation von Schlembach et al.2 verwiesen mit dem Nachsatz, dass, obwohl keine axillärspezifische Radiotherapie in dieser Studie durchgeführt wurde, aufgrund der Bestrahlung der Restbrust davon ausgegangen werden kann, dass ein signifikanter Anteil der Axilla in beiden Studienarmen bestrahlt wurde.
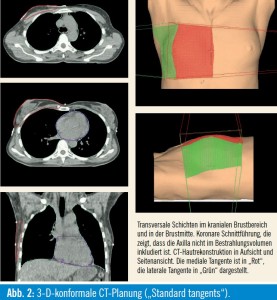
Der Behauptung, dass mit „Standard tangents“ in jedem Fall signifikante Anteile der Axilla behandelt werden, gilt es vehement zu widersprechen. Zu diesem Thema gibt es zahlreiche Publikationen, die belegen, dass bei „Standard tangents“ die Axilla keine therapeutischen Dosen erhält4–10. Eine Bestrahlungsplanung nach modernen Standards (3-Dkonformale CT-Planung) ist in der Lage, das Target (Restbrust) gezielt zu erfassen (Abb. 2) – als Ausnahme gelten besondere anatomische Gegebenheiten, Lagerungsprobleme oder ähnliches.
Selbst wenn Teile der Axilla im Rahmen der ACOSOG-Z0011-Studie mitbehandelt wurden, ist zu hinterfragen, ob es sich hierbei um therapeutische Dosen handelt. Um dies zu verifizieren, bedürfte es einer Analyse mittels Dosis-Volumen- Histogrammen von 3-D-konformalen Plänen nach Delineation der Restbrust, Sentinelregion, Level I/II/III.
Hier ist anzumerken, dass zur Sterilisation von Mikrometastasen (sei es in der Restbrust oder in regionären/juxtaregionären Lymphknoten) eine Dosis zwischen 45–50 Gy erforderlich ist, um dies mit einer 95%igen Wahrscheinlichkeit zu gewährleisten. Handelt es sich um Makrometastasen, sind höhere Dosen erforderlich.
Soll bei einem weiter reduzierten operativen Ansatz die Radiotherapie ausgeweitet werden? Grundsätzlich ist eine weitere Reduktion des operativen Eingriffs zur Vermeidung der ALND-assoziierten Akut- und Spätmorbidität bei gleichbleibender lokoregionärer Kontrolle und gleichbleibendem Überleben vorbehaltlos zu begrüßen. In Frage gestellt und erst bewiesen werden muss, ob eine Erweiterung des Bestrahlungsvolumens mit höherer Belastung benachbarter Strukturen und Organe und daraus resultierenden spezifischen Nebenwirkungen (Lungenschädigung, Bewegungseinschränkungen im Schultergelenk, Lymphödeme, Neuropathien, Gefäßschäden v. a. an Herzkranzgefäßen und Induktion von Zweitmalignomen – wobei Letztere eine Latenzzeit bis zu 20 Jahren aufweisen!) tatsächlich, und zwar im multimodalen Therapiekonzept, das Prädikat „Less is more“ verdienen.
Hat die ALND oder die definitive Bestrahlung der Axilla therapeutischen Nutzen? Bislang wurde ein Überlebensvorteil weder durch die ALND noch durch die primäre definitive Radiotherapie der Axilla bewiesen. In historischen Kollektiven war nach „Sampling“ klinisch vergrößerter Lymphknoten eine gezielte Bestrahlung der Axilla (meist in Kombination mit Bestrahlung der Infra- und Supraklavikularregion) obligat, wobei üblicherweise eine Dosis von 50 Gy appliziert wurde, die, wie schon erwähnt, eine adäquate Dosis nur für mikroskopische Residuen darstellt. Trotzdem traten axilläre Rezidive selten auf. Die Nebenwirkungen nach chirurgischem „Sampling“ und anschließender Radiotherapie waren jedoch ausgeprägt. Gerade aufgrund dieser historischen Erfahrungen wurde die alleinige und standardisierte chirurgische „Clearance“ der Axilla von der radioonkologischen Community begrüßt.
Retrospektive Analysen 11–13, die die axilläre Rezidivrate bei Low-Risk-Patientinnen, bei denen aus verschiedensten Gründen keine ALND durchgeführt wurde und die nur eine Restbrustbestrahlung erhielten, zeigten eine auffällig geringe Rate an axillären Rezidiven, insbesondere in Kombination mit Systemtherapie. Sehr geringe Raten an Lokalrezidiven wurden auch bei Patientinnen berichtet, die in Bauchlage bestrahlt wurden, welche eine Mitbestrahlung der Axilla völlig ausschließt. Dies wirft die Frage auf, ob der axillären „Clearance“ (chirurgisch oder mittels ionisierender Strahlung) der Stellenwert zukommt, der ihr zugewiesen wird?
Qualitätssicherung der Strahlentherapie: Eine rigorose Qualitätssicherung der Strahlentherapie in der ACOSOG- Z0011-Studie hätte eine wichtige Frage mit zweifellos wegweisender Folge beantworten können. Geblieben sind Spekulationen, die sich auch nach retrospektiver Analyse der Radiotherapiedaten nicht werden klären lassen. Insbesondere in den USA wird selbst in großen Zentren die 3-D-konformale Radiotherapie der Brust aus Zeit- und Kostengründen nicht standardmäßig durchgeführt. Ein zusätzlicher und wesentlicher Faktor in dieser Studie ist, hier zitiere ich die Kollegen vom MD Anderson, dass das progressive Studiendesign dafür verantwortlich war, dass die geplante Patientinnenrekrutierung (es wurden nur die Hälfte der geplanten Fälle eingebracht) nicht erreicht wurde. Bedauerlich ist, dass aufgrund der Art der medialen Berichterstattung in den USA auch Patientinnen mit höherem Risikoprofil zunehmend eine ALND ablehnen und Brustchirurgen – die Gründe hierfür sind wahrscheinlich vielfältig – diesem Wunsch unkritisch Folge leisten.
1 guiliano Ae et al., Axillary dissection vs no Axillary dissection in Women With invasive breast cancer and sentinel node Metastasis. JAMA 2011; 305:569–575.
2 schlembach PJ et al., relationship of sentinel and axillary level i–ii lymph nodes to tangential fields used in breast irradiation. int J radiat oncol biol Phys 2001; 501:671-678.
3 giuliano Ae et al., locoregional recurrence After sentinel lymph node dissection. With or Without Axillary dissection in Patients With sentinel lymph node Metastases. Ann surg 2010; 252:426–433.
4 Krasin M et al., evaluation of a standard breast tangent technique: A dose-volume analysis of tangential irradiation using three-dimensional tools. int J radiat oncol biol Phys 2000; 47:327–333.
5 reznik J et al., Analysis of axillary coverage during tangential, radiation therapy to the breast. int J radiat oncol biol Phys 2005; 61:163–168.
6 setton J et al., radiation Field design and regional control in sentinel lymph node-Positive breast cancer Patients With omission of Axillary dissection. cancer 2011; 00:1–10.
7 Kiel K et al., is it possible to treat the axillary nodes in the same radiation fields covering the breast? A study to locate the limits of the axillary dissection relative to anatomic landmarks in the tangential fields. int J radiat oncol biol Phys 1997; 39(2 suppl):p264.
8 smitt Mc et al., utility of three-dimensional Planning for Axillary node coverage with breast-conserving radiation therapy: early experience. radiology 1999; 210:221–226.
9 Aristel c et al., evaluation of level i and ii axillary nodes included in the standard breast tangential fields and calculation of the administered dose: results of a prospective study. int J radiat oncol biol Phys 2001; 51(1):69–73.
10 goodman rl et al., the relationship between radiation fields and regional lymph nodes in carcinoma of the breast. int J radiat oncol biol Phys 2001; 50(1):99–105.
11 Pejavar s et al., regional nodal recurrence in breast cancer patients treated with conservative surgery and radiation therapy (bcs + rt). int J radiat oncol biol Phys 2006; 66:1320–1327.
12 Wong Js et al., treatment outcome after tangential radiation therapy without axillary dissection in patients with early-stage breast cancer and clinically negative axillary nodes. int J radiat oncol biol Phys 1997; 39(4):915–920.
13 hwang rF et al., low locoregional failure rates in selected breast cancer patients with tumor-positive sentinel lymph nodes who do not undergo completion axillary dissection. cancer 2007; 110(4):723–730.