Detektion und klinische Bedeutung – Zirkulierende Tumorzellen
Obwohl in den letzten Jahren bei der Diagnose und Behandlung von Krebserkrankungen wesentliche Fortschritte erzielt wurden, gilt Krebs noch immer als nicht heilbar. Es ist bekannt, dass vom Primärtumor Metastasen streuen und in entfernten Geweben, abhängig von den in der Umgebung vorherrschenden Bedingungen, das Wachstum wieder beginnen kann. Im Knochenmark werden diese Zellen als disseminierte Tumorzellen (disseminated tumor cells, DTC) bezeichnet. Die prognostische Bedeutung des Vorhandenseins solcher DTC in Knochenmarkaspiraten wurde bereits für einige Krebsarten, vor allem im Zusammenhang mit Brustkrebs aufgezeigt. Aufgrund des invasiven Verfahrens zur Gewinnung der DTC aus dem Knochenmark werden Versuche unternommen, um den Nachweis von zirkulierenden Tumorzellen (circulating tumor cells, CTC) aus dem peripheren Blut zu optimieren. Blut wäre die ideale Quelle, da bei Patienten unter Behandlung routinemäßig Blut abgenommen wird. Trotz der Fortschritte in den letzten Jahren ist der Nachweis von CTC bei dem Monitoring eines unter klinischer Behandlung stehenden Krebspatienten noch nicht routinemäßig im Einsatz.
Anreicherung und Detektion von CTC
Die größte Herausforderung bei der Erkennung von CTC ist ihre Seltenheit im Blut. Eine Vielzahl von Techniken zur Anreicherung und Detektion von CTC sind derzeit in Verwendung.
Die Techniken zur Anreicherung von CTC basieren auf deren biologischen und/ oder physikalischen Eigenschaften, wodurch man CTC von normalen Zellen des Blutes unterscheiden kann. Affinitätsbasierende Anreicherung ist bei Weitem die am häufigsten verwendete Methode, um CTC von anderen Zellen zu trennen. Affinitätstechniken nutzen Oberflächenmarker, die von CTC, aber nicht von Blutkörperchen (z. B. EpCAM) oder von Blutzellen, aber nicht von CTC (z. B. CD45) exprimiert werden.
Ein alternativer und älterer Ansatz ist die Anreicherung von Zellen über einen Dichtegradienten. Mit dieser Methode ist jedoch die Anreicherung der Tumorzellen sehr gering.
Eine weitere Eigenschaft, welche zur Anreicherung von CTC herangezogen wird, ist die Größe der Tumorzellen. Tumorzellen, insbesondere jene von soliden Tumoren, sind größer als die meisten Zellen, welche im Blut zu finden sind. Vorteilhaft ist, dass die Heterogenität der an der Oberfläche einer Tumorzelle vorhandenen Marker kein Hindernis darstellt und dadurch ein breiteres Spektrum von Tumoren abgedeckt werden kann.
Auch die neuartigen Mikrochipplattformen, welche zur Anreicherung von Tumorzellen entwickelt werden, basieren auf der Expression von unterschiedlichen Oberflächenmarkern oder auf deren Größe.
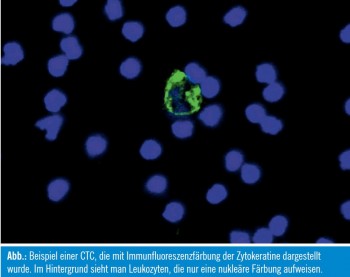
Obwohl Anreicherungsmethoden die Anzahl von CTC aus einem Gemisch verschiedener Zellen erhöhen, erhält man bei keiner der verwendeten Methoden eine reine Population an Tumorzellen. Dadurch wird ein anschließendes Verfahren benötigt, um CTC von den nichtspezifisch isolierten Zellen zu unterscheiden. Dies wird allgemein mittels zytomorphologischer Charakterisierung von CTC, durch den immunzytochemischen Nachweis von tumorspezifischen Antigenen oder mit Hilfe von verschiedenen Real-time-PCR-Ansätzen (RT-PCRAnsätzen) durchgeführt. Die Abbildung zeigt CTC, mit Hilfe einer Immunfluoreszenzfärbung der Zytokeratine dargestellt wurden. Inzwischen wurden auch Multimarker- Ansätze entwickelt, welche die gleichzeitige Visualisierung von mehreren Markern ermöglichen. Mehrere RTPCR- Protokolle wurden bis dato entwickelt. Jedoch zeigte sich, dass die Detektion von CTC durch RT-PCR eine geringe Sensitivität aufweist, da viele Transkripte, welche zur Identifizierung von CTC herangezogen wurden, auch von Nichttumorzellen exprimiert werden.
Besonders erwähnenswert ist das CellSearch®-System von Veridex/Johnson & Johnson. Mit dieser von der FDA zugelassenen Methode kann die Anzahl von CTC im Blut eines Tumorpatienten nachgewiesen werden. Keine der anderen Methoden wurde einer so sorgfältigen präklinischen und klinischen Validierung unterzogen. Es handelt sich dabei um ein vollautomatisiertes System zum Nachweis von CTC, wobei Antikörper (CD45-, EpCAM+, Zytokeratin 8, 18+ und/oder Zytokeratin 19+) mit mikroskopischen Eisenpartikeln (Ferrofluids) verbunden werden und diese Verbindungen spezifisch an CTC binden.
Nachdem die CellSearch®-Methode heutzutage die einzige FDA-valide Methode ist, werden die in Entwicklung befindlichen Anreicherungsverfahren im Vergleich etabliert. In Kooperation zwischen der University of Southern California und Caltech entwickelten wir einen größenselektionsbasierten Mikrofilter, der im Vergleich mit CellSearch® eine höhere Sensitivität zeigte. Kürzlich wurde ein Bericht über einen Vergleich des ISET-Filtersystems mit CellSearch® veröffentlicht. Wiederum wurden diskordante Ergebnisse erzielt, was die Limitierung des EpCAM-Antikörpers aufzeigt. Kürzlich wurde eine weitere, auf Größe basierende Methode, die ScreenCell®- Technologie, entwickelt.
Ein wesentlicher Unterschied zwischen der von unserer Gruppe entwickelten Filtertechnologie und den anderen, auf Größe basierenden Methoden liegt in der Dichte und Ordnungsmäßigkeit der Poren. Auf den meisten Filtern sind die Poren unregelmäßig verteilt mit einer geringen Porendichte und überlappenden Poren, die zum Verlust der CTC führen.
Charakterisierung von CTC
Aufgrund der beschriebenen verschiedenen Anreicherungs- und Detektionsmethoden zur Gewinnung von CTC ist offensichtlich, wie wichtig eine anschließende Charakterisierung ist.
Es gibt Hinweise darauf, dass solide Tumoren aus heterogenen Zellpopulationen bestehen und nur gewisse Subpopulationen dieser Zellen, welche als Tumorstammzellen oder krebsinitiierende Zellen bezeichnet werden, tumorigene Eigenschaften aufweisen. Bei Brustkrebs wurden diese Zellen, auch putative Brustkrebsstammzellen genannt, als CD44+CD24-/low identifiziert. Des Weiteren zeigen diese Zellen eine erhöhte Produktion des Enzyms Aldehyddehydrogenase. Tumorstammzellen scheinen eine wichtige Rolle in der Tumorigenese zu spielen, die Fähigkeit der Selbsterneuerung zu zeigen, in die Angiogense eingebunden und für Therapieresistenzen mitverantwortlich zu sein.
In einer retrospektiven Analyse von DTC in Knochenmarkaspiraten von Brustkrebspatientinnen in den klinischen Stadien I und II haben wir gezeigt, dass die Mehrzahl der Zellen den vermeintlichen Brustkrebsstammzellenphänotyp trägt. Ähnliche Studien an CTC bei Patientinnen mit metastasiertem Brustkrebs folgten. Es konnte gezeigt werden, wie wichtig es ist, neuartige Technologien unter Berücksichtigung der Heterogenität der CTC zur Detektion und Charakterisierung dieser Zellen zu entwickeln. Technologische Fortschritte ermöglichen nun die Charakterisierung auch auf Ebene von einzelnen Zellen, wodurch es ermöglicht wird, neue therapeutische Targets zu identifizieren.
Mehrere Studien haben auf die Möglichkeit der Anwendung der CTC zur aktuellen Charakterisierung der Erkrankung hingedeutet. Beispiele hierfür sind Studien zum Nachweis von Hormonrezeptoren auf den CTC oder zur Detektion des HER2/neu-Status. In einigen Studien konnte gezeigt werden, dass der Status im Primärtumor nicht immer mit den CTC übereinstimmt. In Zukunft bleibt zu erforschen, ob es von klinischer Bedeutung ist, die Therapie danach zu richten.
In den letzten Jahren ist deutlich geworden, dass die epithelial-mesenchymale Transition (EMT) eine wichtige Rolle in der Pathogenese von Krebs, der Stammzellfähigkeit und der Metastasierung zu spielen scheint, und daher wird in Zukunft auch in dieser Richtung zunehmend geforscht werden.
Prognostische und prädiktive Bedeutung von CTC
Sowohl durch die Verwendung von Immunhistochemie als auch durch eine Vielzahl von RT-PCR-Verfahren wurde die prognostische Bedeutung von CTC im peripheren Blut für verschiedene Krebserkrankungen gezeigt. Die prognostische sowie auch die prädiktive Bedeutung von CTC bei verschiedenen Krebserkrankungen haben zur FDA-Zulassung der CellSearch®-Technologie geführt.
In einer wegweisenden Studie von Cristofanilli et al. wurde die prognostische sowie auch die prädiktive Bedeutung der Anzahl von CTC im Blut von metastasierten Brustkrebspatientinnen unter Einsatz des CellSearch®-Gerätes nachgewiesen. In einer Follow-up-Studie wurde gezeigt, dass bei jedem Besuch einer unter Behandlung stehenden Patientin die Bestimmung der Anzahl der CTC eine Aussage bezüglich der Prognose und des Ansprechens auf eine Therapie zulässt. Die prognostische Bedeutung der CTC – bestimmt mit dem CellSearch®-System – wurde auch in einer unabhängigen Studie, durchgeführt von Nole und Kollegen, bei 80 Patientinnen mit metastasiertem Brustkrebs bestätigt. Weitere Studien haben die prognostische Relevanz von CTC auch in Patienten mit anderen Tumorarten gezeigt.
Basierend auf diesen und weiteren Studien wurde vorgeschlagen, dass eine serielle Bestimmung von CTC zusätzlich zu den konventionellen Methoden durchgeführt werden sollte, um die Prognose für den Patienten und das Ansprechen auf die Therapie besser überwachen zu können.
Die prognostische Signifikanz der CTC im peripheren Blut von Krebspatienten wurde aber nicht nur mit CellSearch®, sondern auch mit anderen Methoden demonstriert. Gaforio und Kollegen haben beispielsweise zur Anreicherung und Detektion von CTC den Kit von Miltenyi und eine Trennung beruhend auf MACSSäulen verwendet. In einer ähnlichen Analyse haben wir die prognostische Bedeutung von CTC bei Patientinnen mit metastasiertem Brustkrebs bewiesen. Ähnliche Studien wurden auch bei Patienten mit anderen Tumorarten durchgeführt und konnten sowohl mittels PCR als auch mittels Immunhistochemie die prognostische Wertigkeit von CTC nachweisen. All diese Verfahren haben als gemeinsames Merkmal die Verwendung von tumor- und epithelspezifischen Markern, welche in der Regel bei der gesunden Bevölkerung nicht detektiert werden.
Auswirkungen der CTCErkennung für die Therapie
Es gibt zunehmend Beweise, dass der Nachweis von CTC einen klinischen Nutzen hat, insbesondere bei der Überwachung der Wirksamkeit der Therapie von Krebspatienten. Trotzdem ist der Nachweis von CTC noch immer kein Standardvorgehen im Rahmen der Therapieplanung. Nur wenige der aktuell verfügbaren Technologien haben den Grad der Validierung erreicht, wie die von der FDA zugelassene CellSearch®-Methode. Heutzutage ist der mögliche Informationsgewinn durch Verwendung des CTCNachweises nur als ergänzend anzusehen. Der Nachweis von CTC könnte aber potenziell zu einer Änderung der sonst üblichen Vorgehensweise in der Onkologie führen. Derzeit ist die Frage noch unbeantwortet, was in der Klinik zu tun wäre, wenn ein Anstieg der CTC nachgewiesen wurde. Zwar scheint es, dass eine frühe Änderung der Therapie von Nutzen sein könnte, Beweise dafür gibt es aber derzeit noch nicht. Eine wichtige Studie zur Frage der klinischen Validität ist die Studie SWOG-S0500, die vor Kurzem für die Rekrutierung der Patienten geschlossen wurde und in der nächsten Zukunft zeigen sollte, ob die Detektion von CTC einen wichtigen Baustein in der frühen Therapieentscheidung von metastasierten Brustkrebspatientinnen darstellt. Weitere Studien evaluieren die klinische Bedeutung der CTC in frühen Brustkrebsstadien. In der SUCCESS-Studie konnte gezeigt werden, dass CTC bereits bei der Diagnose der Brustkrebserkrankung nachweisbar sind, dass jedoch die Anzahl der Zellen und der Anteil der Patienten mit CTC deutlich niedriger waren. Die Prognose wurde durch das Vorhandensein von 1 Zelle/21,5 ml Blut beeinflusst. Diese Ergebnisse deuten darauf hin, dass die prognostische Aussagekraft der CTC in frühen Stadien der Erkrankung weit weg von der klinischen Anwendbarkeit zu sein scheint. In diesen Stadien ist die Bedeutung der DETECTStudie größer, in welcher, nach positivem HER2/neu-Status von CTC bei Patientinnen mit prinzipiell HER2/neu-negativer Erkrankung, ein Teil der Patientinnen adjuvant Trastuzumab bekommt. Diese Studie könnte wichtige Hinweise zur adjuvanten Behandlung von Patientinnen mit Mammakarzinom bringen.
Nachteilig sind sicher auch die Kosten einer CTC-Bestimmung. Je früher allerdings ein Therapiewechsel durchgeführt und eine nicht wirksame Therapie abgebrochen werden kann, desto eher können auch die Kosten reduziert werden. Dabei wäre nicht nur das Potenzial zur Senkung der Therapiekosten gegeben, sondern auch die Möglichkeit, den Patienten die Nebenwirkungen einer inadäquaten Therapie zu ersparen – was noch wichtiger erscheint. Wenn der CTC-Nachweis dazu verwendet werden kann, eine wirksamere Therapie früher zu bestimmen, sollte sich diese Option im Endeffekt als kostengünstig herausstellen.
Zukünftige Entwicklung
Der Nachweis von CTC und deren Charakterisierung hat enorm an Bedeutung gewonnen. Derzeit besteht ein großes Interesse an neuen Methoden zur Anreicherung und deren weiteren Charakterisierung. Die neuen Detektionsplattformen müssen jedoch noch validiert werden, um den aktuellen Standard der von der FDA zugelassenen CellSearch®- Technologie zu erreichen. Ziel ist es, durch eine Erhöhung der Sensitivität des CTC-Nachweises die Behandlung der Patienten zu optimieren. Des Weiteren könnten durch neuartige Technologien, speziell auf Ebene von Einzelzellen, neue therapeutische Targets identifiziert werden und so zu einer verbesserten Behandlungsstrategie bei Patienten mit Krebs führen.