Jenseits von Staging, Typing und Grading – Molekulare Subtypen beim Mammakarzinom: Klinische Relevanz für Therapieentscheidungen?
Thematisch wurde der Bogen mit der Feststellung gespannt, dass Mammakarzinome zwar eine sehr heterogene Gruppe an Tumoren umfassen, andererseits aber drei Faktoren für die Wahl der adjuvanten Therapie entscheidend sind: der Hormonrezeptor-, Menopausen- und der HER2-Status. Davon ausgehend stellt sich die Frage, ob die endokrine Therapie über die Bestimmung des Hormonrezeptorstatus hinaus weiter individualisiert werden kann bzw. wann eine adjuvante Chemotherapie erforderlich ist. Klassische Faktoren für die Entscheidung zur adjuvanten Chemotherapie sind die Tumorlast (axillärer Lymphknotenstatus, Tumorgröße), das Grading oder das Patientenalter – „wobei die Tumorlast nicht primär eine Information über die Aggressivität der Erkrankung liefert, sondern mehr eine Auskunft darüber gibt, ob eine neoadjuvante oder adjuvante Strategie verfolgt werden soll“ (Professor Harbeck). Soweit möglich, wird heute zuerst an das Target im Tumor und dann an das Risiko gedacht, bzw. tritt die Tumorlast auch hinter die Tumorbiologie zurück, wenn z. B. hormonsensitive Mammakarzinome durch eine endokrine Therapie „einschmelzen“, auch wenn der Tumor groß ist, während auf der anderen Seite HER2-positive Patientinnen Trastuzumab plus Chemotherapie erhalten, auch wenn ihr Tumor klein ist. Chemotherapie wird bei triplenegativen Tumoren empfohlen. Wenn in der großen Gruppe hormonrezeptorpositiver Tumoren nach einem risikobasierten Schema vorgegangen wird und Patientinnen mit höherem Rezidivrisiko zusätzlich eine Chemotherapie erhalten, stellt sich die Frage, welche Patientinnen wirklich von der Chemotherapie profitieren.
Invasions- und Metastasierungsmarker: In den 1990er-Jahren waren Onkologen in Deutschland am Fein-Tuning der Chemotherapie bei nodalnegativen Patientinnen interessiert: bei weniger aggressiven G1-Tumoren wurde keine adjuvante Chemotherapie verabreicht, bei aggressiven G3-Tumoren ja, bei intermediären G2- Tumoren war die Entscheidung fraglich. Auf Arbeiten von Fritz Jänicke geht die Entwicklung der Invasions- und Metastasierungsbiomarker uPA und PAI-1 zurück. In einer Studie aus den 1990er- Jahren („Chemo N0“) wurden lymphknotennegative Patientinnen mit hoher Markerexpression in Chemotherapie vs. Beobachtung randomisiert. Der prognostisch entscheidende Faktor war das Grading, wobei uPA/PAI-1 die Prognose bei intermediärem Risiko verfeinern konnte. G2-Tumoren mit hoher Markerexpression hatten schlechte 10-Jahres-Ergebnisse mit einem doppelt so hohen Rezidivrisiko und profitierten von der Chemotherapie mit einer 50%igen Risikoreduktion. Der Marker wäre mit 200 € kostengünstig, eine Limitationen besteht darin, dass gefrorene Frischbiopsien zur Auswertung erforderlich sind. Laut Professor Harbeck würde etwa ein Drittel der Zentren in Deutschland mit diesem Marker arbeiten, der sich auch als therapeutisches Target eignen könnte, wie derzeit in einer Phase-II-Studie evaluiert wird. Im Rückblick lässt sich festhalten, dass die Chemo-N0-Studie mehrheitlich hormonrezeptorpositive Patientinnen ohne endokrine Therapie inkludierte und dass die HER2-Bestimmung nicht etabliert war, dennoch war es eine prospektive und zum damaligen Zeitpunkt visionär nach dem Biomarkerstatus ausgerichtete Studie. Als Prognosemarker sagt dieser Faktor etwas über die zugrundeliegende Tumorbiologie und gibt Hinweise, wann eine Therapie initiiert werden soll, jedoch noch nicht unbedingt welche: Die Frage der optimalen Chemotherapie war der Nachfolgestudie NNBC-3 vorbehalten, die mit über 4000 Patientinnen neben TAILORx die größte nodalnegative Studie ist und bei 40 % der Patientinnen mit niedrigem uPA/PAI-1 auf Chemotherapie verzichtete. Ein vorbildlich evaluierter Biomarker und 10 Jahre Nachbeobachtung mit zwischenzeitlich neuen Therapiestandards ergeben in Summe einen langen Atem. Wünschenswert wäre vielleicht, wenn innovative Wege der Biomarkerevaluierung zugleich mit einer Beschleunigung des Fortschritts einhergingen, was einen breiteren Einsatz ermöglichen könnte.
Genexpressionsprofile: Ein andere Option ist die Einschätzung des Rezidivrisikos auf Basis von Genprofilen wie MammaPrint ® (70 Gene) oder oncotype DX® (21 Gene), die Kosten hierfür betragen etwa 3000 €. Oncotype DX® hat eine prognostische Wertigkeit über den Lymphknotenstatus hinweg, was laut Professor Harbeck dann interessant ist, wenn das Konzept darin besteht, dass man lymphknotenpositive und -negative Patientinnen nicht unterschiedlich behandelt, d. h. wenn die Tumorlast hinter die Tumorbiologie zurücktritt und man sich weniger am Lymphknotenstatus als „Target“ für Chemotherapie orientiert. In diesem Konzept würde man bei hormonrezeptorpositiven Patientinnen mit niedrigem Rezidivrisiko z. B. selbst bei Vorliegen von 1–3 positiven Lymphknoten auf Chemotherapie verzichten. Ein Test, der nun nach Deutschland kommt und in Kooperation mit der ABCSG (Univ.-Doz. Dr. Martin Filipits) evaluiert wird, ist der EndoPredict-Test für hormonrezeptorpositive, HER2-negative Patientinnen. Das Validierungskollektiv stammt aus den ABCSG-Studien 6 (n = 378) und 8 (n = 1324). Grundsätzlich wurde festgehalten, dass all diese Tests Auskunft geben über eine hochproliferative Brustkrebserkrankung mit hohem Rezidivrisiko bei relativer Resistenz gegenüber endokrinen Therapien bzw. relativer Sensitivität gegenüber Chemotherapien.
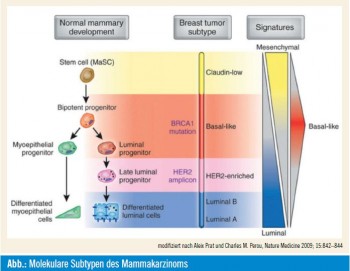
Intrinsische Subtypen: Die derzeit klinisch relevanten molekularen Subtypen des Mammakarzinoms unterscheiden zwischen hochgradig hormonsensitiven Tumoren: Luminal A; weniger hormonsensitiven Tumoren, auch wenn sie hormonrezeptorpositiv sind: Luminal B; sowie HER2 und basal-like und wurden in den St.-Gallen-Richtlinien 2011 als prinzipiell therapieentscheidend berücksichtigt. So scheinen Luminal-B-Tumoren gegenüber Luminal-A-Tumoren mehr von Chemotherapie zu profitieren. Die Unterscheidungen sind klinisch relevant; die Frage ist, wie man Genarrays allen Patientinnen zukommen lässt. Alternativ ließen sich die molekularen Subtypen vielleicht auch immunhistochemisch abbilden: So ließe sich eine Entscheidung zur Chemotherapie über den Proliferationsmarker Ki-67 (Ki für Kiel in Norddeutschland) ableiten, beispielsweise bei einem Cut-off-Wert von 14 %, der aber in dieser Form nicht validiert ist. Wenig proliferativ wären 5 %, hochproliferativ 25 %, dazwischen gibt es Grauzonen. An dieser Stelle wurde festgehalten, dass heute bereits ein Test für molekulare Subtypen verfügbar ist, der „Molecular Subtype Predictor“, genannt PAM50, der auf Basis von 50 Genen die klinisch relevanten molekularen Subtypen auch an Paraffinmaterial bestimmen kann.
WSG-Plan-B-Studie, SABCS 2011: Im Sinne einer klinischen Zusammenfassung des molekularen „Profilings“ wurde von Professor Harbeck die WSGPlan- B-Studie präsentiert, in der hormonrezeptorpositive Patientinnen entsprechend dem oncotype-Rezidiv-Score randomisiert wurden: Patientinnen mit niedrigem Rezidivrisiko wurden auch bei Vorliegen von bis zu 3 positiven Lymphknoten allein mit endokriner Therapie behandelt, was in Deutschland eine Premiere darstellt. Hormonrezeptorpositive Patientinnen mit hohem Rezidiv-Score und hormonrezeptornegative Patienten wurden in unterschiedliche Chemotherapiearme randomisiert. Die Studie rekrutierte schnell (mehr als 3000 Patientinnen in 2 Jahren) und war die erste ihrer Art, die am San Antonio Breast Cancer Symposium 2011 als reine Biomarkeruntersuchung noch ohne Wirksamkeitsdaten präsentiert und diskutiert wurde: Bei etwa 20 % der Patienten mit niedrigem Rezidivrisiko wurde auf eine Chemotherapie verzichtet. Der Vergleich mit verschiedenen Risikoprädiktoren ergab eine gute Konkordanz vor allem im Hochrisikobereich, wobei laut Professor Harbeck die Ergebnisse der oncotype-Auswertungen sowohl von Patientinnen als auch von Ärzten sehr gut angenommen wurden (88 % Akzeptanzrate).
Konzepte neuer Brustkrebsstudien: Die Zielsetzung neuer Studien besteht ausblickend darin, mit Hilfe von Verlaufsmarkern wie Ki-67 bereits nach einer kurzen (2-wöchigen) präoperativen Therapiephase zugleich auch den Erfolg der adjuvanten Langzeittherapie vorherzusagen. Ki-67 ist in diesem Zusammenhang ein biologischer Marker für die Therapiesensitivität und erfüllt zugleich prognostische und prädiktive Kriterien. In der von Professor Nadja Harbeck und Professor Nitz (Mönchengladbach) geleiteten WSG-ADAPT-Studie, die in Deutschland durchaus kontroversiell diskutiert wird, werden hormonrezeptorpositive Patientinnen in der präoperativen Phase nach dem Ki-67-Ansprechen evaluiert und in drei Risikogruppen unterteilt: Niedrigrisikopatientinnen erhalten die endokrine Therapie, Hochrisikopatientinnen zusätzlich eine Chemotherapie und Patientinnen mit intermediärem Risiko werden je nach „Proliferationssignatur“ entweder der Gruppe mit hohem oder niedrigem Rezidivrisiko zugeordnet, sodass man bei einem Teil auf Chemotherapie verzichten könnte. Ein anderer Score, der „präoperative endokrine Prognoseindex“ (PEPI), der Tumorgröße, Nodalstatus, Östrogenrezeptorexpression und Ki-67 inkludiert, soll ebenfalls nach einer relativ kurzen (3-monatigen) präoperativen Therapiephase eine Aussage über die Langzeitprognose gestatten. So wird in der ACOSOG- Z1031-Studie die endokrine Therapie adjuvant dann weitergeführt, wenn Ki-67 in der präoperativen Phase niedrig war (Ansprechen auf die endokrine Therapie) und wenn zusätzlich auch der PEPI-Score niedrig ist (gute Prognose unter alleiniger endokriner Therapie) – oder es wird zusätzlich eine adjuvante Chemotherapie verabreicht, wenn der Ki- 67-Index initial zwar niedrig war, aber der PEPI-Score hoch ist (höhere Rezidivwahrscheinlichkeit unter alleiniger endokriner Therapie).
Fazit: Laut Professor Nadia Harbeck sind molekulare Subtypen des Mammakarzinoms derzeit Gegenstand intensiver Forschung, während die Histopathologie nach wie vor den Goldstandard in der klinischen Routine darstellt. Zusätzlich zu den klassischen Prognosefaktoren können Proliferationsmarker die Therapieentscheidung konkretisieren, was aber durch klinische Validierungsstudien weiter abgesichert werden müsste. Als übergeordnetes Ziel ließe sich noch formulieren, dass nicht jene Patientinnen die meiste Therapie erhalten, die das größte Rezidivrisiko haben, sondern jene Patientinnen, die am meisten von einer Therapie profitieren – weil Nebenwirkungen von einer Patientin, deren geringes Rezidivrisiko von 15 auf 5 % gesenkt wird, eher toleriert werden als von einer Patientin, deren hohes Rezidivrisiko um 5 % gesenkt wird.